
Учебник по химии для 10 класса Габриеляна и Остроумова — это понятное и структурированное издание, которое помогает школьникам освоить основные химические понятия и законы. В нем есть теоретический материал, практические задания и лабораторные работы, что способствует глубокому пониманию предмета. Учебник подходит для эффективной подготовки к экзаменам и развития научного мышления.
ГДЗ по Химии 10 Класс Практическая работа 2 Углубленный Уровень Габриелян, Остроумов — Подробные Ответы
Получение и свойства метана
В пробирку поместите выданную учителем смесь безводного ацетата натрия и натронной извести в соотношении 1:2. Пробирку закройте пробкой с газоотводной трубкой и закрепите наклонно вверх в лапке штатива. Содержимое пробирки нагрейте в пламени спиртовки. Напишите уравнение протекающей реакции.
Выделяющийся газ пропустите через подкисленный раствор перманганата калия и бромную воду (если она отсутствует, можно воспользоваться аналогом — йодной водой, которую готовят, приливая 2–3 капли спиртовой настойки иода к 1–2 мл воды). Что наблюдаете?
Выделяющийся газ подожгите. Обратите внимание на характер горения. Напишите уравнение реакции горения метана.
Вопросы
1. Почему не наблюдается изменения окраски раствора перманганата калия и бромной воды при пропускании через них метана?
Перманганат калия и бром в составе бромной воды — сильные окислители. Однако в метане нет кратных связей или очень длинных цепочек, которые можно было бы окислить. Поэтому реакция окисления не протекает и обесцвечивания не наблюдается.
2. О чём свидетельствует характер пламени метана?
Метан — основной компонент природного газа, который горит голубым пламенем. Отсутствие коптящего дымного пламени свидетельствует об относительно низком массовом содержании углерода в молекуле метана.
Получение и свойства этилена (этена)
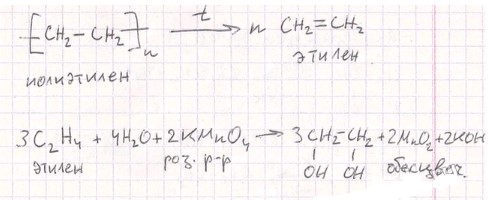
Пробирку на 1/4 заполните гранулами технического полиэтилена (содержащего следы катализатора Циглера–Натта), закройте пробкой с газоотводной трубкой и укрепите в лапке штатива горизонтально с небольшим наклоном (рис. 85). Содержимое нагрейте на пламени спиртовки. Напишите уравнение реакции деполимеризации полиэтилена.
Выделяющийся этилен пропустите через подкисленный раствор перманганата калия и бромную (йодную) воду. Что наблюдаете? Напишите уравнения протекающих реакций.
Переверните пробку в пробирке газоотводной трубкой вверх (осторожно, горячая пробирка!) и подожгите выделяющийся этилен. Обратите внимание на характер пламени этилена, сравните его с пламенем метана. Напишите уравнение реакции горения этилена.
Выделяющийся газ не обесцвечивает раствор перманганата калия и бромную воду, но поддерживает горение: горит голубоватым пламенем.
Вопросы
1. Чем обусловлен различный характер горения метана и этилена?
В отличие от метана, который горит ясным голубоватым пламенем, этилен горит более ярким пламенем, что свидетельствует о большем массовом содержании углерода в молекуле этилена.
2. Какими способами получают этилен в лаборатории и в промышленности? Напишите уравнения реакций.
3. Почему этилен обесцвечивает растворы бромной воды и перманганата калия?
Этен содержит двойную связь, которая легко окисляется перманганатом или бромом, поэтому их водные растворы обесцвечиваются в присутствии этилена.
Получение и свойства ацетилена
В сухой прибор для получения газов поместите 2 кусочка карбида кальция, завёрнутые в фильтровальную бумагу. С помощью пипетки добавьте в пробирку несколько капель насыщенного раствора хлорида натрия (с водой реакция протекает слишком бурно). Закройте прибор пробкой с газоотводной трубкой. Напишите уравнение реакции карбида кальция с водой.
Выделяющийся газ пропустите через подкисленный раствор перманганата калия и бромную воду. Что наблюдаете?
Подожгите газ у конца газоотводной трубочки. Отметьте характер горения ацетилена.
По окончании опыта, после того как перестал выделяться ацетилен, выньте из пробирки пробку с газоотводной трубкой и добавьте в пробирку каплю раствора фенолфталеина. Что наблюдаете?
Раствор перманганата калия и бромная вода обесцвечиваются.
Ацетилен поддерживает горение и горит коптящим пламенем.
Фенолфталеин даёт малиновое окрашивание.
Вопросы
1. Зачем кусочки карбида кальция заворачивают в фильтровальную бумагу?
Реакция карбида с водой протекает очень бурно, чтобы предотвратить разбрызгивание реакционной смеси, используют своеобразную изоляцию, которая уменьшает площадь соприкосновения реагентов.
2. Почему ацетилен обесцвечивает бромную воду и раствор перманганата калия?
Ацетилен содержит тройную связь, которая легко окисляется перманганатом и бромом, в результате чего растворы обесцвечиваются.
3. Почему ацетилен горит коптящим пламенем?
В ацетилене относительно высокая массовая доля углерода, который при сгорании ацетилена частично превращается в уголь и даёт коптящее пламя.
4. Почему фенолфталеин изменяет окраску при добавлении к продуктам реакции гидролиза карбида кальция?
При получении ацетилена из карбида кальция образуется побочный продукт — гидроксид кальция: его остатки обуславливают щелочную среду, о чём свидетельствует изменение окраски фенолфталеина.
Получение и свойства метана
Реакция получения метана происходит при нагревании смеси безводного ацетата натрия (CH₃COONa) с натронной известью (NaOH):
Выделяющийся газ не меняет окраску раствора перманганата калия и бромной воды, но поддерживает горение, горит голубоватым пламенем.
- Перманганат калия и бром в составе бромной воды являются сильными окислителями. Однако в молекуле метана отсутствуют кратные связи или длинные цепочки, которые можно было бы окислить. Поэтому реакция окисления не происходит, и раствор не обесцвечивается.
- Метан — основной компонент природного газа, который горит голубым пламенем. Отсутствие коптящего дымного пламени указывает на относительно низкое массовое содержание углерода в молекуле метана.
Вывод: устойчивость метана к растворам сильных окислителей подтверждает его непредельный характер.
Получение и свойства этилена (этена)
C₂H₄ + Br₂ → C₂H₄Br₂ (этилен + бурый р-р → дибромэтан; раствор обесцвечивается)
CH₂=CH₂ + 3O₂ → 2CO₂↑ + 2H₂O
1) В отличие от метана, который горит ясным голубоватым пламенем, этилен горит более ярким пламенем, что указывает на большее массовое содержание углерода в молекуле этилена.
2) В промышленности:
- дегидрирование этана:
CH₃–CH₃ → t°, кат. → CH₂=CH₂ + H₂ - гидрирование ацетилена:
HC≡CH + H₂ → Ni, Pt → CH₂=CH₂
В лаборатории:
- деполимеризация полиэтилена (термическое разрушение):
- дегидратация этанола:
CH₂(H)-CH₂(OH) —(170°C, H₂SO₄(к))—> CH₂=CH₂ + H₂O
- дегидрогалогенирование хлорэтана:
CH₂(H)-CH₂(Cl) —(KOH)—> CH₂=CH₂
(побочные продукты: -KCl, -H₂O) - дегалогенирование 1,2-дибромэтана:
CH₂(Br)-CH₂(Br) + Zn —(t)—> CH₂=CH₂ + ZnBr₂
3) Этилен обесцвечивает растворы бромной воды и перманганата калия, так как содержит двойную связь, которая легко вступает в реакции окисления и присоединения.
Вывод: этилен обесцвечивает растворы перманганата калия и бромную воду, что подтверждает наличие в его молекуле кратной двойной связи. Пламя этилена ярче, чем у метана, что свидетельствует о большем содержании углерода.
Получение и свойства ацетилена
CaC₂ + 2H₂O → Ca(OH)₂ + C₂H₂↑
Раствор перманганата калия и бромная вода при взаимодействии с ацетиленом обесцвечиваются.
Ацетилен поддерживает горение и образует коптящее пламя.
Фенолфталеин при взаимодействии с раствором ацетилена приобретает малиновый цвет.
- Реакция карбида кальция с водой протекает очень интенсивно. Чтобы избежать разбрызгивания, применяют специальную изоляцию, уменьшающую площадь контакта реагентов.
- В молекуле ацетилена присутствует тройная связь, которая легко окисляется перманганатом калия и бромом, что приводит к обесцвечиванию растворов.
- Ацетилен содержит относительно высокую массовую долю углерода, из-за чего при горении часть углерода превращается в сажу, дающую коптящее пламя.
- При получении ацетилена из карбида кальция образуется побочный продукт — гидроксид кальция, который создаёт щелочную среду, что подтверждается изменением окраски фенолфталеина.
Вывод: ацетилен — это ненасыщенное углеводородное соединение с высокой массовой долей углерода в составе.
Введение в логику эксперимента
В данной работе исследуется зависимость химических свойств углеводородов от их строения. Мы сравниваем три типа соединений: алканы (метан), алкены (этилен) и алкины (ацетилен). Главное различие между ними — кратность связи между атомами углерода. Одинарная связь обеспечивает стабильность, а двойная и тройная связи делают молекулы «ненасыщенными» и готовыми к активным превращениям.
Часть 1. Получение и свойства метана (CH₄)
Метан — это «крепость» среди углеводородов. Все его связи одинарные (σ-связи), что определяет его химическую инертность при обычных условиях.
Ход опыта и уравнения
В лаборатории метан получают методом декарбоксилирования (реакция Дюма):
- Уравнение получения:
CH₃COONa (тв.) + NaOH (тв.) —(t°)—> CH₄↑ + Na₂CO₃
- Уравнение горения:
CH₄ + 2O₂ → CO₂↑ + 2H₂O
Ответы на вопросы по метану:
- Почему нет реакции с бромной водой (Br₂) и марганцовкой (KMnO₄)?
Метан — предельный (насыщенный) углеводород. В его молекуле нет кратных связей, которые могли бы легко разорваться для присоединения новых атомов. Его электроны прочно удерживаются в одинарных связях, поэтому метан не вступает в реакции окисления при обычных условиях. Растворы сохраняют свой цвет. - О чем говорит характер пламени метана?
Метан горит прозрачным голубоватым пламенем. Это свидетельствует о полном сгорании углерода. Так как массовая доля углерода в метане минимальна (75%), кислорода воздуха достаточно для его мгновенного окисления до углекислого газа, без образования раскаленных частиц сажи.
Часть 2. Получение и свойства этилена (C₂H₄)
Ниже приведен подробный разбор физико-химических свойств этилена и способов его получения с использованием всех необходимых химических уравнений.
1. Различие в характере горения метана и этилена
Разный характер горения обусловлен массовой долей углерода в молекулах этих газов.
- Метан (CH₄): Содержит 75% углерода. Кислорода воздуха достаточно для его полного и быстрого окисления. Пламя ясное, голубоватое, без копоти и яркого свечения.
Уравнение горения метана:
CH₄ + 2O₂ → CO₂↑ + 2H₂O - Этилен (C₂H₄): Массовая доля углерода выше (85,7%). При горении в обычных условиях часть углерода не успевает мгновенно превратиться в газ. Образуются микроскопические частицы свободного углерода, которые раскаляются в пламени и создают яркое свечение.
Уравнение горения этилена:
CH₂=CH₂ + 3O₂ → 2CO₂↑ + 2H₂O
2. Способы получения этилена в лаборатории и промышленности
Этилен можно получить различными путями, используя как органическое сырье, так и продукты переработки нефти.
Лабораторные способы:
В лаборатории акцент делается на чистоту продукта и доступность реагентов.
- Дегидратация этанола (отщепление воды):
- Дегидрогалогенирование хлорэтана (спиртовым раствором щелочи):
CH₃-CH₂-Cl + KOH (спирт.) → CH₂=CH₂ + KCl + H₂O - Деполимеризация полиэтилена (термическое разрушение):
- Дегалогенирование 1,2 дибромэтана
Промышленные способы:
В промышленности используются крупнотоннажные процессы переработки углеводородов.
- Дегидрирование этана (отщепление водорода):
CH₃-CH₃ —(t°, кат)—> CH₂=CH₂ + H₂ - Гидрирование ацетилена (присоединение водорода):
HC≡CH + H₂ —(Ni, Pt)—> CH₂=CH₂
3. Причина обесцвечивания растворов Br₂ и KMnO₄
Этилен (этен) является непредельным углеводородом. Его молекула содержит двойную связь, состоящую из прочной σ-связи и слабой π-связи. Именно эта слабая связь легко разрывается, позволяя этилену вступать в реакции присоединения и окисления.
- С бромной водой: Происходит реакция присоединения. Молекула брома «встраивается» по месту разрыва двойной связи, образуя бесцветный дибромэтан.
Уравнение: C₂H₄ + Br₂ → C₂H₄Br₂ - С перманганатом калия: Происходит мягкое окисление (реакция Вагнера). Марганцовка расходуется на образование двухатомного спирта, из-за чего фиолетовый раствор обесцвечивается и выпадает бурый осадок.
Уравнение:
Итоговый вывод
В ходе выполнения заданий мы подтвердили, что наличие кратной (двойной) связи делает этилен химически активным веществом, способным к качественным реакциям обесцвечивания. Также было установлено, что повышенное содержание углерода в молекуле этилена по сравнению с метаном напрямую влияет на яркость его пламени при горении.
Часть 3. Получение и свойства ацетилена (C₂H₂)
Ацетилен (этин) содержит тройную связь (C≡C). Это «энергетический концентрат» с самым высоким содержанием углерода среди газов.
Ход опыта и уравнения
Получение из карбида кальция:
- Уравнение получения:
CaC₂ + 2H₂O → C₂H₂↑ + Ca(OH)₂
Ответы на вопросы по ацетилену:
- Зачем при получении ацетилена используют фильтровальную бумагу?
Реакция карбида с водой протекает очень бурно. Бумага (или вата) замедляет контакт воды с карбидом, позволяя газу выделяться равномерно и предотвращая разбрызгивание щелочной смеси. - Почему ацетилен обесцвечивает растворы Br₂ и KMnO₄?
Тройная связь ацетилена еще более активна, чем двойная. Она легко разрывается, присоединяя бром или окисляясь марганцовкой. Это подтверждает его непредельный характер. - Почему пламя ацетилена сильно коптящее?
Доля углерода в ацетилене огромна (92,3%). Кислорода в воздухе не хватает для его полного сгорания, поэтому избыток углерода выделяется в виде густой черной сажи (копоти). - Почему фенолфталеин в растворе после реакции стал малиновым?
В ходе реакции, помимо газа, образуется гидроксид кальция — Ca(OH)₂. Это сильное основание (щелочь). В щелочной среде индикатор фенолфталеин всегда меняет цвет на малиновый.
Итоговый вывод
В ходе работы мы установили, что химическая активность углеводородов растет с увеличением кратности связи.
| Вещество | Тип связи | Реакция с окислителями | Характер пламени |
|---|---|---|---|
| Метан | Одинарная | Не реагирует | Голубое, прозрачное |
| Этилен | Двойная | Обесцвечивает | Яркое, светящееся |
| Ацетилен | Тройная | Обесцвечивает | Коптящее (сажа) |
Главный вывод: качественным признаком непредельных соединений является их способность обесцвечивать бромную воду и раствор перманганата калия. Характер пламени же напрямую зависит от массовой доли углерода в молекуле.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.


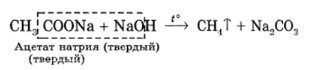


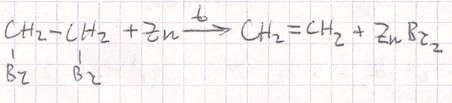
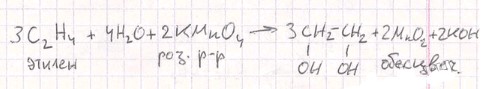


Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!