
Учебник «Химия» для 10 класса, написанный Габриеляном и Остроумовым, является надежным и современным пособием, которое помогает старшеклассникам углубить свои знания в области химии. Книга отличается четкой структурой, логичным изложением материала и наглядными иллюстрациями, что способствует лучшему усвоению сложных тем. В ней рассматриваются ключевые концепции, такие как органическая и неорганическая химия, а также основы химической кинетики и термодинамики. Учебник не только помогает подготовиться к экзаменам, но и вдохновляет на дальнейшее изучение науки, делая процесс обучения увлекательным и доступным для каждого ученика.
ГДЗ по Химии 10 Класс Параграф 15 Вопрос 6 Габриелян, Остроумов — Подробные Ответы
В чем сходство и различие химических свойств неорганических и органических кислот? Ответ подтвердите уравнениями химических реакций.
Общие свойства органических и неорганических кислот заключаются в их реакции с металлами (до водорода в ряду напряжений), основаниями (процесс нейтрализации) и солями (если при этом образуется газ или осадок):
Zn + 2HCl = ZnCl₂ + H₂↑
Zn + 2CH₃COOH = Zn(CH₃COO)₂ + H₂↑
NaOH + HCl = NaCl + H₂O
NaOH + CH₃COOH = CH₃COONa + H₂O
K₂CO₃ + 2HCl = 2KCl + H₂O + CO₂↑
K₂CO₃ + 2CH₃COOH = 2CH₃COOK + H₂O + CO₂↑
K₂SiO₃ + 2HCl = H₂SiO₃↓ + 2KCl
K₂SiO₃ + 2CH₃COOH = H₂SiO₃↓ + 2CH₃COOK
Отличительной особенностью органических кислот являются реакции окисления (при полном сгорании образуются углекислый газ и вода) и реакции этерификации (взаимодействие с спиртами с образованием сложных эфиров):
CH₃COOH + 2O₂ → 2H₂O + 2CO₂
или
CH₃COOH + C₂H₅OH ⇄ CH₃COOC₂H₅ + H₂O
(Уксусная кислота + этиловый спирт ⇄ этиловый эфир уксусной кислоты + вода)
Химические свойства органических и неорганических кислот имеют как фундаментальные сходства, обусловленные наличием подвижного атома водорода, так и существенные различия, связанные с особенностями строения органических молекул.
Общие свойства: Сходство кислот
Органические кислоты (на примере уксусной CH₃COOH) и неорганические кислоты (на примере соляной HCl) одинаково реагируют с активными металлами, основаниями и солями.
1. Взаимодействие с металлами
Оба типа кислот реагируют с металлами, стоящими в ряду напряжений до водорода. В результате образуется соль и выделяется свободный водород.
Zn + 2HCl = ZnCl₂ + H₂↑
Zn + 2CH₃COOH = Zn(CH₃COO)₂ + H₂↑
2. Реакция нейтрализации (с основаниями)
Кислоты взаимодействуют с растворимыми основаниями (щелочами), образуя соль и воду.
NaOH + HCl = NaCl + H₂O
NaOH + CH₃COOH = CH₃COONa + H₂O
3. Реакции с солями (выделение газа)
При взаимодействии с карбонатами кислоты вытесняют более слабую и летучую угольную кислоту, которая тут же распадается на воду и углекислый газ.
K₂CO₃ + 2HCl = 2KCl + H₂O + CO₂↑
K₂CO₃ + 2CH₃COOH = 2CH₃COOK + H₂O + CO₂↑
4. Реакции с солями (образование осадка)
Кислоты могут вытеснять другие кислоты из их солей, если образуется нерастворимый осадок. Например, при реакции с силикатами выпадает кремниевая кислота.
K₂SiO₃ + 2HCl = H₂SiO₃↓ + 2KCl
K₂SiO₃ + 2CH₃COOH = H₂SiO₃↓ + 2CH₃COOK
Отличительные свойства органических кислот
В отличие от минеральных кислот, органические соединения способны к реакциям горения и образованию сложных эфиров.
1. Реакция окисления (горение)
Органические кислоты состоят из углеродного скелета, поэтому они способны полностью сгорать в кислороде до углекислого газа и воды.
CH₃COOH + 2O₂ → 2H₂O + 2CO₂
2. Реакция этерификации
Это уникальное свойство органических кислот — взаимодействие со спиртами с образованием сложных эфиров. Реакция протекает в присутствии катализатора (концентрированной серной кислоты H₂SO₄) и является обратимой.
CH₃COOH + C₂H₅OH ⇄ CH₃COOC₂H₅ + H₂O
(Уксусная кислота + этиловый спирт ⇄ этиловый эфир уксусной кислоты + вода)
Итоговое резюме
Сходство кислот проявляется в их ионных реакциях, где ключевую роль играет катион водорода. Различие же заключается в молекулярных превращениях: органические кислоты могут окисляться (гореть) и вступать в специфические взаимодействия с другими органическими веществами (спиртами), что нехарактерно для большинства неорганических кислот.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.


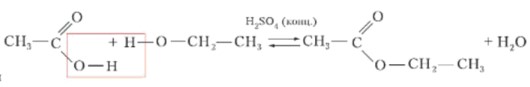


Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!