
Учебник «Химия» для 10 класса, написанный Габриеляном и Остроумовым, является надежным и современным пособием, которое помогает старшеклассникам углубить свои знания в области химии. Книга отличается четкой структурой, логичным изложением материала и наглядными иллюстрациями, что способствует лучшему усвоению сложных тем. В ней рассматриваются ключевые концепции, такие как органическая и неорганическая химия, а также основы химической кинетики и термодинамики. Учебник не только помогает подготовиться к экзаменам, но и вдохновляет на дальнейшее изучение науки, делая процесс обучения увлекательным и доступным для каждого ученика.
ГДЗ по Химии 10 Класс Параграф 2 Вопрос 5 Габриелян, Остроумов — Подробные Ответы
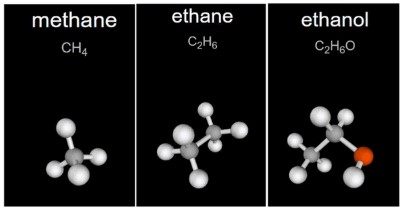
Найдите в Интернете и установите на свой компьютер программу построения 3D-моделей молекул органических веществ. Постройте модели молекул метана, этана, этилового спирта. Какие возможности предоставляет виртуальное моделирование для изучения химического строения веществ?
Применение программ для создания 3D-моделей молекул органических соединений даёт возможность наглядно представить информацию о качественном и количественном составе вещества: измерить длину химических связей, увидеть относительные размеры атомов и определить геометрическую форму молекулы.
Ниже приведены примеры веб-приложений, предназначенных для построения 3D-моделей молекул:
https://phet.colorado.edu/sims/html/build-a-molecule/latest/build-a-molecule_en.html
https://marvinjs-demo.chemaxon.com/latest/demo.html
1. Подходящая программа для построения 3D-моделей
Для построения 3D-молекул можно использовать как устанавливаемые программы, так и веб-приложения (работают прямо в браузере). Вариант с веб-приложением удобен тем, что ничего не нужно настраивать: сразу вводите формулу или рисуете структуру и получаете объёмную модель.
Примеры веб-приложений для 3D-моделирования молекул:
MolView https://molview.org/
PhET Build a Molecule https://phet.colorado.edu/sims/html/build-a-molecule/latest/build-a-molecule_en.html
Marvin JS Demo https://marvinjs-demo.chemaxon.com/latest/demo.html
Идея у всех похожая: задаёте состав или строение, а программа строит объёмную геометрию и позволяет её вращать, измерять и менять отображение.
2. Как построить 3D-модели метана, этана и этилового спирта
Метан CH₄
Сначала создаётся атом углерода, к которому добавляются четыре атома водорода. Программа автоматически разместит связи так, чтобы модель соответствовала реальной устойчивой геометрии метана — тетраэдр. Это означает, что четыре связи C–H направлены в разные стороны максимально равномерно, а углы между ними близки к тетраэдрическим. В 3D-режиме это особенно хорошо видно: водороды не лежат в одной плоскости, а занимают вершины тетраэдра вокруг углерода.
Этан C₂H₆
Создаётся цепь из двух атомов углерода, между ними связь C–C, затем каждый углерод дополняется водородами до четырёх связей. В объёмной модели становится видно сразу два важных момента.
Первый: вокруг каждого углерода геометрия снова тетраэдрическая, потому что каждый углерод образует четыре одинарные связи.
Второй: появляется возможность рассматривать пространственное расположение групп при вращении вокруг одинарной связи C–C. Виртуальная модель позволяет поворачивать фрагменты относительно друг друга и видеть разные конформации, например, когда водороды разнесены максимально и когда оказываются ближе друг к другу. На плоской формуле это заметить трудно, а в 3D это видно мгновенно.
Этиловый спирт (этанол) C₂H₆O, структура CH₃–CH₂–OH
Строится углеродная цепь из двух атомов C–C, затем ко второму углероду присоединяется атом кислорода, а к кислороду — атом водорода, образующий группу –OH. Далее добавляются недостающие водороды к углеродам.
После перехода в 3D можно увидеть, что:
- углеродные атомы опять имеют тетраэдрическое окружение;
- кислород в группе –OH создаёт выступающий фрагмент, который заметно меняет форму молекулы и её полярность;
- становится наглядно, где именно расположена функциональная группа –OH, из-за которой этанол по свойствам резко отличается от этана, хотя углеродный скелет похож.
3. Какие возможности даёт виртуальное моделирование для изучения химического строения
Визуализация формы молекулы и пространственного расположения атомов
На бумаге структурная формула часто плоская, а настоящая молекула объёмная. Виртуальная модель показывает, что атомы не лежат в одной плоскости, а занимают определённые положения в пространстве. Это особенно важно для понимания тетраэдрического строения вокруг атома углерода и различий между молекулами с разными группами.
Наглядное отображение длин связей и углов между ними
Многие программы позволяют измерять длины связей и валентные углы. Это помогает связать теорию, например, представления о геометрии связей, с реальной моделью, а также сравнивать разные вещества: метан, этан и этанол будут отличаться не только составом, но и деталями геометрии вокруг разных атомов.
Понимание конформаций и вращения вокруг одинарных связей
На примере этана хорошо видно, что вокруг одинарной связи возможны повороты, и молекула может принимать разные пространственные формы — конформации. В 3D это можно показать буквально вращением фрагмента и наблюдением, как меняется взаимное расположение атомов.
Различение классов веществ по функциональным группам
Этан и этанол отличаются наличием кислорода и группы –OH. В 3D это не просто буква O в формуле, а конкретный участок молекулы, который меняет форму, распределение электронов и характер взаимодействий. Поэтому виртуальная модель помогает понять, почему вещества разных классов — алканы и спирты — по-разному реагируют и имеют разные свойства.
Сравнение изомеров и объяснение различий их свойств
Если построить два вещества с одинаковой молекулярной формулой, но разным строением, в 3D будет видно, что изменился порядок соединения атомов или пространственная конфигурация. Это позволяет наглядно объяснить, почему изомеры могут иметь разные температуры кипения, растворимость и химическую активность — у них различается строение и форма молекулы.
Моделирование взаимодействий и представления о полярности
Во многих моделях можно включить отображение частичных зарядов, поверхности электронной плотности или хотя бы понять полярность качественно по наличию атомов типа O и распределению связей. На примере этанола становится ясно, что участок –OH более активный и полярный, чем углеводородная часть, и это связано именно со строением молекулы.
Итоговая мысль такая: виртуальное моделирование делает химическое строение видимым. Оно помогает перейти от условной плоской записи к пониманию реальной пространственной формы молекулы, а значит — лучше объясняет, почему вещества с разным строением ведут себя по-разному и почему наличие определённых групп, например –OH, радикально меняет химические свойства.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.




Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!