
Учебник «Химия» для 10 класса, написанный Габриеляном и Остроумовым, является надежным и современным пособием, которое помогает старшеклассникам углубить свои знания в области химии. Книга отличается четкой структурой, логичным изложением материала и наглядными иллюстрациями, что способствует лучшему усвоению сложных тем. В ней рассматриваются ключевые концепции, такие как органическая и неорганическая химия, а также основы химической кинетики и термодинамики. Учебник не только помогает подготовиться к экзаменам, но и вдохновляет на дальнейшее изучение науки, делая процесс обучения увлекательным и доступным для каждого ученика.
ГДЗ по Химии 10 Класс Параграф 4 Вопрос 5 Габриелян, Остроумов — Подробные Ответы
Сравните этан и этилен по следующим признакам:
а) качественный и количественный состав;
б) строение молекул;
в) химические свойства.
| Этан | Этилен |
| Качественный и количественный состав | |
| C2H6 | C2H4 |
| Строение молекул | |
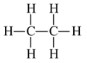 | 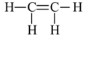 |
| Химические свойства | |
| Этан: Горение: Дегидрирование: Галогенирование: Этилен: Горение: Гидрирование: Галогенирование: Гидрогалогенирование: Полимеризация: Обесцвечивание раствора перманганата калия: | |
а) Качественный и количественный состав
Этан и этилен состоят из одних и тех же элементов, то есть качественный состав одинаковый: в обоих случаях это углерод и водород.
Количественный состав различается по числу атомов водорода при одинаковом числе атомов углерода. Для этана формула C₂H₆: в молекуле 2 атома C и 6 атомов H. Для этилена формула C₂H₄: в молекуле 2 атома C и 4 атома H. Это сразу показывает, что этан более «насыщен» водородом, а этилен имеет меньшую степень насыщения.
б) Строение молекул
Этан относится к алканам и имеет только одинарную связь между атомами углерода: H₃C–CH₃. Одинарная связь C–C означает, что каждый атом углерода уже «насыщен» связями, поэтому в молекуле нет кратных связей и она менее реакционноспособна в реакциях присоединения.
Этилен относится к алкенам и имеет двойную связь между атомами углерода: H₂C=CH₂. Двойная связь состоит из более прочной σ-связи и дополнительной π-связи, причём именно π-связь легче разрушается при взаимодействии с реагентами. Поэтому для этилена характерны реакции присоединения по месту двойной связи.
в) Химические свойства
1. Горение (окисление кислородом)
И этан, и этилен при полном сгорании дают CO₂ и H₂O, потому что это углеводороды. Разница в коэффициентах связана с разным количеством водорода в молекулах.
Этан:
2C₂H₆+7O₂→4CO₂↑+6H₂O
Этилен:
C₂H₄+3O₂→2CO₂↑+2H₂O
Коэффициенты подбирают так, чтобы число атомов C и H в продуктах соответствовало исходным веществам, а затем уравнивают кислород.
2. Реакции с участием водорода (гидрирование и дегидрирование)
Этан (насыщенный) может отдавать водород при нагревании на катализаторе: это дегидрирование, которое приводит к появлению двойной связи и образованию этилена:
CH₃–CH₃ → CH₂=CH₂+H₂ (обычно 400–600°C, катализатор Cr₂O₃)
Этилен (ненасыщенный) легко присоединяет водород по двойной связи, потому что π-связь разрывается и образуется насыщенное соединение — этан:
CH₂=CH₂+H₂→CH₃–CH₃ (катализатор, нагрев)
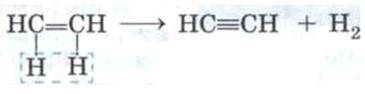
Также этилен может дальше терять водород (дегидрирование) с образованием ацетилена, где уже тройная связь:
CH₂=CH₂→HC≡CH+H₂
3. Реакции с галогенами и галогеноводородами
Для этана характерно замещение (потому что присоединяться «некуда» — кратной связи нет). Например, при хлорировании один атом H заменяется на Cl, образуется хлороэтан и выделяется HCl:
CH₃–CH₃+Cl₂→CH₃–CH₂Cl+HCl
Для этилена характерно присоединение по двойной связи.
Галогенирование (например, бромирование) идёт как присоединение двух атомов Br к двум углеродам двойной связи, образуется 1,2-дибромэтан:
CH₂=CH₂+Br₂→CH₂Br–CH₂Br
Гидрогалогенирование (присоединение HBr) также идёт по двойной связи, образуется бромэтан:
CH₂=CH₂+HBr→CH₃–CH₂Br
4. Полимеризация (характерна для этилена)
Этилен способен соединяться в длинные цепи, потому что двойная связь «раскрывается» и мономеры связываются между собой. Так получают полиэтилен:
nCH₂=CH₂→(–CH₂–CH₂–)n (катализаторы типа TiCl₂, Al(C₂H₅)₃)
Для этана полимеризация нехарактерна, потому что у него нет кратной связи, которую можно «раскрыть» для образования цепи.
5. Окисление мягкими окислителями (качественная реакция на двойную связь)
Этилен обесцвечивает раствор перманганата калия в щелочной среде, потому что окисляется по месту двойной связи с образованием двухатомного спирта (этиленгликоля), при этом появляется бурый осадок MnO₂:
3CH₂=CH₂+2KMnO₄+4H₂O→3HO–CH₂–CH₂–OH+2MnO₂+2KOH (NaOH или Na₂CO₃)
Этан такой реакции в обычных условиях не даёт, потому что у него нет двойной связи, которая легко вступает в мягкое окисление.
Итоговое сравнение по свойствам такое: этан (алкан) в основном вступает в реакции замещения и горения, а этилен (алкен) — в реакции присоединения по двойной связи, полимеризацию, а также даёт качественные реакции на ненасыщенность.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.


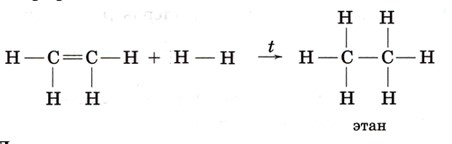
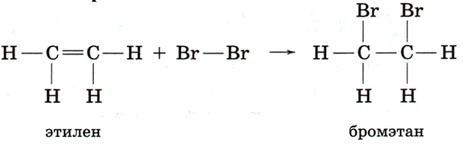
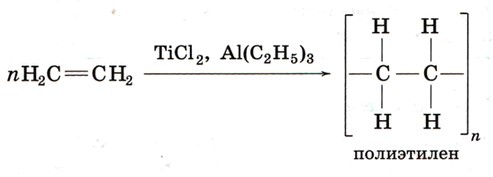
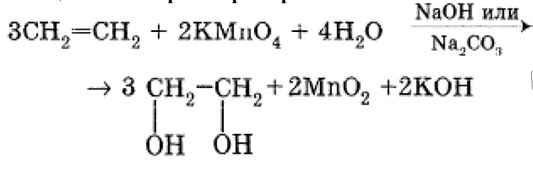


Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!