
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страница 157 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
3. Реакции замещения водорода в молекуле воды на металл идут с образованием _______________:
1) 2M + 2HOH = 2____________ + ______________ для металлов _________ группы,
например: ______________
2) M + 2HOH = ______________ + ______________ для металлов _________ группы,
например: ______________
4. Реакции обмена — это реакции разложения веществ водой,
или реакции ______________, например: ______________
В таблице растворимости такие вещества обозначены знаком ______________
Часть II
1. «Химическим антонимом» реакции разложения воды является её синтез из соответствующих простых веществ.
Напишите уравнение этого процесса: ______________
Придумайте и решите задачу, если известен объём одного из исходных веществ (н. у.), а требуется найти массу воды.
Вопрос 3
Реакции замещения водорода в молекуле воды на металл идут с образованием ЩЕЛОЧИ:
2M + 2H₂O → 2MOH + H₂↑ для металлов IA-группы, например:
2Li + 2H₂O → 2LiOH + H₂↑
M + 2H₂O → M(OH)₂ + H₂↑ для металлов IIA-группы, например:
Ca + 2H₂O → Ca(OH)₂ + H₂↑
Вопрос 4
Реакции обмена — это реакции разложения веществ водой, или реакции гидролиза, например:
В таблице растворимости такие вещества обозначены знаком «–» (иногда «Г»)
Часть II
Вопрос 1
2H₂ + O₂ → 2H₂O
Какую массу воды можно получить из 5 л водорода?
Дано:
V(H₂) = 5 л
M(H₂O) = 18 г/моль
Vₘ = 22,4 л/моль
m(H₂O) = ?
Решение:
2H₂ + O₂ → 2H₂O
n(H₂) = V/Vₘ = 5/22,4 = 0,223 (моль)
По уравнению реакции:
| H₂ | H₂O |
|---|---|
| 0,223 моль | х моль |
| 2 молекулы | 2 молекулы |
| x = n(H₂O) = 0,223 · 2 / 2 = 0,223 (моль) | |
m(H₂O) = n · M = 0,223 · 18 = 4,014 (г)
Ответ: 4,014 г.
Вопрос 3
Общая концепция: Реакции активных металлов с водой
Вода (H₂O) может быть представлена как H-OH, где водород связан с гидроксильной группой. Хотя вода является очень слабым электролитом и диссоциирует лишь в ничтожной степени на H⁺ и OH⁻ ионы, она способна реагировать с очень активными металлами.
Активность металлов определяется их положением в электрохимическом ряду напряжений. Металлы, стоящие до водорода в этом ряду, теоретически могут вытеснять водород из кислот. Однако только очень активные металлы (щелочные, щелочноземельные и некоторые другие, например, алюминий, но с оговорками) способны вытеснять водород непосредственно из воды при обычных условиях.
При взаимодействии активного металла с водой происходит реакция замещения: металл замещает водород в молекуле воды, образуя гидроксид металла и выделяя газообразный водород.
1. Для металлов IA-группы (щелочные металлы)
Примеры металлов: Литий (Li), Натрий (Na), Калий (K), Рубидий (Rb), Цезий (Cs).
Характеристики: Эти металлы являются одновалентными, то есть в химических соединениях они проявляют степень окисления +1. Они обладают очень высокой химической активностью, легко отдают свой единственный валентный электрон.
Механизм реакции: Реакция протекает очень бурно, часто с воспламенением выделяющегося водорода (особенно для Na, K и более тяжелых элементов). Металл реагирует с водой, образуя гидроксид металла (MOH) и газообразный водород (H₂).
Уравнение: Поскольку металл одновалентен, для уравнивания реакции требуется две молекулы воды на каждые два атома металла, чтобы образовались две молекулы гидроксида и одна молекула водорода.
2M + 2H₂O → 2MOH + H₂↑
(Иногда для наглядности пишут 2HOH вместо 2H₂O, чтобы показать, что замещается именно атом водорода из гидроксильной группы воды.)
Продукты: Образующиеся гидроксиды (MOH) – это сильные основания, которые хорошо растворимы в воде и называются щелочами. Например, LiOH (гидроксид лития), NaOH (гидроксид натрия).
Пример:
2Li + 2H₂O → 2LiOH + H₂↑
(Литий реагирует менее бурно, чем натрий или калий, но все равно активно.)
2. Для металлов IIА-группы (щелочноземельные металлы)
Примеры металлов: Кальций (Ca), Стронций (Sr), Барий (Ba). (Бериллий (Be) и Магний (Mg) реагируют с водой значительно слабее или только при нагревании.)
Характеристики: Эти металлы являются двухвалентными, то есть в химических соединениях они проявляют степень окисления +2. Они также очень активны, но, как правило, немного менее, чем щелочные металлы.
Механизм реакции: Реакция протекает активно, но обычно менее бурно, чем у щелочных металлов. Металл реагирует с водой, образуя гидроксид металла (M(OH)₂) и газообразный водород (H₂).
Уравнение: Поскольку металл двухвалентен, для образования гидроксида M(OH)₂ требуется два гидроксид-иона, которые берутся из двух молекул воды.
M + 2H₂O → M(OH)₂ + H₂↑
Продукты: Образующиеся гидроксиды (M(OH)₂) – это также сильные основания, большинство из которых (кроме Be(OH)₂) являются щелочами (хотя растворимость Ca(OH)₂ не очень высока, он все равно считается щелочью).
Пример:
Ca + 2H₂O → Ca(OH)₂ + H₂↑
(Кальций активно реагирует с водой, наблюдается выделение пузырьков водорода и помутнение раствора из-за образования малорастворимого гидроксида кальция.)
Заполнение пропусков:
Реакции замещения водорода в молекуле воды на металл идут с образованием ЩЕЛОЧИ:
1) 2M + 2HOH = 2MOH + H₂ для металлов IA группы, например: 2Li + 2H₂O → 2LiOH + H₂↑
2) M + 2HOH = M(OH)₂ + H₂ для металлов IIA группы, например: Ca + 2H₂O → Ca(OH)₂ + H₂↑
Вопрос 4
Общая концепция: Реакции обмена (двойного замещения)
Реакции обмена — это тип химических реакций, при которых два сложных вещества обмениваются своими составными частями (ионами) с образованием двух новых сложных веществ.
Общая схема: AB + CD → AD + CB
Для того чтобы реакция обмена протекала до конца (была необратимой), необходимо наличие так называемой «движущей силы». Этими движущими силами могут быть:
1. Образование осадка: Один из продуктов реакции нерастворим в воде и выпадает в осадок (↓). Это удаляет ионы из раствора, смещая равновесие в сторону продуктов.
2. Образование газа: Один из продуктов реакции является газом и улетучивается (↑). Это также удаляет продукт из реакционной среды.
3. Образование малодиссоциирующего вещества: Один из продуктов является слабым электролитом (например, вода, слабые кислоты, слабые основания), который практически не диссоциирует на ионы. Это также эффективно удаляет ионы из раствора.
Гидролиз как частный случай реакции обмена
Гидролиз – это химическая реакция взаимодействия вещества с водой, приводящая к разложению этого вещества. В контексте реакций обмена, гидролиз – это реакция обмена между веществом и водой, где вода выступает как один из реагентов, а ее молекула (H₂O) распадается, и ее части (H⁺ и OH⁻) присоединяются к частям гидролизуемого вещества.
Пример гидролиза: Al₂S₃ + 6H₂O
Рассмотрим реакцию: Al₂S₃ + 6H₂O → 2Al(OH)₃↓ + 3H₂S↑
Почему происходит гидролиз?
Сульфид алюминия (Al₂S₃) – это соль, образованная катионом сильного металла (Al³⁺, хотя Al(OH)₃ является слабым основанием) и анионом очень слабой кислоты (S²⁻, от сероводородной кислоты H₂S).
Когда такая соль растворяется в воде, ее ионы (Al³⁺ и S²⁻) активно взаимодействуют с молекулами воды.
Катион Al³⁺ – это катион слабого основания. Он реагирует с гидроксид-ионами воды (или оттягивает OH⁻ от H₂O), образуя нерастворимый гидроксид алюминия:
Al³⁺ + 3H₂O → Al(OH)₃↓ + 3H⁺
Анион S²⁻ – это анион очень слабой кислоты. Он реагирует с протонами воды (или оттягивает H⁺ от H₂O), образуя газообразный сероводород:
S²⁻ + 2H₂O → H₂S↑ + 2OH⁻
Суммарно: Обе части соли (катион и анион) одновременно гидролизуются, и продукты гидролиза (Al(OH)₃ и H₂S) удаляются из раствора (осадок и газ соответственно). Это делает реакцию гидролиза практически необратимой и полной.
Движущие силы в данном примере:
- Образование осадка (Al(OH)₃↓).
- Образование газа (H₂S↑).
Наличие обеих движущих сил делает эту реакцию очень эффективной и полной.
Обозначение в таблице растворимости:
В таблицах растворимости некоторые вещества, которые не существуют в водном растворе из-за полного гидролиза (то есть они сразу же реагируют с водой при попытке растворения), обозначаются специальным знаком. Наиболее распространенное обозначение для таких веществ – «-» (прочерк). Иногда могут использоваться другие символы, например, «Г» (гидролизуется) или «Н» (не существует в растворе), но «-» является наиболее универсальным.
Заполнение пропусков:
Реакции обмена — это реакции разложения веществ водой, или реакции гидролиза, например:
Al₂S₃ + 6HOH = 2Al(OH)₃↓ + 3H₂S↑
В таблице растворимости такие вещества обозначены знаком «-».
Часть II
Вопрос 1
Синтез воды и расчеты
1. «Химическим антонимом» реакции разложения воды является её синтез из соответствующих простых веществ.
Реакция разложения воды (электролиз):
2H₂O → 2H₂ + O₂
В этой реакции сложное вещество (вода) распадается на простые вещества (водород и кислород).
Реакция синтеза воды:
«Химический антоним» означает обратную реакцию. То есть, из простых веществ (водорода и кислорода) образуется сложное вещество (вода).
2H₂ + O₂ → 2H₂O
Эта реакция представляет собой процесс горения водорода в кислороде, в результате которого образуется вода. Она является экзотермической (выделяется тепло).
Балансировка: Для балансировки уравнения:
- Слева у нас 2 атома водорода (H₂) и 2 атома кислорода (O₂).
- Справа у нас 2 атома водорода и 1 атом кислорода в молекуле воды (H₂O).
- Чтобы уравнять атомы кислорода, ставим коэффициент 2 перед H₂O: 2H₂ + O₂ → 2H₂O.
- Теперь справа 4 атома водорода (2 * 2 = 4). Чтобы уравнять атомы водорода слева, ставим коэффициент 2 перед H₂: 2H₂ + O₂ → 2H₂O.
- Уравнение сбалансировано.
2. Придумайте и решите задачу, если известен объём одного из исходных веществ (н. у.), а требуется найти массу воды.
Задача: Какую массу воды (H₂O) можно получить из 5 литров водорода (H₂), если реакция протекает при нормальных условиях (н. у.)?
Решение:
Шаг 1: Запишите данные и что нужно найти.
Дано:
- Объем водорода V(H₂) = 5 л
- Молярная масса воды M(H₂O) = 18 г/моль (Рассчитывается: Ar(H) = 1 г/моль, Ar(O) = 16 г/моль. Тогда M(H₂O) = 2 * Ar(H) + Ar(O) = 2 * 1 + 16 = 18 г/моль).
- Молярный объем газа при нормальных условиях Vm = 22,4 л/моль. (Нормальные условия (н. у.) или стандартные условия (STP) в химии обычно определяются как температура 0°C (273,15 K) и давление 1 атмосфера (101,325 кПа). При этих условиях 1 моль любого идеального газа занимает объем 22,4 литра.)
Найти:
Масса воды m(H₂O) = ?
Шаг 2: Напишите сбалансированное химическое уравнение реакции.
Мы уже определили, что реакция синтеза воды выглядит так:
2H₂ + O₂ → 2H₂O
Шаг 3: Переведите известный объем газа в количество вещества (моль).
Для газов при нормальных условиях количество вещества (n) можно найти, разделив объем газа (V) на молярный объем (Vm).
Формула: n = V / Vm
Расчет: n(H₂) = 5 л / 22,4 л/моль ≈ 0,223214 моль
(Оставляем несколько знаков после запятой для точности промежуточных расчетов, округлять будем в конце.)
Шаг 4: Используйте стехиометрические коэффициенты из уравнения реакции, чтобы найти количество вещества продукта (воды).
Стехиометрические коэффициенты в сбалансированном уравнении показывают соотношение молей реагентов и продуктов.
Из уравнения 2H₂ + O₂ → 2H₂O видно, что:
- 2 моль водорода (H₂) реагируют с 1 моль кислорода (O₂).
При этом образуется 2 моль воды (H₂O).
Таким образом, соотношение молей водорода к молям воды составляет 2:2, что эквивалентно соотношению 1:1.
Это означает, что количество моль образовавшейся воды будет равно количеству моль прореагировавшего водорода.
Расчет: n(H₂O) = n(H₂) ≈ 0,223 моль
Шаг 5: Переведите количество вещества продукта (воды) в массу.
Для любого вещества масса (m) может быть найдена путем умножения количества вещества (n) на его молярную массу (M).
Формула: m = n * M
Расчет: m(H₂O) = 0,223 моль * 18 г/моль = 4,014 г.
Ответ: Масса воды, которую можно получить, составляет приблизительно 4,014 г.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.


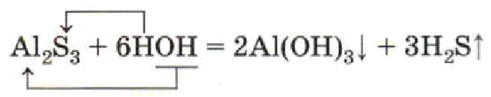



Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!