
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страница 183 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
4. Приведите не менее трёх молекулярных уравнений, соответствующих следующему сокращённому ионному:
CaCO₃ + 2H⁺ = Ca²⁺ + CO₂ + H₂O.
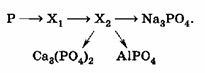
5. Определите неизвестные вещества и запишите молекулярные и ионные уравнения реакций, протекающих согласно схеме:
6. Сколько граммов 30%-й азотной кислоты потребуется для взаимодействия с 250 г известняка, содержащего 20% примесей? Какой объём углекислого газа (н. у.) при этом образуется?
Вопрос 4
CaCO₃ + 2H⁺ = Ca²⁺ + CO₂ + H₂O
CaCO₃ + 2HCl → CaCl₂ + H₂O + CO₂
CaCO₃ + H₂SO₄ → CaSO₄ + H₂O + CO₂
CaCO₃ + 2HNO₃ → Ca(NO₃)₂ + H₂O + CO₂
Вопрос 5
4P + 5O₂ → 2P₂O₅
P₂O₅ + 3H₂O → 2H₃PO₄
H₃PO₄ + Al(OH)₃ → AlPO₄↓ + 3H₂O
3H⁺ + PO₄³⁻ + Al(OH)₃ → AlPO₄↓ + 3H₂O
3NaOH + H₃PO₄ → Na₃PO₄ + 3H₂O
3H⁺ + PO₄³⁻ + 3Na⁺ + 3OH⁻ → 3Na⁺ + PO₄³⁻ + 3H₂O
H⁺ + OH⁻ → H₂O
3Ca(OH)₂ + 2H₃PO₄ → Ca₃(PO₄)₂↓ + 6H₂O
6H⁺ + 2PO₄³⁻ + 3Ca²⁺ + 6OH⁻ → Ca₃(PO₄)₂↓ + 6H₂O
Вопрос 6
Дано:
m(известняка) = 250 г
ω(прим.) = 20%
ω(HNO₃) = 30%
M(CaCO₃) = 100 г/моль
M(HNO₃) = 63 г/моль
Vₘ = 22,4 л/моль
m(раствора HNO₃) = ?
V(CO₂) = ?
CaCO₃ + 2HNO₃ → Ca(NO₃)₂ + H₂O + CO₂
ω(CaCO₃) = 100% — ω(прим.) = 100% — 20% = 80%
m(CaCO₃) = m(известняка) × ω(CaCO₃) / 100% = 250 × 0,8 = 200 г
n(CaCO₃) = m / M = 200 / 100 = 2 моль
По уравнению реакции:
| CaCO₃ | HNO₃ | CO₂ |
|---|---|---|
| 2 моль | x моль | y моль |
| 1 молекула | 2 молекулы | 1 молекула |
x = n(HNO₃) = 2 × 2 / 1 = 4 моль
x = n(CO₂) = 2 моль
V(CO₂) = n × Vₘ = 2 × 22,4 = 44,8 л
m(HNO₃) = n × M = 4 × 63 = 252 г
| HNO₃ | 252 г | 30% |
| Раствор HNO₃ | x г | 100% |
x = m(раствора HNO₃) = 252 × 100 / 30 = 840 г
Ответ: 44,8 л, 840 г.
Вопрос 4
Приведите не менее трёх молекулярных уравнений, соответствующих следующему сокращённому ионному:
CaCO₃ + 2H⁺ = Ca²⁺ + CO₂ + H₂O
Понимание сокращенного ионного уравнения:
Это уравнение описывает химический процесс на уровне ионов. Оно показывает только те частицы, которые непосредственно участвуют в реакции и изменяются.
- CaCO₃ (карбонат кальция) — это твердое, нерастворимое вещество. Поэтому оно записывается в молекулярном виде.
- 2H⁺ (ионы водорода) — это активные частицы кислоты, которые реагируют с карбонатом.
- Ca²⁺ (ионы кальция) — образуются в результате реакции и растворяются в воде.
- CO₂ (углекислый газ) — образуется и выделяется из раствора в виде газа.
- H₂O (вода) — образуется в результате реакции.
Цель — найти такие молекулярные вещества, которые при взаимодействии дадут именно эту ионную реакцию. Молекулярное уравнение показывает все вещества в их исходной молекулярной форме (или формульной единице для ионных соединений), а также продукты реакции.
Как получить молекулярное уравнение из сокращенного ионного:
Нам нужно «добавить» к ионам, участвующим в реакции, так называемые «ионы-зрители». Это ионы, которые присутствуют в растворе, но не вступают в химическое взаимодействие. Они должны быть частью растворимых соединений (кислот, солей или оснований), которые мы выбираем.
Требования к выбору реагентов:
1. Источник H⁺: Нам нужна кислота, которая диссоциирует, давая ионы H⁺. Для полной диссоциации и эффективной реакции мы выбираем сильные кислоты.
2. Образование растворимой соли: Анион выбранной кислоты должен образовывать растворимую соль с ионом Ca²⁺, чтобы Ca²⁺ оставался в растворе, как указано в сокращенном ионном уравнении.
Вариант 1: Использование соляной кислоты (HCl)
Выбор кислоты: Соляная кислота (HCl) — сильная кислота. В водном растворе она полностью диссоциирует на ионы водорода (H⁺) и хлорид-ионы (Cl⁻).
Ионы-зрители: В данном случае, Cl⁻ будут ионами-зрителями.
Продукты:
- CaCO₃ реагирует с H⁺ с образованием Ca²⁺, CO₂ и H₂O.
- Ионы Ca²⁺ (образовавшиеся) и Cl⁻ (ионы-зрители) объединяются, образуя CaCl₂. Хлорид кальция (CaCl₂) является растворимой солью, что соответствует условию, что Ca²⁺ остается в растворе.
Составление и балансировка молекулярного уравнения:
Нам нужно 2 иона H⁺ для реакции с CaCO₃. Поскольку HCl дает 1 H⁺ на молекулу, нам потребуется 2 молекулы HCl.
CaCO₃(тв) + 2HCl(р-р) → CaCl₂(р-р) + H₂O(ж) + CO₂↑(г)
Проверка (переход от молекулярного к сокращенному ионному):
1. Полное ионное уравнение:
CaCO₃(тв) + 2H⁺(aq) + 2Cl⁻(aq) → Ca²⁺(aq) + 2Cl⁻(aq) + H₂O(ж) + CO₂↑(г)
(Примечание: CaCO₃ не диссоциирует, H₂O и CO₂ также не диссоциируют).
2. Сокращение ионов-зрителей: Ионы 2Cl⁻(aq) присутствуют по обе стороны уравнения и не изменяются, поэтому они являются ионами-зрителями и сокращаются.
3. Сокращенное ионное уравнение:
CaCO₃(тв) + 2H⁺(aq) → Ca²⁺(aq) + H₂O(ж) + CO₂↑(г)
Это полностью соответствует заданному сокращенному ионному уравнению.
Вариант 2: Использование серной кислоты (H₂SO₄)
Выбор кислоты: Серная кислота (H₂SO₄) — сильная кислота. В водном растворе она диссоциирует на ионы водорода (H⁺) и сульфат-ионы (SO₄²⁻).
Ионы-зрители: В данном случае, SO₄²⁻ будут ионами-зрителями.
Продукты:
- CaCO₃ реагирует с H⁺ с образованием Ca²⁺, CO₂ и H₂O.
- Ионы Ca²⁺ и SO₄²⁻ объединяются, образуя CaSO₄. Сульфат кальция (CaSO₄) является малорастворимой солью. Хотя он может выпадать в осадок, реакция с карбонатом кальция все равно протекает, и ионы Ca²⁺ образуются в растворе (хотя затем часть их может выпасть в осадок). Для целей данного задания, это допустимый вариант, так как основная реакция (растворение карбоната) соответствует.
Составление и балансировка молекулярного уравнения:
Серная кислота H₂SO₄ дает 2 иона H⁺ на молекулу, что идеально подходит для реакции с CaCO₃.
CaCO₃(тв) + H₂SO₄(р-р) → CaSO₄(тв/р-р) + H₂O(ж) + CO₂↑(г)
Проверка:
1. Полное ионное уравнение:
CaCO₃(тв) + 2H⁺(aq) + SO₄²⁻(aq) → CaSO₄(тв/р-р) + H₂O(ж) + CO₂↑(г)
2. Сокращение ионов-зрителей: Если CaSO₄ выпадает в осадок, то SO₄²⁻ не является полностью ионом-зрителем. Однако, если рассматривать реакцию как растворение CaCO₃ под действием H⁺, то сокращенное ионное уравнение остается тем же.
3. Сокращенное ионное уравнение:
CaCO₃(тв) + 2H⁺(aq) → Ca²⁺(aq) + H₂O(ж) + CO₂↑(г) (если CaSO₄ остается в растворе)
Или, если CaSO₄ выпадает в осадок, то ион Ca²⁺ не будет полностью в растворе, но образуется из CaCO₃. Важно, что реакция протекает, и CO₂ выделяется.
Вариант 3: Использование азотной кислоты (HNO₃)
Выбор кислоты: Азотная кислота (HNO₃) — сильная кислота. В водном растворе она полностью диссоциирует на ионы водорода (H⁺) и нитрат-ионы (NO₃⁻).
Ионы-зрители: В данном случае, NO₃⁻ будут ионами-зрителями.
Продукты:
- CaCO₃ реагирует с H⁺ с образованием Ca²⁺, CO₂ и H₂O.
- Ионы Ca²⁺ и NO₃⁻ объединяются, образуя Ca(NO₃)₂. Нитрат кальция (Ca(NO₃)₂) является растворимой солью, что идеально соответствует условию, что Ca²⁺ остается в растворе.
Составление и балансировка молекулярного уравнения:
Нам нужно 2 иона H⁺ для реакции с CaCO₃. Поскольку HNO₃ дает 1 H⁺ на молекулу, нам потребуется 2 молекулы HNO₃.
CaCO₃(тв) + 2HNO₃(р-р) → Ca(NO₃)₂(р-р) + H₂O(ж) + CO₂↑(г)
Проверка:
1. Полное ионное уравнение:
CaCO₃(тв) + 2H⁺(aq) + 2NO₃⁻(aq) → Ca²⁺(aq) + 2NO₃⁻(aq) + H₂O(ж) + CO₂↑(г)
2. Сокращение ионов-зрителей: Ионы 2NO₃⁻(aq) сокращаются.
3. Сокращенное ионное уравнение:
CaCO₃(тв) + 2H⁺(aq) → Ca²⁺(aq) + H₂O(ж) + CO₂↑(г)
Это полностью соответствует заданному сокращенному ионному уравнению.
Вопрос 5
Определите неизвестные вещества и запишите молекулярные и ионные уравнения реакций, протекающих согласно схеме:
Эта схема описывает химические превращения, начинающиеся с элементарного фосфора (P) и приводящие к различным фосфатам. Это типичная задача на химические свойства неметаллов и их соединений.
Шаг 1: P → X₁
Анализ: Фосфор (P) — это неметалл. Он может реагировать с кислородом (O₂) с образованием оксида. Фосфор образует несколько оксидов, но наиболее стабильным и распространенным при избытке кислорода является оксид фосфора(V).
Реакция: Горение фосфора в избытке кислорода.
Молекулярное уравнение: 4P(тв) + 5O₂(г) → 2P₂O₅(тв)
Определение X₁: X₁ — это оксид фосфора(V), P₂O₅.
Шаг 2: X₁ → X₂
Анализ: X₁ (P₂O₅) — это кислотный оксид (ангидрид). Кислотные оксиды реагируют с водой, образуя соответствующие кислоты.
Реакция: Взаимодействие оксида фосфора(V) с водой.
Молекулярное уравнение: P₂O₅(тв) + 3H₂O(ж) → 2H₃PO₄(р-р)
Определение X₂: X₂ — это фосфорная кислота, H₃PO₄.
Теперь, зная, что X₂ = H₃PO₄, мы можем рассмотреть дальнейшие реакции.
Шаг 3: X₂ → Na₃PO₄
Анализ: Фосфорная кислота (H₃PO₄) — это кислота. Чтобы получить соль фосфата натрия (Na₃PO₄), нам нужно прореагировать кислоту с основанием, содержащим натрий. Наиболее подходящим является гидроксид натрия (NaOH) — сильное основание. Это реакция нейтрализации.
Реакция: Взаимодействие фосфорной кислоты с гидроксидом натрия. Фосфорная кислота является трехосновной, поэтому для образования средней соли Na₃PO₄ потребуется три молекулы NaOH на одну молекулу H₃PO₄.
Молекулярное уравнение: H₃PO₄(р-р) + 3NaOH(р-р) → Na₃PO₄(р-р) + 3H₂O(ж)
Полное ионное уравнение: Фосфорная кислота (H₃PO₄) является кислотой средней силы, но в реакции с сильным основанием она диссоциирует практически полностью. NaOH, Na₃PO₄ — растворимые сильные электролиты.
3H⁺(aq) + PO₄³⁻(aq) + 3Na⁺(aq) + 3OH⁻(aq) → 3Na⁺(aq) + PO₄³⁻(aq) + 3H₂O(ж)
Сокращенное ионное уравнение: Ионы 3Na⁺ и PO₄³⁻ являются ионами-зрителями.
3H⁺(aq) + 3OH⁻(aq) → 3H₂O(ж)
(Можно сократить коэффициенты: H⁺(aq) + OH⁻(aq) → H₂O(ж))
Шаг 4: X₂ → Ca₃(PO₄)₂
Анализ: Фосфорная кислота (H₃PO₄) реагирует с соединением кальция для образования фосфата кальция (Ca₃(PO₄)₂). Фосфат кальция — это нерастворимая соль, которая выпадает в осадок. Источником кальция может быть гидроксид кальция (Ca(OH)₂).
Реакция: Взаимодействие фосфорной кислоты с гидроксидом кальция.
Молекулярное уравнение: Для балансировки: нам нужно 3 иона Ca²⁺ и 2 иона PO₄³⁻.
2H₃PO₄(р-р) + 3Ca(OH)₂(р-р) → Ca₃(PO₄)₂↓(тв) + 6H₂O(ж)
(Балансировка: 2*3=6 H⁺ и 3*2=6 OH⁻ дают 6 H₂O. 2 PO₄³⁻ и 3 Ca²⁺ дают Ca₃(PO₄)₂).
Полное ионное уравнение: Ca(OH)₂ является малорастворимым, но достаточно сильным основанием, чтобы диссоциировать в растворе. Ca₃(PO₄)₂ — нерастворимый осадок.
6H⁺(aq) + 2PO₄³⁻(aq) + 3Ca²⁺(aq) + 6OH⁻(aq) → Ca₃(PO₄)₂↓(тв) + 6H₂O(ж)
Сокращенное ионное уравнение: Ионы H⁺ и OH⁻ образуют воду и сокращаются.
3Ca²⁺(aq) + 2PO₄³⁻(aq) → Ca₃(PO₄)₂↓(тв)
Шаг 5: X₂ → AlPO₄
Анализ: Фосфорная кислота (H₃PO₄) реагирует с соединением алюминия для образования фосфата алюминия (AlPO₄). Фосфат алюминия — это нерастворимая соль, которая выпадает в осадок. Источником алюминия может быть гидроксид алюминия (Al(OH)₃).
Реакция: Взаимодействие фосфорной кислоты с гидроксидом алюминия.
Молекулярное уравнение:
H₃PO₄(р-р) + Al(OH)₃(тв) → AlPO₄↓(тв) + 3H₂O(ж)
(Балансировка: 3 H⁺ из H₃PO₄ и 3 OH⁻ из Al(OH)₃ дают 3 H₂O).
Полное ионное уравнение: Al(OH)₃ является нерастворимым основанием, поэтому записывается в молекулярном виде. AlPO₄ — нерастворимый осадок.
3H⁺(aq) + PO₄³⁻(aq) + Al(OH)₃(тв) → AlPO₄↓(тв) + 3H₂O(ж)
Сокращенное ионное уравнение: В этом случае нет ионов-зрителей, так как Al(OH)₃ и AlPO₄ являются твердыми веществами и не диссоциируют.
3H⁺(aq) + PO₄³⁻(aq) + Al(OH)₃(тв) → AlPO₄↓(тв) + 3H₂O(ж)
Вопрос 6
Сколько граммов 30%-й азотной кислоты потребуется для взаимодействия с 250 г известняка, содержащего 20% примесей? Какой объём углекислого газа (н. у.) при этом образуется?
Это задача на стехиометрию химической реакции.
Она включает расчеты с учетом примесей в исходном веществе.
А также расчеты с учетом процентной концентрации раствора реагента.
И, наконец, расчет объема газообразного продукта при нормальных условиях.
Дано:
Масса известняка равна 250 граммов.
Массовая доля примесей в известняке составляет 20 процентов.
Массовая доля азотной кислоты в растворе равна 30 процентам.
Нормальные условия (н. у.) означают, что молярный объем любого газа равен 22,4 литра на моль.
Найти:
Масса раствора азотной кислоты, которая потребуется.
Объем углекислого газа, который образуется.
Решение:
Первый шаг: Определяем массу чистого карбоната кальция (CaCO₃) в известняке.
Известняк состоит из карбоната кальция и примесей. Примеси не вступают в реакцию с азотной кислотой. Поэтому для расчетов нам нужна только масса чистого реагирующего вещества. Если примесей 20 процентов, то чистого карбоната кальция в известняке 100% — 20% = 80%.
Масса чистого CaCO₃ = Масса известняка × Массовая доля чистого CaCO₃.
Масса чистого CaCO₃ = 250 г × (80 / 100).
Масса чистого CaCO₃ = 250 г × 0,8.
Масса чистого CaCO₃ = 200 г.
Второй шаг: Записываем химическое уравнение реакции и балансируем его.
Карбонат кальция (CaCO₃) реагирует с азотной кислотой (HNO₃). Это реакция обмена между солью и кислотой. Продуктами такой реакции являются новая соль, вода и углекислый газ. Углекислый газ выделяется в виде газа.
Уравнение реакции:
CaCO₃ + HNO₃ → Ca(NO₃)₂ + H₂O + CO₂
Теперь балансируем его. Нам нужно два атома водорода слева, чтобы образовать воду и углекислый газ. Поэтому перед HNO₃ ставим коэффициент 2.
CaCO₃(тв) + 2HNO₃(р-р) → Ca(NO₃)₂(р-р) + H₂O(ж) + CO₂↑(г)
Уравнение сбалансировано.
Третий шаг: Рассчитываем количество вещества (моли) чистого карбоната кальция.
Для этого нам нужна молярная масса CaCO₃.
Молярная масса Ca = 40 г/моль.
Молярная масса C = 12 г/моль.
Молярная масса O = 16 г/моль.
Молярная масса CaCO₃ = 40 + 12 + (3 × 16) = 40 + 12 + 48 = 100 г/моль.
Количество вещества (моли) = Масса / Молярная масса.
n(CaCO₃) = 200 г / 100 г/моль.
n(CaCO₃) = 2 моль.
Четвертый шаг: Используем стехиометрию реакции для определения количества вещества HNO₃ и CO₂.
Стехиометрия – это соотношение молей веществ в химической реакции.
Из сбалансированного уравнения:
- 1 моль CaCO₃ реагирует с 2 моль HNO₃.
- И 1 моль CaCO₃ образует 1 моль CO₂.
Следовательно, для 2 моль CaCO₃:
Количество вещества HNO₃ (n(HNO₃)) = 2 × n(CaCO₃) = 2 × 2 моль = 4 моль.
Количество вещества CO₂ (n(CO₂)) = n(CaCO₃) = 2 моль.
Пятый шаг: Рассчитываем массу чистой азотной кислоты (HNO₃).
Для этого нам нужна молярная масса HNO₃.
Молярная масса H = 1 г/моль.
Молярная масса N = 14 г/моль.
Молярная масса O = 16 г/моль.
Молярная масса HNO₃ = 1 + 14 + (3 × 16) = 1 + 14 + 48 = 63 г/моль.
Масса чистой HNO₃ = Количество вещества × Молярная масса.
m(HNO₃) = 4 моль × 63 г/моль.
m(HNO₃) = 252 г.
Шестой шаг: Рассчитываем массу 30%-го раствора азотной кислоты.
Массовая доля вещества в растворе = (Масса вещества / Масса раствора) × 100%.
Отсюда, Масса раствора = Масса вещества / (Массовая доля / 100%).
Масса раствора HNO₃ = 252 г / (30 / 100).
Масса раствора HNO₃ = 252 г / 0,3.
Масса раствора HNO₃ = 840 г.
Седьмой шаг: Рассчитываем объем углекислого газа (CO₂) при нормальных условиях.
При нормальных условиях 1 моль любого газа занимает объем 22,4 литра.
Объем CO₂ = Количество вещества CO₂ × Молярный объем газа.
V(CO₂) = 2 моль × 22,4 л/моль.
V(CO₂) = 44,8 л.
Ответ:
Для взаимодействия с известняком потребуется 840 граммов 30%-й азотной кислоты.
При этом образуется 44,8 литра углекислого газа (при нормальных условиях).

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!