
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страница 189 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
4. Приведите не менее трёх молекулярных уравнений, соответствующих следующему сокращённому ионному:
CO₂ + 2OH⁻ → CO₃²⁻ + H₂O.
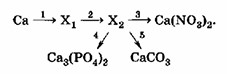
5. Определите неизвестные вещества и запишите молекулярные и ионные уравнения реакций, протекающих согласно схеме:
1)
2)
3)
4)
5)
Вопрос 4
1) CO₂ + 2KOH → K₂CO₃ + H₂O
2) CO₂ + 2NaOH → Na₂CO₃ + H₂O
3) CO₂ + 2LiOH → Li₂CO₃ + H₂O
Вопрос 5
1. 2Ca + O₂ → 2CaO
2. CaO + H₂O → Ca(OH)₂
3. Ca(OH)₂ + 2HNO₃ → Ca(NO₃)₂ + 2H₂O
Ca²⁺ + 2OH⁻ + 2H⁺ + 2NO₃⁻ → Ca²⁺ + 2NO₃⁻ + 2H₂O
H⁺ + OH⁻ → H₂O
4. 3Ca(OH)₂ + 2K₃PO₄ → Ca₃(PO₄)₂ + 6KOH
3Ca²⁺ + 6OH⁻ + 6K⁺ + 2PO₄³⁻ → Ca₃(PO₄)₂ + 6K⁺ + 6OH⁻
3Ca²⁺ + 2PO₄³⁻ → Ca₃(PO₄)₂
5. Ca(OH)₂ + Na₂CO₃ → CaCO₃↓ + 2NaOH
Ca²⁺ + 2OH⁻ + 2Na⁺ + CO₃²⁻ → CaCO₃↓ + 2Na⁺ + 2OH⁻
Ca²⁺ + CO₃²⁻ → CaCO₃↓
Вопрос 4
Молекулярные уравнения для CO₂ + 2OH⁻ → CO₃²⁻ + H₂O
Анализ сокращенного ионного уравнения:
Данное уравнение описывает реакцию между углекислым газом (CO₂), который является кислотным оксидом, и гидроксид-ионами (OH⁻), которые поступают от сильного основания (щёлочи). В результате реакции образуется карбонат-ион (CO₃²⁻) и вода (H₂O). Это типичная реакция кислотного оксида со щёлочью с образованием соли и воды.
Стратегия поиска молекулярных уравнений:
- Источник CO₂: Это сам углекислый газ.
- Источник OH⁻: Должна быть сильная растворимая щёлочь (гидроксид щелочного металла).
- Продукты: Образуется соответствующий карбонат щелочного металла и вода.
Примеры молекулярных уравнений:
1. Реакция углекислого газа с гидроксидом калия:
Исходные вещества: CO₂ и KOH.
Продукты: K₂CO₃ (карбонат калия) и H₂O.
Молекулярное уравнение:
CO₂(г) + 2KOH(р-р) → K₂CO₃(р-р) + H₂O(ж)
Проверка ионного уравнения:
Полное ионное: CO₂(г) + 2K⁺(р-р) + 2OH⁻(р-р) → 2K⁺(р-р) + CO₃²⁻(р-р) + H₂O(ж)
Сокращенное ионное (после сокращения иона K⁺): CO₂(г) + 2OH⁻(р-р) → CO₃²⁻(р-р) + H₂O(ж). Это соответствует исходному.
2. Реакция углекислого газа с гидроксидом натрия:
Исходные вещества: CO₂ и NaOH.
Продукты: Na₂CO₃ (карбонат натрия) и H₂O.
Молекулярное уравнение:
CO₂(г) + 2NaOH(р-р) → Na₂CO₃(р-р) + H₂O(ж)
Проверка ионного уравнения:
Аналогично первому примеру, ион Na⁺ будет сокращен, что приведет к исходному сокращенному ионному уравнению.
3. Реакция углекислого газа с гидроксидом лития:
Исходные вещества: CO₂ и LiOH.
Продукты: Li₂CO₃ (карбонат лития) и H₂O.
Молекулярное уравнение:
CO₂(г) + 2LiOH(р-р) → Li₂CO₃(р-р) + H₂O(ж)
Проверка ионного уравнения:
Аналогично первому примеру, ион Li⁺ будет сокращен, что приведет к исходному сокращенному ионному уравнению.
Вопрос 5
Схема показывает превращения кальция (Ca) и его соединений. Необходимо определить промежуточные вещества X₁ и X₂, а затем записать молекулярные и ионные уравнения для каждой стадии.
Шаг 1: Ca →¹ X₁
Кальций (Ca) — активный щелочноземельный металл. Он легко реагирует с кислородом воздуха.
Реакция: Кальций реагирует с кислородом, образуя оксид кальция.
X₁: Оксид кальция (CaO).
Молекулярное уравнение (1):
2Ca(т) + O₂(г) → 2CaO(т)
Ионное уравнение (1):
Это окислительно-восстановительная реакция между простыми веществами, для которой обычно не записывают ионное уравнение в виде ионов-зрителей. Если требуется, можно показать изменение степеней окисления: 2Ca⁰ + O₂⁰ → 2Ca²⁺ + 2O²⁻.
Шаг 2: X₁ →² X₂ (то есть CaO →² X₂)
Оксид кальция (CaO) — это основной оксид. Основные оксиды щелочноземельных металлов реагируют с водой, образуя гидроксиды.
Реакция: Оксид кальция реагирует с водой, образуя гидроксид кальция.
X₂: Гидроксид кальция (Ca(OH)₂).
Молекулярное уравнение (2):
CaO(т) + H₂O(ж) → Ca(OH)₂(р-р)
Ионное уравнение (2):
Полное ионное: CaO(т) + H₂O(ж) → Ca²⁺(р-р) + 2OH⁻(р-р)
Сокращенное ионное: CaO(т) + H₂O(ж) → Ca²⁺(р-р) + 2OH⁻(р-р) (поскольку CaO и H₂O не диссоциируют в растворе).
Шаг 3: X₂ →³ Ca(NO₃)₂ (то есть Ca(OH)₂ →³ Ca(NO₃)₂)
Гидроксид кальция (Ca(OH)₂) — это основание. Чтобы получить нитрат кальция (Ca(NO₃)₂), необходимо провести реакцию нейтрализации с азотной кислотой (HNO₃).
Реакция: Гидроксид кальция реагирует с азотной кислотой.
Молекулярное уравнение (3):
Ca(OH)₂(р-р) + 2HNO₃(р-р) → Ca(NO₃)₂(р-р) + 2H₂O(ж)
Ионное уравнение (3):
Полное ионное: Ca²⁺(р-р) + 2OH⁻(р-р) + 2H⁺(р-р) + 2NO₃⁻(р-р) → Ca²⁺(р-р) + 2NO₃⁻(р-р) + 2H₂O(ж)
Сокращенное ионное (после сокращения ионов Ca²⁺ и NO₃⁻): 2OH⁻(р-р) + 2H⁺(р-р) → 2H₂O(ж) или H⁺(р-р) + OH⁻(р-р) → H₂O(ж).
Шаг 4: X₂ →⁴ Ca₃(PO₄)₂ (то есть Ca(OH)₂ →⁴ Ca₃(PO₄)₂)
Гидроксид кальция (Ca(OH)₂) является источником ионов Ca²⁺. Для образования нерастворимого фосфата кальция (Ca₃(PO₄)₂) необходим источник фосфат-ионов (PO₄³⁻). В качестве такого источника можно использовать растворимую соль фосфорной кислоты, например, фосфат калия (K₃PO₄).
Реакция: Гидроксид кальция реагирует с фосфатом калия.
Молекулярное уравнение (4):
3Ca(OH)₂(р-р) + 2K₃PO₄(р-р) → Ca₃(PO₄)₂(т)↓ + 6KOH(р-р)
Ионное уравнение (4):
Полное ионное: 3Ca²⁺(р-р) + 6OH⁻(р-р) + 6K⁺(р-р) + 2PO₄³⁻(р-р) → Ca₃(PO₄)₂(т)↓ + 6K⁺(р-р) + 6OH⁻(р-р)
Сокращенное ионное (после сокращения ионов K⁺ и OH⁻): 3Ca²⁺(р-р) + 2PO₄³⁻(р-р) → Ca₃(PO₄)₂(т)↓.
Шаг 5: X₂ →⁵ CaCO₃ (то есть Ca(OH)₂ →⁵ CaCO₃)
Гидроксид кальция (Ca(OH)₂) является источником ионов Ca²⁺. Для образования нерастворимого карбоната кальция (CaCO₃) необходим источник карбонат-ионов (CO₃²⁻). В качестве такого источника можно использовать растворимую соль угольной кислоты, например, карбонат натрия (Na₂CO₃).
Реакция: Гидроксид кальция реагирует с карбонатом натрия.
Молекулярное уравнение (5):
Ca(OH)₂(р-р) + Na₂CO₃(р-р) → CaCO₃(т)↓ + 2NaOH(р-р)
Ионное уравнение (5):
Полное ионное: Ca²⁺(р-р) + 2OH⁻(р-р) + 2Na⁺(р-р) + CO₃²⁻(р-р) → CaCO₃(т)↓ + 2Na⁺(р-р) + 2OH⁻(р-р)
Сокращенное ионное (после сокращения ионов Na⁺ и OH⁻): Ca²⁺(р-р) + CO₃²⁻(р-р) → CaCO₃(т)↓.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!