
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страница 29 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
3. Номер периода соответствует числу ☐☐☐☐☐☐☐☐-
☐☐☐ ☐☐☐☐☐ в атоме химического элемента.
4. Номер группы соответствует числу электронов на внешнем
энергетическом ☐☐☐☐☐☐.
5. Запишите схемы строения электронных оболочек атомов химических элементов с порядковыми номерами с 1-го по 10-й в таблице Д. И. Менделеева, а также калия и кальция.
Ответ:
Часть II
1. В приведённом перечне: мышьяк, теллур, германий, иод, селен, полоний, астат, — число элементов, в атомах которых по шесть электронов на внешнем энергетическом уровне, равно:
1) одному
2) двум
3) трём
4) четырём
2. Атомы химических элементов 4-го периода имеют одинаковое число:
1) электронов на внешнем энергетическом уровне
2) нейтронов
3) энергетических уровней
4) протонов
Вопрос 3
Номер периода соответствует числу ЭЛЕКТРОННЫХ СЛОЕВ в атоме химического элемента.
Вопрос 4
Номер группы соответствует числу электронов на внешнем энергетическом УРОВНЕ.
Вопрос 5
Часть II
Вопрос 1
| Элемент | Число внешних электронов |
|---|---|
| Мышьяк | 5 |
| Теллур | 6 |
| Германий | 4 |
| Иод | 7 |
| Селен | 6 |
| Полоний | 6 |
| Астат | 7 |
Число элементов, в атомах которых по шесть электронов на внешнем энергетическом уровне, равно 3.
Ответ: 3.
Вопрос 2
Атомы химических элементов 4-го периода имеют одинаковое число энергетических уровней.
Ответ: 3.
Вопрос 3
Номер периода соответствует числу электронных слоев в атоме химического элемента.
Объяснение:
— Период — это горизонтальный ряд в периодической таблице элементов Менделеева.
— Номер периода прямо связан с количеством электронных слоев или энергетических уровней, на которых могут находиться электроны атома.
— Например:
- Элементы первого периода (например, водород \(H\)) имеют 1 электронный слой.
- Элементы второго периода (например, литий \(Li\)) имеют 2 электронных слоя.
- Элементы третьего периода (например, натрий \(Na\)) имеют 3 электронных слоя.
- И так далее. Каждый период начинается с нового энергетического уровня, который заполняется электронами.
Таким образом, номер периода в таблице соответствует количеству электронных слоев в атомах элементов, находящихся в этом периоде.
Вопрос 4
Номер группы соответствует числу электронов на внешнем энергетическом уровне.
Объяснение:
— Группа — это вертикальный столбец в периодической таблице Менделеева.
— Элементы в одной группе имеют схожие химические свойства, потому что число электронов на внешнем энергетическом уровне (валентных электронов) у них одинаково.
— Пример:
- Элементы группы 1 (щелочные металлы, например, натрий \(Na\)) имеют 1 валентный электрон на внешнем уровне.
- Элементы группы 17 (галогены, например, хлор \(Cl\)) имеют 7 валентных электронов на внешнем уровне.
- Элементы группы 18 (благородные газы, например, неон \(Ne\)) имеют 8 валентных электронов на внешнем уровне, что делает их химически инертными.
Таким образом, номер группы указывает на количество электронов на внешнем энергетическом уровне, которые влияют на химическую активность элемента.
Вопрос 5
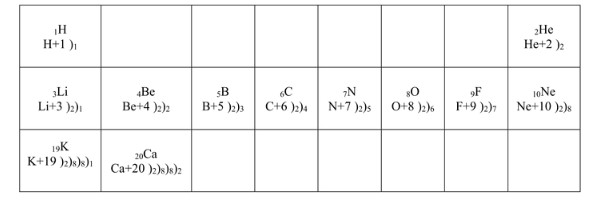
Давайте подробно разберем, как строятся схемы электронных оболочек атомов, используя предоставленные данные и принципы строения атома.
Основные принципы:
1. Атомный номер (Z): Число, указывающее на количество протонов в ядре атома. В нейтральном атоме количество электронов равно количеству протонов, то есть равно атомному номеру.
2. Электронные оболочки (энергетические уровни): Электроны располагаются вокруг ядра на определенных энергетических уровнях, или оболочках. Номер периода в периодической таблице соответствует количеству таких заполненных или частично заполненных электронных оболочек.
3. Заполнение оболочек: Каждая электронная оболочка имеет максимальное количество электронов, которое она может вместить:
— Первая оболочка (ближайшая к ядру): до 2 электронов.
— Вторая оболочка: до 8 электронов.
— Третья оболочка: до 18 электронов (но для элементов первых главных подгрупп 3-го и 4-го периодов, как правило, сначала заполняется внешний уровень до 8 электронов, а затем уже достраивается третий уровень). В упрощенных схемах часто показывают 8 электронов на третьем уровне перед заполнением четвертого.
— Четвертая оболочка: до 32 электронов.
4. Валентные электроны: Электроны на внешнем энергетическом уровне. Их количество определяет химические свойства элемента и соответствует номеру группы (для элементов главных подгрупп).
Разбор элементов:
1. Водород (¹H)
— Атомный номер (Z) = 1.
— Количество электронов = 1.
— Находится в 1-м периоде, значит, имеет 1 электронную оболочку.
— Схема: H⁺¹ )₁
— Один электрон находится на первой оболочке.
2. Гелий (²He)
— Атомный номер (Z) = 2.
— Количество электронов = 2.
— Находится в 1-м периоде, имеет 1 электронную оболочку.
— Схема: He⁺² )₂
— Два электрона находятся на первой оболочке, которая при этом полностью заполнена.
3. Литий (³Li)
— Атомный номер (Z) = 3.
— Количество электронов = 3.
— Находится во 2-м периоде, значит, имеет 2 электронные оболочки.
— Заполнение:
- Первая оболочка вмещает 2 электрона: 3 — 2 = 1 электрон остается.
- Вторая оболочка получает оставшийся 1 электрон.
— Схема: Li⁺³ )₂)₁
— 2 электрона на первой оболочке, 1 электрон на второй (валентный).
4. Бериллий (⁴Be)
— Атомный номер (Z) = 4.
— Количество электронов = 4.
— Находится во 2-м периоде, имеет 2 электронные оболочки.
— Заполнение:
- Первая оболочка: 2 электрона. Остается 4 — 2 = 2 электрона.
- Вторая оболочка: 2 электрона.
— Схема: Be⁺⁴ )₂)₂
— 2 электрона на первой оболочке, 2 электрона на второй (валентные).
5. Бор (⁵B)
— Атомный номер (Z) = 5.
— Количество электронов = 5.
— Находится во 2-м периоде, имеет 2 электронные оболочки.
— Заполнение:
- Первая оболочка: 2 электрона. Остается 5 — 2 = 3 электрона.
- Вторая оболочка: 3 электрона.
— Схема: B⁺⁵ )₂)₃
— 2 электрона на первой оболочке, 3 электрона на второй (валентные).
6. Углерод (⁶C)
— Атомный номер (Z) = 6.
— Количество электронов = 6.
— Находится во 2-м периоде, имеет 2 электронные оболочки.
— Заполнение:
- Первая оболочка: 2 электрона. Остается 6 — 2 = 4 электрона.
- Вторая оболочка: 4 электрона.
— Схема: C⁺⁶ )₂)₄
— 2 электрона на первой оболочке, 4 электрона на второй (валентные).
7. Азот (⁷N)
— Атомный номер (Z) = 7.
— Количество электронов = 7.
— Находится во 2-м периоде, имеет 2 электронные оболочки.
— Заполнение:
- Первая оболочка: 2 электрона. Остается 7 — 2 = 5 электронов.
- Вторая оболочка: 5 электронов.
— Схема: N⁺⁷ )₂)₅
— 2 электрона на первой оболочке, 5 электронов на второй (валентные).
8. Кислород (⁸O)
— Атомный номер (Z) = 8.
— Количество электронов = 8.
— Находится во 2-м периоде, имеет 2 электронные оболочки.
— Заполнение:
- Первая оболочка: 2 электрона. Остается 8 — 2 = 6 электронов.
- Вторая оболочка: 6 электронов.
— Схема: O⁺⁸ )₂)₆
— 2 электрона на первой оболочке, 6 электронов на второй (валентные).
9. Фтор (⁹F)
— Атомный номер (Z) = 9.
— Количество электронов = 9.
— Находится во 2-м периоде, имеет 2 электронные оболочки.
— Заполнение:
- Первая оболочка: 2 электрона. Остается 9 — 2 = 7 электронов.
- Вторая оболочка: 7 электронов.
— Схема: F⁺⁹ )₂)₇
— 2 электрона на первой оболочке, 7 электронов на второй (валентные).
10. Неон (¹⁰Ne)
— Атомный номер (Z) = 10.
— Количество электронов = 10.
— Находится во 2-м периоде, имеет 2 электронные оболочки.
— Заполнение:
- Первая оболочка: 2 электрона. Остается 10 — 2 = 8 электронов.
- Вторая оболочка: 8 электронов.
— Схема: Ne⁺¹⁰ )₂)₈
— 2 электрона на первой оболочке, 8 электронов на второй (валентные). Вторая оболочка полностью заполнена, что делает неон химически инертным.
11. Калий (¹⁹K)
— Атомный номер (Z) = 19.
— Количество электронов = 19.
— Находится в 4-м периоде, имеет 4 электронные оболочки.
— Заполнение (упрощенная модель):
- Первая оболочка: 2 электрона.
- Вторая оболочка: 8 электронов.
Осталось: 19 — 2 — 8 = 9 электронов.
Согласно правилам заполнения, для элементов 4-го периода сначала заполняется 4-я оболочка одним или двумя электронами, а затем уже достраивается 3-я оболочка. В упрощенных схемах для K и Ca 3-я оболочка часто показывается с 8 электронами, а 4-я — с оставшимися. - Третья оболочка: 8 электронов.
Остается: 9 — 8 = 1 электрон. - Четвертая оболочка: 1 электрон.
— Схема: K⁺¹⁹ )₂)₈)₈)₁
— 2 электрона на первой, 8 на второй, 8 на третьей, 1 на четвертой (валентный).
12. Кальций (²⁰Ca)
— Атомный номер (Z) = 20.
— Количество электронов = 20.
— Находится в 4-м периоде, имеет 4 электронные оболочки.
— Заполнение (упрощенная модель):
- Первая оболочка: 2 электрона.
- Вторая оболочка: 8 электронов.
Осталось: 20 — 2 — 8 = 10 электронов. - Третья оболочка: 8 электронов.
Остается: 10 — 8 = 2 электрона. - Четвертая оболочка: 2 электрона.
— Схема: Ca⁺²⁰ )₂)₈)₈)₂
— 2 электрона на первой, 8 на второй, 8 на третьей, 2 на четвертой (валентные).
Итог:
Схемы строения электронных оболочек атомов показывают распределение электронов по энергетическим уровням. Они позволяют понять, почему элементы в одной группе имеют схожие химические свойства (из-за одинакового числа валентных электронов) и почему свойства элементов меняются по мере продвижения по периоду (из-за изменения числа валентных электронов и количества оболочек).
Часть II
Вопрос 1
Необходимо выяснить, сколько элементов из предложенного перечня имеют 6 электронов на внешнем энергетическом уровне. Перечень элементов: мышьяк, теллур, германий, иод, селен, полоний, астат.
Пошаговое решение:
1. Мышьяк (As):
— Мышьяк находится в группе 15, атомный номер 33.
— Внешний уровень содержит 5 валентных электронов, так как группа 15 имеет 5 валентных электронов.
— Ответ: 5 внешних электронов.
2. Теллур (Te):
— Теллур находится в группе 16, атомный номер 52.
— Внешний уровень содержит 6 валентных электронов, так как группа 16 имеет 6 валентных электронов.
— Ответ: 6 внешних электронов.
3. Германий (Ge):
— Германий находится в группе 14, атомный номер 32.
— Внешний уровень содержит 4 валентных электрона, так как группа 14 имеет 4 валентных электрона.
— Ответ: 4 внешних электрона.
4. Иод (I):
— Иод находится в группе 17, атомный номер 53.
— Внешний уровень содержит 7 валентных электронов, так как группа 17 имеет 7 валентных электронов.
— Ответ: 7 внешних электронов.
5. Селен (Se):
— Селен находится в группе 16, атомный номер 34.
— Внешний уровень содержит 6 валентных электронов, так как группа 16 имеет 6 валентных электронов.
— Ответ: 6 внешних электронов.
6. Полоний (Po):
— Полоний находится в группе 16, атомный номер 84.
— Внешний уровень содержит 6 валентных электронов, так как группа 16 имеет 6 валентных электронов.
— Ответ: 6 внешних электронов.
7. Астат (At):
— Астат находится в группе 17, атомный номер 85.
— Внешний уровень содержит 7 валентных электронов, так как группа 17 имеет 7 валентных электронов.
— Ответ: 7 внешних электронов.
Подсчитаем количество элементов с 6 внешними электронами:
— Теллур (Te): 6 внешних электронов.
— Селен (Se): 6 внешних электронов.
— Полоний (Po): 6 внешних электронов.
Итого: 3 элемента имеют по 6 электронов на внешнем уровне.
Ответ: 3.
Вопрос 2
Задание:
Атомы химических элементов 4-го периода имеют одинаковое число:
1. электронов на внешнем энергетическом уровне
2. нейтронов
3. энергетических уровней
4. протонов
Пояснение:
1) Электроны на внешнем энергетическом уровне
— Электроны на внешнем уровне могут различаться у элементов одного периода, так как количество внешних электронов зависит от номера группы. Например, в 4-й периоде, элементы группы 1 (щелочные металлы) имеют 1 электрон на внешнем уровне, а элементы группы 18 (благородные газы) имеют 8 электронов на внешнем уровне. Следовательно, эти элементы не имеют одинаковое количество внешних электронов.
2) Нейтроны
— Нейтроны в ядре атома могут варьироваться у элементов одного периода, поскольку массовое число каждого элемента зависит от числа нейтронов. Например, у элементов одного периода (например, у калия и кальция) будут разные массовые числа и, соответственно, разное количество нейтронов. Следовательно, эти элементы не имеют одинаковое количество нейтронов.
3) Энергетические уровни
— Все элементы 4-го периода (например, натрий Na, магний Mg, железо Fe) имеют одинаковое количество энергетических уровней, так как они все находятся в одном периоде. Период таблицы Менделеева соответствует количеству энергетических уровней (или электронных слоев) атомов элементов этого периода. Для 4-го периода это будет 4 энергетических уровня.
4) Протоны
— Количество протонов (атомный номер) у элементов в одном периоде различается. Например, у натрия Na 11 протонов, а у магния Mg 12 протонов. Следовательно, эти элементы не имеют одинаковое количество протонов.
Правильный ответ: 3) энергетических уровней.
Все элементы 4-го периода имеют одинаковое количество энергетических уровней, так как они находятся в одном периоде таблицы Менделеева.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!