
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страница 36 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
1. Атомы металлов, отдавая внешние электроны, превращаются в ___________ ионы:
M⁰ — nē → Mn⁺,
атом ион
где n — число электронов внешнего слоя атома, соответствующее номеру группы химического элемента.
2. Атомы неметаллов, принимая электроны, недостающие до завершения внешнего электронного слоя, превращаются в ______________ ионы:
HM⁰ + (8 — n)ē → HM⁽⁸⁻ⁿ⁾⁻
атом ион
3. Между разноимённо заряженными _______ возникает связь, которая называется _______.
4. Дополните таблицу «Ионная связь».
§8
Часть І
Вопрос 1
Атомы металлов, отдавая внешние электроны, превращаются в ПОЛОЖИТЕЛЬНЫЕ ионы:
M⁰ – nē → Mⁿ⁺,
атом ион
где n – число электронов внешнего слоя атома, соответствующее номеру группы химического элемента.
Вопрос 2
Атомы неметаллов, принимая электроны, недостающие до завершения внешнего электронного слоя, превращаются в ОТРИЦАТЕЛЬНЫЕ ионы:
HM⁰ + (8 – n)ē → HM⁽⁸⁻ⁿ⁾⁻
атом ион
Вопрос 3
Между разноименно заряженными ИОНАМИ возникает связь, которая называется ИОННОЙ.
Вопрос 4
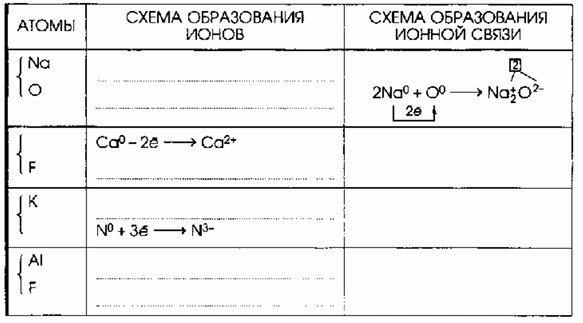
| Атомы | Схема образования ионов | Схема образования ионной связи |
|---|---|---|
| Na | Na⁰ — e⁻ → Na⁺ | 2Na⁰ + O⁰(2e⁻) → Na⁺₂O⁻² (2) |
| O | O⁰ + 2e⁻ → O²⁻ | |
| Ca | Ca⁰ — 2e⁻ → Ca²⁺ | Ca⁰ + 2F⁰(2e⁻) → Ca⁺²F⁻₂ (2) |
| F | F⁰ + e⁻ → F⁻ | |
| K | K⁰ — e⁻ → K⁺ | 3K⁰ + N⁰(3e⁻) → K⁺₃N⁻³ (3) |
| N | N⁰ + 3e⁻ → N³⁻ | |
| Al | Al⁰ — 3e⁻ → Al³⁺ | Al⁰ + 3F⁰(3e⁻) → Al⁺³F⁻₃ (3) |
| F | F⁰ + e⁻ → F⁻ |
§8
Часть І
Вопрос 1
Давай разберем, как атомы металлов превращаются в ионы и почему они становятся положительными.
1. Структура атома:
Каждый атом состоит из ядра, в котором находятся протоны и нейтроны, и оболочки, где расположены электроны. Внешние электроны, или валентные электроны, определяют химические свойства элемента.
2. Металлы и их электроны:
Металлы, как правило, имеют небольшое количество валентных электронов (обычно от одного до трех). Эти электроны находятся на внешнем энергетическом уровне и слабо связаны с ядром атома, что делает их более подвижными.
3. Отдача электронов:
Когда атом металла теряет один или несколько из своих внешних электронов, он становится положительно заряженным ионом. Это происходит потому, что количество протонов в ядре (которые имеют положительный заряд) остается неизменным, а число отрицательно заряженных электронов уменьшается. Таким образом, общий заряд атома становится положительным.
4. Пример:
Рассмотрим натрий (Na). У него один валентный электрон. Когда он отдает этот электрон, он превращается в ион Na⁺:
Na⁰ → Na⁺ + e⁻
В этом случае Na⁺ — это положительный ион натрия.
5. Обобщение:
В общем виде процесс можно записать так:
M⁰ – nē → Mⁿ⁺
Здесь M — это атом металла, n — число отданных электронов. Поскольку металлы обычно отдают электроны, они становятся положительными ионами (катионами).
Таким образом, когда мы говорим о превращении атомов металлов в ионы, мы имеем в виду, что они теряют электроны и становятся положительно заряженными из-за избытка протонов по сравнению с электронами.
Вопрос 2
Атомы неметаллов, принимая электроны, недостающие до завершения внешнего электронного слоя, превращаются в отрицательные ионы.
Давайте разберем это подробно:
1. Стремление к стабильности:
Атомы, как правило, стремятся к наиболее стабильному состоянию, которое достигается, когда их внешний электронный слой полностью заполнен. Для большинства элементов это означает наличие 8 электронов на внешнем уровне (правило октета), как у благородных газов.
2. Неметаллы и их электроны:
Неметаллы обычно имеют от 4 до 7 электронов на внешнем энергетическом уровне. Им легче добрать недостающие электроны до восьми, чем отдать все свои валентные электроны.
3. Принятие электронов:
Когда атом неметалла принимает один или несколько электронов, он превращается в отрицательно заряженный ион. Почему?
— В нейтральном атоме количество положительно заряженных протонов в ядре равно количеству отрицательно заряженных электронов, поэтому общий заряд равен нулю.
— Когда атом принимает дополнительные электроны, количество отрицательно заряженных частиц (электронов) становится -больше-, чем количество положительно заряженных частиц (протонов).
— Поскольку электроны несут отрицательный заряд, добавление их к атому делает общий заряд атома отрицательным.
4. Название ионов:
Отрицательно заряженные ионы называются анионами.
5. Пример:
Рассмотрим атом хлора (Cl). У него 7 валентных электронов. Чтобы достичь стабильного октета, ему нужен всего 1 электрон.
— Когда атом хлора (Cl⁰) принимает один электрон (e⁻), он превращается в хлорид-ион (Cl⁻):
Cl⁰ + e⁻ → Cl⁻
— Теперь у хлорид-иона на один электрон больше, чем протонов, поэтому его заряд становится -1.
6. Общая формула: HM⁰ + (8 — n)ē → HM⁽⁸⁻ⁿ⁾⁻
- HM⁰ — это нейтральный атом неметалла.
- n — это количество валентных электронов у данного неметалла.
- (8 — n) — это количество электронов, которое неметаллу необходимо принять, чтобы завершить свой внешний электронный слой до 8.
- ē — это электрон.
- HM⁽⁸⁻ⁿ⁾⁻ — это образовавшийся отрицательно заряженный ион (анион). Его заряд равен количеству принятых электронов, так как каждый электрон несет заряд -1.
Таким образом, неметаллы, принимая электроны, увеличивают количество отрицательных зарядов в своей электронной оболочке, что приводит к образованию отрицательно заряженных ионов.
Вопрос 3
Между разноименно заряженными ИОНАМИ возникает связь, которая называется ИОННОЙ.
1. Ионы:
— Когда атомы теряют или приобретают электроны, они превращаются в заряженные частицы, называемые ионами.
— Атомы, которые теряют электроны, становятся положительно заряженными ионами (их называют катионами). Это чаще всего происходит с металлами.
— Атомы, которые приобретают электроны, становятся отрицательно заряженными ионами (их называют анионами). Это чаще всего происходит с неметаллами.
2. Стремление к стабильности:
— Образование ионов происходит потому, что атомы стремятся достичь более стабильной электронной конфигурации, обычно такой же, как у ближайшего благородного газа (полностью заполненный внешний электронный слой, правило октета).
— Например, атом натрия (Na) имеет 1 электрон на внешнем слое и ему легче отдать этот электрон, чтобы стать Na⁺ (как Ne).
— Атом хлора (Cl) имеет 7 электронов на внешнем слое и ему легче принять 1 электрон, чтобы стать Cl⁻ (как Ar).
3. Электростатическое притяжение:
— Как известно из физики, разноименные электрические заряды притягиваются друг к другу (положительный притягивается к отрицательному).
— Когда образуются положительно заряженные катионы и отрицательно заряженные анионы, между ними возникает сильное электростатическое притяжение.
4. Ионная связь:
— Это сильное электростатическое притяжение между разноименно заряженными ионами и есть ионная связь.
— Эта связь не является направленной, то есть каждый ион притягивает к себе ионы противоположного заряда со всех сторон.
— В результате образуются кристаллические решетки, где ионы расположены в строгом порядке, чередуясь по знаку заряда.
5. Пример:
— Классический пример — образование хлорида натрия (поваренной соли, NaCl).
— Атом натрия (Na) отдает один электрон атому хлора (Cl).
Na → Na⁺ + e⁻
Cl + e⁻ → Cl⁻
— Затем между положительно заряженным ионом натрия (Na⁺) и отрицательно заряженным ионом хлора (Cl⁻) возникает сильное электростатическое притяжение, образуя ионную связь и, как следствие, кристаллическую структуру NaCl.
Вопрос 4
| Атомы | Схема образования ионов | Схема образования ионной связи |
|---|---|---|
| Na | Na⁰ — e⁻ → Na⁺ | 2Na⁰ + O⁰(2e⁻) → Na⁺₂O⁻² (2) |
| O | O⁰ + 2e⁻ → O²⁻ | |
| Ca | Ca⁰ — 2e⁻ → Ca²⁺ | Ca⁰ + 2F⁰(2e⁻) → Ca⁺²F⁻₂ (2) |
| F | F⁰ + e⁻ → F⁻ | |
| K | K⁰ — e⁻ → K⁺ | 3K⁰ + N⁰(3e⁻) → K⁺₃N⁻³ (3) |
| N | N⁰ + 3e⁻ → N³⁻ | |
| Al | Al⁰ — 3e⁻ → Al³⁺ | Al⁰ + 3F⁰(3e⁻) → Al⁺³F⁻₃ (3) |
| F | F⁰ + e⁻ → F⁻ |
Ионная связь образуется между атомами, которые имеют большую разницу в электроотрицательности, обычно между типичными металлами и типичными неметаллами. В этом процессе происходит полный переход электронов от атома металла к атому неметалла, в результате чего образуются ионы (положительно заряженные катионы и отрицательно заряженные анионы), которые затем притягиваются друг к другу электростатическими силами.
1. Атомы: Na (Натрий) и O (Кислород)
Схема образования ионов:
— Натрий (Na): Натрий — элемент I группы главной подгруппы (щелочной металл). На его внешней электронной оболочке находится 1 электрон. Для достижения стабильной электронной конфигурации благородного газа (как у Неона), атому Натрия энергетически выгодно отдать этот 1 электрон.
— Уравнение: Na⁰ — e⁻ → Na⁺ (атом Натрия теряет 1 электрон и превращается в катион Натрия с зарядом +1).
— Кислород (O): Кислород — элемент VI группы главной подгруппы (неметалл). На его внешней электронной оболочке находится 6 электронов. Для достижения стабильной электронной конфигурации благородного газа (как у Неона), атому Кислорода энергетически выгодно принять 2 электрона.
— Уравнение: O⁰ + 2e⁻ → O²⁻ (атом Кислорода принимает 2 электрона и превращается в анион Кислорода с зарядом -2).
Схема образования ионной связи:
— Чтобы образовать нейтральное соединение, количество отданных электронов должно быть равно количеству принятых электронов. Один атом Кислорода принимает 2 электрона, а один атом Натрия отдает 1 электрон. Следовательно, для реакции потребуется два атома Натрия, чтобы отдать в общей сложности 2 электрона, которые примет один атом Кислорода.
— Уравнение: 2Na⁰ + O⁰ → 2Na⁺ + O²⁻ → Na₂O
— Схема: 2Na⁰ + O⁰(2e⁻) → Na⁺₂O⁻² (2)
— (2e⁻) указывает, что атом кислорода принимает 2 электрона.
— Na⁺₂O⁻² показывает, что образуется соединение, состоящее из двух ионов Na⁺ и одного иона O²⁻.
— (2) в скобках указывает на общее количество переданных электронов.
2. Атомы: Ca (Кальций) и F (Фтор)
Схема образования ионов:
— Кальций (Ca): Кальций — элемент II группы главной подгруппы (щелочноземельный металл). На его внешней электронной оболочке находится 2 электрона. Для достижения стабильной электронной конфигурации благородного газа (как у Аргона), атому Кальция энергетически выгодно отдать эти 2 электрона.
— Уравнение: Ca⁰ — 2e⁻ → Ca²⁺ (атом Кальция теряет 2 электрона и превращается в катион Кальция с зарядом +2).
— Фтор (F): Фтор — элемент VII группы главной подгруппы (галоген). На его внешней электронной оболочке находится 7 электронов. Для достижения стабильной электронной конфигурации благородного газа (как у Неона), атому Фтора энергетически выгодно принять 1 электрон.
— Уравнение: F⁰ + e⁻ → F⁻ (атом Фтора принимает 1 электрон и превращается в анион Фтора с зарядом -1).
Схема образования ионной связи:
— Один атом Кальция отдает 2 электрона, а один атом Фтора принимает 1 электрон. Чтобы сбалансировать перенос электронов, потребуется два атома Фтора, чтобы принять 2 электрона, отданные одним атомом Кальция.
— Уравнение: Ca⁰ + 2F⁰ → Ca²⁺ + 2F⁻ → CaF₂
— Схема: Ca⁰ + 2F⁰(2e⁻) → Ca⁺²F⁻₂ (2)
— (2e⁻) указывает, что два атома фтора принимают по одному электрону каждый, в сумме 2 электрона.
— Ca⁺²F⁻₂ показывает, что образуется соединение, состоящее из одного иона Ca²⁺ и двух ионов F⁻.
— (2) в скобках указывает на общее количество переданных электронов.
3. Атомы: K (Калий) и N (Азот)
Схема образования ионов:
— Калий (K): Калий — элемент I группы главной подгруппы (щелочной металл). На его внешней электронной оболочке находится 1 электрон. Для достижения стабильной электронной конфигурации благородного газа (как у Аргона), атому Калия энергетически выгодно отдать этот 1 электрон.
— Уравнение: K⁰ — e⁻ → K⁺ (атом Калия теряет 1 электрон и превращается в катион Калия с зарядом +1).
— Азот (N): Азот — элемент V группы главной подгруппы (неметалл). На его внешней электронной оболочке находится 5 электронов. Для достижения стабильной электронной конфигурации благородного газа (как у Неона), атому Азота энергетически выгодно принять 3 электрона.
— Уравнение: N⁰ + 3e⁻ → N³⁻ (атом Азота принимает 3 электрона и превращается в анион Азота с зарядом -3).
Схема образования ионной связи:
— Один атом Азота принимает 3 электрона, а один атом Калия отдает 1 электрон. Чтобы сбалансировать перенос электронов, потребуется три атома Калия, чтобы отдать в общей сложности 3 электрона, которые примет один атом Азота.
— Уравнение: 3K⁰ + N⁰ → 3K⁺ + N³⁻ → K₃N
— Схема: 3K⁰ + N⁰(3e⁻) → K⁺₃N⁻³ (3)
— (3e⁻) указывает, что атом азота принимает 3 электрона.
— K⁺₃N⁻³ показывает, что образуется соединение, состоящее из трех ионов K⁺ и одного иона N³⁻.
— (3) в скобках указывает на общее количество переданных электронов.
4. Атомы: Al (Алюминий) и F (Фтор)
Схема образования ионов:
— Алюминий (Al): Алюминий — элемент III группы главной подгруппы (металл). На его внешней электронной оболочке находится 3 электрона. Для достижения стабильной электронной конфигурации благородного газа (как у Неона), атому Алюминия энергетически выгодно отдать эти 3 электрона.
— Уравнение: Al⁰ — 3e⁻ → Al³⁺ (атом Алюминия теряет 3 электрона и превращается в катион Алюминия с зарядом +3).
— Фтор (F): Фтор — элемент VII группы главной подгруппы (галоген). На его внешней электронной оболочке находится 7 электронов. Для достижения стабильной электронной конфигурации благородного газа (как у Неона), атому Фтора энергетически выгодно принять 1 электрон.
— Уравнение: F⁰ + e⁻ → F⁻ (атом Фтора принимает 1 электрон и превращается в анион Фтора с зарядом -1).
Схема образования ионной связи:
— Один атом Алюминия отдает 3 электрона, а один атом Фтора принимает 1 электрон. Чтобы сбалансировать перенос электронов, потребуется три атома Фтора, чтобы принять 3 электрона, отданные одним атомом Алюминия.
— Уравнение: Al⁰ + 3F⁰ → Al³⁺ + 3F⁻ → AlF₃
— Схема: Al⁰ + 3F⁰(3e⁻) → Al⁺³F⁻₃ (3)
— (3e⁻) указывает, что три атома фтора принимают по одному электрону каждый, в сумме 3 электрона.
— Al⁺³F⁻₃ показывает, что образуется соединение, состоящее из одного иона Al³⁺ и трех ионов F⁻.
— (3) в скобках указывает на общее количество переданных электронов.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!