
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страница 37 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
Часть II
1. Дополните схемы образования положительно заряженных ионов. Из букв, соответствующих правильным ответам, вы составите название одного из древнейших природных красителей:
1) Fº + ē → ___________________ Ф
2) Kº – ē →___________________ И
3) Naº – ē →___________________Н
4) Alº – 3ē →__________________Д
5) Baº – 2ē →__________________И
6) Mgº – 2ē →__________________Г
7) Asº + 3ē →__________________Р
8) Caº – 2ē →__________________О
2. Поиграйте в «крестики-нолики». Покажите выигрышный путь, который составляют формулы веществ с ионной химической связью.
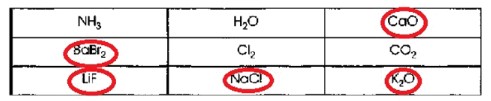
| NH₃ | H₂O | CaO |
|---|---|---|
| BaBr₂ | Cl₂ | CO₂ |
| LiF | NaCl | K₂O |
3. Верны ли следующие утверждения?
А. Электронная схема 2ē, 8ē, 8ē соответствует иону химического элемента, расположенного в 3-м периоде, IA группе.
Б. ⁷₃Li⁰ — ☐☐☐☐ лития и ⁷₃Li⁺ — ☐☐☐ лития имеют разное число электронов.
1) оба суждения верны
2) верно только А
3) верно только Б
4) оба суждения неверны
Часть II
Вопрос 1
| 1. F⁰ + e⁻ → F⁻ | Ф |
| 2. K⁰ — e⁻ → K⁺ | И |
| 3. Na⁰ — e⁻ → Na⁺ | Н |
| 4. Al⁰ — 3e⁻ → Al³⁺ | Д |
| 5. Ba⁰ — 2e⁻ → Ba²⁺ | И |
| 6. Mg⁰ — 2e⁻ → Mg²⁺ | Г |
| 7. As⁰ + 3e⁻ → As³⁻ | P |
| 8. Ca⁰ — 2e⁻ → Ca²⁺ | О |
Название одного из древнейших природных красителей: ИНДИГО.
Вопрос 2
Вопрос 3
А. Электронная схема 2ē, 8ē, 8ē соответствует иону химического элемента, расположенного в 3-м периоде, IA группе. Неверно, так как элемент третьего периода группы IA (натрий, 2 электрона на первом уровне, 8 на втором и 1 внешний) теряет один внешний электрон, образуя ион Na⁺ с электронной конфигурацией 2e, 8e.
Б. ⁷₃Li⁰ – АТОМ лития и ⁷₃Li⁺ – ИОН лития имеют разное число электронов. Это верно, поскольку у иона лития количество электронов меньше на один по сравнению с атомом.
Верно только Б.
Ответ: 3.
Часть II
Вопрос 1
Задание состоит из двух частей:
1. Дополнить схемы химических реакций, показывающих образование ионов из нейтральных атомов.
2. Используя буквы, соответствующие только тем реакциям, где образуются положительно заряженные ионы, составить название древнейшего природного красителя.
Общие принципы образования ионов:
Атомы стремятся достичь стабильной электронной конфигурации (как у благородных газов), для чего они либо теряют, либо приобретают электроны.
— Образование положительных ионов (катионов): Происходит, когда атом теряет электроны. Чаще всего это характерно для металлов. Число потерянных электронов определяет заряд иона (например, потеря 1 электрона → заряд +1; потеря 2 электронов → заряд +2).
— Образование отрицательных ионов (анионов): Происходит, когда атом приобретает электроны. Чаще всего это характерно для неметаллов. Число приобретенных электронов определяет заряд иона (например, приобретение 1 электрона → заряд -1; приобретение 3 электронов → заряд -3).
Анализ каждой схемы:
1. F⁰ + e⁻ → F⁻
— Фтор (F) — это неметалл, находится в 17 группе. У него 7 валентных электронов. Для достижения стабильной электронной оболочки ему нужно приобрести 1 электрон.
— Приобретение электрона приводит к образованию отрицательно заряженного иона.
— Результат: F⁻ (фторид-ион). Это отрицательно заряженный ион.
— Соответствующая буква: Ф
2. K⁰ — e⁻ → K⁺
— Калий (K) — это щелочной металл, находится в 1 группе. У него 1 валентный электрон. Он легко отдаёт 1 электрон, чтобы достичь стабильной электронной оболочки.
— Потеря электрона приводит к образованию положительно заряженного иона.
— Результат: K⁺ (ион калия). Это положительно заряженный ион.
— Соответствующая буква: И
3. Na⁰ — e⁻ → Na⁺
— Натрий (Na) — это щелочной металл, находится в 1 группе. У него 1 валентный электрон. Он легко отдаёт 1 электрон, чтобы достичь стабильной электронной оболочки.
— Потеря электрона приводит к образованию положительно заряженного иона.
— Результат: Na⁺ (ион натрия). Это положительно заряженный ион.
— Соответствующая буква: Н
4. Al⁰ — 3e⁻ → Al³⁺
— Алюминий (Al) — это металл, находится в 13 группе. У него 3 валентных электрона. Он склонен отдавать 3 электрона, чтобы достичь стабильной электронной оболочки.
— Потеря электронов приводит к образованию положительно заряженного иона.
— Результат: Al³⁺ (ион алюминия). Это положительно заряженный ион.
— Соответствующая буква: Д
5. Ba⁰ — 2e⁻ → Ba²⁺
— Барий (Ba) — это щелочноземельный металл, находится во 2 группе. У него 2 валентных электрона. Он легко отдаёт 2 электрона, чтобы достичь стабильной электронной оболочки.
— Потеря электронов приводит к образованию положительно заряженного иона.
— Результат: Ba²⁺ (ион бария). Это положительно заряженный ион.
— Соответствующая буква: И
6. Mg⁰ — 2e⁻ → Mg²⁺
— Магний (Mg) — это щелочноземельный металл, находится во 2 группе. У него 2 валентных электрона. Он легко отдаёт 2 электрона, чтобы достичь стабильной электронной оболочки.
— Потеря электронов приводит к образованию положительно заряженного иона.
— Результат: Mg²⁺ (ион магния). Это положительно заряженный ион.
— Соответствующая буква: Г
7. As⁰ + 3e⁻ → As³⁻
— Мышьяк (As) — это неметалл/металлоид, находится в 15 группе. У него 5 валентных электронов. В данном случае он приобретает 3 электрона, чтобы достичь стабильной электронной оболочки.
— Приобретение электронов приводит к образованию отрицательно заряженного иона.
— Результат: As³⁻ (арсенид-ион). Это отрицательно заряженный ион.
— Соответствующая буква: Р
8. Ca⁰ — 2e⁻ → Ca²⁺
— Кальций (Ca) — это щелочноземельный металл, находится во 2 группе. У него 2 валентных электрона. Он легко отдаёт 2 электрона, чтобы достичь стабильной электронной оболочки.
— Потеря электронов приводит к образованию положительно заряженного иона.
— Результат: Ca²⁺ (ион кальция). Это положительно заряженный ион.
— Соответствующая буква: О
Согласно условию, название красителя составляется «Из букв, соответствующих правильным ответам». Под «правильными ответами» в контексте «Дополните схемы образования положительно заряженных ионов» подразумеваются только те реакции, где образуются положительно заряженные ионы.
Выбираем буквы только из тех реакций, где образовались положительно заряженные ионы (катионы), в порядке следования номеров:
— Реакция 2 (K⁺): И
— Реакция 3 (Na⁺): Н
— Реакция 4 (Al³⁺): Д
— Реакция 5 (Ba²⁺): И
— Реакция 6 (Mg²⁺): Г
— Реакция 8 (Ca²⁺): О
Собирая эти буквы в указанном порядке, получаем слово: ИНДИГО.
Название одного из древнейших природных красителей: ИНДИГО.
Вопрос 2
Для того чтобы сыграть в «крестики-нолики» и найти выигрышный путь, состоящий из веществ с ионной химической связью, необходимо определить тип связи для каждой формулы в таблице.
Общие правила определения типа химической связи:
— Ионная связь: Образуется между атомами металла и неметалла, или между ионом металла и сложным анионом (например, сульфат-ионом), или между ионом аммония и анионом. Характеризуется большой разницей в электроотрицательности (обычно > 1,7). Происходит полный переход электронов от атома металла к атому неметалла.
— Ковалентная полярная связь: Образуется между атомами разных неметаллов. Электроны смещаются к более электроотрицательному атому. Разница в электроотрицательности находится в диапазоне от 0,4 до 1,7.
— Ковалентная неполярная связь: Образуется между атомами одного и того же неметалла. Электроны распределяются равномерно. Разница в электроотрицательности равна 0.
Анализ веществ в таблице:
1. NH₃ (Аммиак)
— Состав: Азот (N) — неметалл, Водород (H) — неметалл.
— Тип связи: Между двумя неметаллами. Разница в электроотрицательности N (3.04) и H (2.20) составляет 0.84.
— Вывод: Ковалентная полярная связь.
2. H₂O (Вода)
— Состав: Кислород (O) — неметалл, Водород (H) — неметалл.
— Тип связи: Между двумя неметаллами. Разница в электроотрицательности O (3.44) и H (2.20) составляет 1.24.
— Вывод: Ковалентная полярная связь.
3. CaO (Оксид кальция)
— Состав: Кальций (Ca) — металл, Кислород (O) — неметалл.
— Тип связи: Между металлом и неметаллом. Разница в электроотрицательности O (3.44) и Ca (1.00) составляет 2.44.
— Вывод: Ионная связь.
4. BaBr₂ (Бромид бария)
— Состав: Барий (Ba) — металл, Бром (Br) — неметалл.
— Тип связи: Между металлом и неметаллом. Разница в электроотрицательности Br (2.96) и Ba (0.89) составляет 2.07.
— Вывод: Ионная связь.
5. Cl₂ (Хлор)
— Состав: Хлор (Cl) — неметалл, Хлор (Cl) — неметалл.
— Тип связи: Между двумя одинаковыми неметаллами. Разница в электроотрицательности Cl (3.16) и Cl (3.16) составляет 0.
— Вывод: Ковалентная неполярная связь.
6. CO₂ (Углекислый газ)
— Состав: Углерод (C) — неметалл, Кислород (O) — неметалл.
— Тип связи: Между двумя неметаллами. Разница в электроотрицательности O (3.44) и C (2.55) составляет 0.89.
— Вывод: Ковалентная полярная связь.
7. LiF (Фторид лития)
— Состав: Литий (Li) — металл, Фтор (F) — неметалл.
— Тип связи: Между металлом и неметаллом. Разница в электроотрицательности F (3.98) и Li (0.98) составляет 3.00.
— Вывод: Ионная связь.
8. NaCl (Хлорид натрия)
— Состав: Натрий (Na) — металл, Хлор (Cl) — неметалл.
— Тип связи: Между металлом и неметаллом. Разница в электроотрицательности Cl (3.16) и Na (0.93) составляет 2.23.
— Вывод: Ионная связь.
9. K₂O (Оксид калия)
— Состав: Калий (K) — металл, Кислород (O) — неметалл.
— Тип связи: Между металлом и неметаллом. Разница в электроотрицательности O (3.44) и K (0.82) составляет 2.62.
— Вывод: Ионная связь.
Поиск выигрышного пути:
Выигрышный путь в «крестиках-ноликах» — это три одинаковых символа (в данном случае, формулы с ионной связью) в одном ряду, столбце или по диагонали.
Рассмотрим строки, столбцы и диагонали:
— Первая строка: NH₃, H₂O, CaO — Не все ионные.
— Вторая строка: BaBr₂, Cl₂, CO₂ — Не все ионные.
— Третья строка: LiF, NaCl, K₂O — Все три вещества имеют ионную связь. Это выигрышный путь!
— Первый столбец: NH₃, BaBr₂, LiF — Не все ионные.
— Второй столбец: H₂O, Cl₂, NaCl — Не все ионные.
— Третий столбец: CaO, CO₂, K₂O — Не все ионные.
— Главная диагональ (сверху слева направо вниз): NH₃, Cl₂, K₂O — Не все ионные.
— Побочная диагональ (сверху справа налево вниз): CaO, Cl₂, LiF — Не все ионные.
Выигрышный путь составляют формулы веществ с ионной химической связью, расположенные в третьей (нижней) строке:
LiF, NaCl, K₂O
Вопрос 3
Анализ утверждения А:
Утверждение А: «Электронная схема 2ē, 8ē, 8ē соответствует иону химического элемента, расположенного в 3-м периоде, IA группе.»
1. Разберем электронную схему 2ē, 8ē, 8ē:
— Эта схема означает, что на первом энергетическом уровне (оболочке) находится 2 электрона.
— На втором энергетическом уровне — 8 электронов.
— На третьем энергетическом уровне — 8 электронов.
— Общее количество электронов в такой частице составляет: 2 + 8 + 8 = 18 электронов.
2. Определим, какому элементу соответствует 18 электронов в нейтральном атоме:
— В нейтральном атоме число электронов равно числу протонов (порядковому номеру элемента).
— Элемент с порядковым номером 18 — это Аргон (Ar).
3. Определим положение Аргона в Периодической системе:
— Аргон (Ar) находится в 3-м периоде (так как имеет 3 электронных слоя) и в VIIIА группе (или 18-й группе), являясь инертным газом.
4. Определим, какой элемент находится в 3-м периоде, IA группе:
— В 3-м периоде, IA группе (или 1-й группе) находится химический элемент Натрий (Na).
— Порядковый номер Натрия — 11.
— Электронная схема нейтрального атома Натрия (Na⁰): 2ē, 8ē, 1ē (всего 11 электронов).
5. Определим электронную схему иона Натрия:
— Натрий — щелочной металл, он стремится отдать один внешний электрон, чтобы завершить внешний электронный слой и приобрести устойчивую конфигурацию ближайшего инертного газа (Неона).
— Ион Натрия (Na⁺) образуется при потере 1 электрона: 11 (протонов) — 1 (электрон) = 10 электронов.
— Электронная схема иона Na⁺: 2ē, 8ē.
6. Сравним:
— Электронная схема, указанная в утверждении А (2ē, 8ē, 8ē), соответствует 18 электронам.
— Электронная схема иона элемента из 3-го периода, IA группы (Na⁺), соответствует 10 электронам (2ē, 8ē).
— Эти схемы не совпадают.
Вывод по утверждению А:
Утверждение А неверно. Ион элемента из 3-го периода, IA группы (Na⁺) имеет электронную схему 2ē, 8ē, а не 2ē, 8ē, 8ē.
Анализ утверждения Б:
Утверждение Б: «⁷₃Li⁰ — атом лития и ⁷₃Li⁺ — ион лития имеют разное число электронов.»
1. Разберем обозначение ⁷₃Li⁰:
— Нижний индекс «3» указывает на порядковый номер элемента в Периодической системе, который равен числу протонов в ядре и числу электронов в нейтральном атоме. Значит, у нейтрального атома Лития (Li⁰) 3 электрона.
— Верхний индекс «7» указывает на массовое число (сумму протонов и нейтронов), которое не влияет на число электронов.
— Верхний правый индекс «0» (или его отсутствие) означает, что это нейтральный атом.
2. Разберем обозначение ⁷₃Li⁺:
— Нижний индекс «3» по-прежнему означает 3 протона.
— Верхний правый индекс «⁺» означает, что это ион с зарядом +1. Положительный заряд означает, что атом потерял электроны. Заряд +1 означает потерю одного электрона.
— Следовательно, у иона Лития (Li⁺) число электронов равно: 3 (протона) — 1 (потерянный электрон) = 2 электрона.
3. Сравним число электронов:
— У атома ⁷₃Li⁰ — 3 электрона.
— У иона ⁷₃Li⁺ — 2 электрона.
— Число электронов (3 и 2) разное.
Вывод по утверждению Б:
Утверждение Б верно. Атом и ион одного и того же элемента всегда имеют разное число электронов (если ион не является нейтральным, что тогда он был бы атомом).
Общий вывод:
— Утверждение А — неверно.
— Утверждение Б — верно.
Следовательно, правильный вариант ответа: 3) верно только Б.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!