
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страница 38 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
4. Подчеркните пары химических элементов, между которыми образуется ионная химическая связь.
1) калий и кислород
2) водород и фосфор
3) алюминий и фтор
4) водород и азот
Составьте схемы образования химической связи между выбранными элементами.
5*. Придумайте рисунок в стиле комиксов, отражающий процесс образования ионной химической связи.
6. Составьте схему образования двух химических соединений с ионной связью по условной записи: А° + 2Б° → А²⁺Б₂⁻.
Выберите химические элементы «А» и «Б» из следующего списка:
кальций, хлор, калий, кислород, азот, алюминий, магний, углерод, бром.
Вопрос 4
1) калий и кислород
K⁰ — e⁻ → K⁺
O⁰ + 2e⁻ → O²⁻
2K⁰ + O⁰(2e⁻) → K⁺₂O²⁻ (2)
3) алюминий и фтор
Al⁰ — 3e⁻ → Al³⁺
F⁰ + e⁻ → F⁻
Al⁰ + 3F⁰(3e⁻) → Al⁺³F⁻₃ (3)
Ответ: 1, 3.
Вопрос 5
Образование ионной связи:
Вопрос 6
Кальций, хлор, магний, бром:
Ca⁰ — 2e⁻ → Ca²⁺
Cl⁰ + e⁻ → Cl⁻
Ca⁰ + 2Cl⁰ → Ca⁺²Cl⁻₂
Mg⁰ — 2e⁻ → Mg²⁺
Br⁰ + e⁻ → Br⁻
Mg⁰ + 2Br⁰ → Mg⁺²Br⁻₂
Вопрос 4
Ионная связь образуется между элементами, которые имеют значительные различия в электроотрицательности. Обычно это происходит между металлами и неметаллами. В данном случае мы рассмотрим пары элементов, которые могут образовывать ионные связи.
Выбор пар элементов:
1) Калий и кислород (K и O)
Калий (K) — металл группы IA, который легко отдает один электрон, образуя положительный ион K⁺. Кислород (O) — неметалл, который принимает два электрона, образуя отрицательный ион O²⁻.
Схема образования связи:
K⁰ — e⁻ → K⁺
O⁰ + 2e⁻ → O²⁻
В результате реакции образуется ионное соединение:
2K⁺ + O²⁻ → K₂O
2) Водород и фосфор (H и P)
Водород (H) может образовывать ковалентные связи с фосфором (P), но не образует ионную связь, так как оба элемента имеют схожие электроотрицательности. Поэтому эта пара не подходит.
3) Алюминий и фтор (Al и F)
Алюминий (Al) — металл, который может отдавать три электрона, образуя положительный ион Al³⁺. Фтор (F) — неметалл, который принимает один электрон, образуя отрицательный ион F⁻.
Схема образования связи:
Al⁰ — 3e⁻ → Al³⁺
F⁰ + e⁻ → F⁻
В результате реакции образуется ионное соединение:
Al³⁺ + 3F⁻ → AlF₃
4) Водород и азот (H и N)
Водород (H) и азот (N) также образуют ковалентные связи, а не ионные. Азот может делиться электронами с водородом, формируя молекулу NH₃ (аммиак), но не образует ионную связь.
Таким образом, пары элементов, между которыми образуется ионная связь, это:
— Калий и кислород (1)
— Алюминий и фтор (3)
Ответ: 1, 3.
Вопрос 5
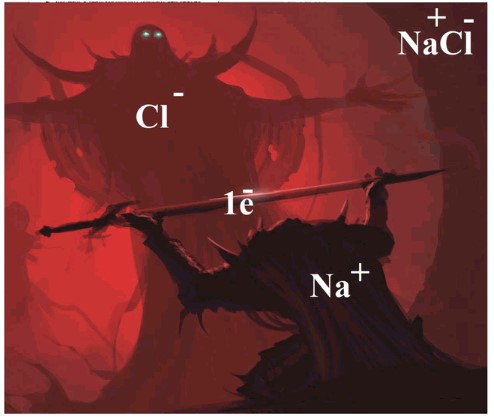
Изображение в стиле комиксов наглядно демонстрирует процесс образования ионной химической связи на примере хлорида натрия (поваренной соли), NaCl.
— Большая фигура (Cl⁻):
Представляет атом хлора (Cl), который является неметаллом и обладает высокой электроотрицательностью. Он стремится принять электроны для достижения стабильной электронной конфигурации. На изображении он показан как могущественная фигура, готовая принять «дар». После принятия электрона атом хлора превращается в отрицательно заряженный ион хлорида (Cl⁻).
— Маленькая фигура (Na⁺):
Представляет атом натрия (Na), который является щелочным металлом и обладает низкой электроотрицательностью. Он легко отдает один электрон, чтобы достичь стабильной электронной конфигурации. На изображении он показан как рыцарь, предлагающий «меч». После потери электрона атом натрия превращается в положительно заряженный ион натрия (Na⁺).
— Меч (1e⁻):
Символизирует один электрон (1e⁻), который передается от атома натрия к атому хлора. Это ключевой момент в образовании ионной связи — полная передача электрона, а не его обобществление.
— Надпись в правом верхнем углу (Na⁺Cl⁻):
Обозначает образовавшееся ионное соединение — хлорид натрия. После передачи электрона между положительно заряженным ионом натрия (Na⁺) и отрицательно заряженным ионом хлорида (Cl⁻) возникает сильное электростатическое притяжение, которое и формирует ионную связь, удерживающую их вместе в кристаллической решетке.
Таким образом, рисунок метафорически показывает, как атом натрия «отдает» свой электрон атому хлора, в результате чего они оба становятся ионами с противоположными зарядами, которые притягиваются друг к другу, образуя стабильное соединение.
Вопрос 6
Для составления схемы образования химических соединений с ионной связью по условной записи А° + 2Б° → А²⁺Б₂⁻, необходимо выполнить следующие шаги:
1. Понимание условной записи:
— А°: Нейтральный атом элемента «А».
— Б°: Нейтральный атом элемента «Б».
— А²⁺: Ион элемента «А» с зарядом +2 (это означает, что атом «А» отдал 2 электрона).
— Б⁻: Ион элемента «Б» с зарядом -1 (это означает, что атом «Б» принял 1 электрон).
— 2Б°: Требуется два атома элемента «Б», потому что каждый атом «Б» принимает только один электрон, а атом «А» отдает два электрона.
— А²⁺Б₂⁻: Образовавшееся ионное соединение, где один ион «А» с зарядом +2 связан с двумя ионами «Б» с зарядом -1.
2. Выбор подходящих элементов из списка:
— Для элемента «А» (который образует ион А²⁺): Нам нужен элемент, который является металлом и легко отдает 2 электрона, чтобы достичь стабильной электронной конфигурации. Из предложенного списка подходят:
- Кальций (Ca): Щелочноземельный металл, находится во 2-й группе, легко отдает 2 электрона.
- Магний (Mg): Щелочноземельный металл, находится во 2-й группе, легко отдает 2 электрона.
— Для элемента «Б» (который образует ион Б⁻): Нам нужен элемент, который является неметаллом и легко принимает 1 электрон, чтобы достичь стабильной электронной конфигурации. Из предложенного списка подходят:
- Хлор (Cl): Галоген, находится в 17-й группе, легко принимает 1 электрон.
- Бром (Br): Галоген, находится в 17-й группе, легко принимает 1 электрон.
3. Составление схем образования соединений:
Пример 1: Соединение из Кальция (А) и Хлора (Б)
— Атом Кальция (Ca⁰): Кальций является металлом и стремится отдать 2 электрона, чтобы стать стабильным ионом с зарядом +2 (Ca²⁺), подобно инертному газу аргону.
— Схема потери электронов: Ca⁰ — 2e⁻ → Ca²⁺
— Атом Хлора (Cl⁰): Хлор является неметаллом и стремится принять 1 электрон, чтобы стать стабильным ионом с зарядом -1 (Cl⁻), подобно инертному газу аргону.
— Схема принятия электронов: Cl⁰ + e⁻ → Cl⁻
— Образование связи: Поскольку один атом кальция отдает 2 электрона, а один атом хлора может принять только 1 электрон, для образования нейтрального соединения требуется два атома хлора, чтобы принять оба электрона от кальция.
— Общая схема реакции: Ca⁰ + 2Cl⁰ → Ca²⁺ + 2Cl⁻
— Формула соединения: Ca⁺²Cl⁻₂ (или CaCl₂)
Пример 2: Соединение из Магния (А) и Брома (Б)
— Атом Магния (Mg⁰): Магний является металлом и стремится отдать 2 электрона, чтобы стать стабильным ионом с зарядом +2 (Mg²⁺), подобно инертному газу неону.
— Схема потери электронов: Mg⁰ — 2e⁻ → Mg²⁺
— Атом Брома (Br⁰): Бром является неметаллом и стремится принять 1 электрон, чтобы стать стабильным ионом с зарядом -1 (Br⁻), подобно инертному газу криптону.
— Схема принятия электронов: Br⁰ + e⁻ → Br⁻
— Образование связи: Аналогично первому примеру, один атом магния отдает 2 электрона, а один атом брома может принять только 1 электрон. Следовательно, для образования нейтрального соединения требуется два атома брома.
— Общая схема реакции: Mg⁰ + 2Br⁰ → Mg²⁺ + 2Br⁻
— Формула соединения: Mg⁺²Br⁻₂ (или MgBr₂)
Таким образом, в обоих случаях атомы металлов (Кальций, Магний) отдают электроны, а атомы неметаллов (Хлор, Бром) принимают их. Полная передача электронов приводит к образованию противоположно заряженных ионов, которые притягиваются друг к другу электростатическими силами, формируя стабильную ионную связь.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!