
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 167-170 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
Часть I
1. Электролиты — это
__________________________________________________________
Признаки электролитов:
— состоят из □□□□;
— растворяются в □□□.
2. Диссоциация — это
__________________________________________________________
3. Основные положения ТЭД.
1) По способности проводить электрический ток в растворах
2) В растворах электролиты □□□□□□□□□□ на □□□□, т. е. □□□□□□□□□□□□□□. Ионы различают:
3) Разные электролиты по-разному диссоциируют на ионы, что характеризует степень электролитической диссоциации — □.
\( \alpha = \frac{\text{кол-во в-ва электролита, распавшегося на ионы}}{\text{кол-во в-ва растворённого вещества}} \)
α зависит:
— от природы электролита, например:
______________________________________________________
— от разбавления (как?)
______________________________________________________
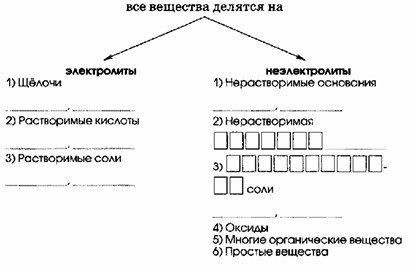
4) Как электролиты, все вещества делятся на три класса.
а) Кислоты — это электролиты, которые диссоциируют на □□□□□□□□ и □□□□□□□□.
Например: HNO₃ — □ + □, H₂SO₄ — □ + □
б) Основания —
Например: KOH — □ + □, Ba(OH)₂ — □ + □
в) Соли —
Например: Fe(NO₃)₃ — □ + □, AlCl₃ — □ + □
§35
Часть I
Вопрос 1
Электролиты — это вещества, чьи растворы способны проводить электрический ток.
Признаки электролитов:
— состоят из ИОНОВ
— растворяются в ВОДЕ
Вопрос 2
Диссоциация — это процесс разделения электролита на ионы.
Вопрос 3
1) По способности проводить электрический ток в растворах все вещества делятся на:
| Электролиты | Неэлектролиты |
|---|---|
| 1) Щелочи NaOH, KOH, Ba(OH)2 | 1) Нерастворимые основания Fe(OH)3, Zn(OH)2 |
| 2) Растворимые кислоты HNO3, H2SO4, HCl | 2) Нерастворимая кислота H2SiO3 |
| 3) Растворимые соли BaCl2, Ca(NO3)2, Li2SO4 | 3) Нерастворимые соли AgBr, BaSO4 |
| 4) Оксиды | |
| 5) Многие органические вещества | |
| 6) Простые вещества |
2) В растворах электролиты РАСПАДАЮТСЯ на ионы, т. е. ДИССОЦИИРУЮТ.
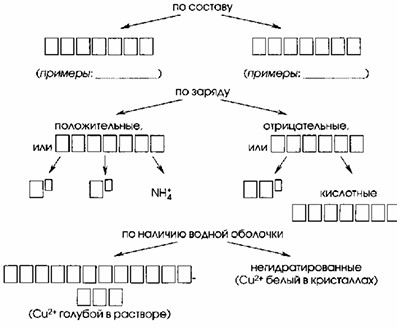
Ионы различают:
По составу:
| Простые | Сложные |
|---|---|
| Na+, K+, Ba2+, Cl— | NH4+, SO42-, PO43- |
По заряду:
| Положительные, или КАТИОНЫ | Отрицательные, или АНИОНЫ |
|---|---|
| Na+, K+, NH4+ | OH—, кислотные остатки |
По наличию водной оболочки:
— ГИДРАТИРОВАННЫЕ
— Негидратированные
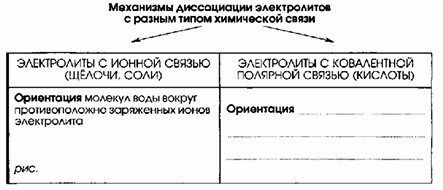
| Механизмы диссоциации электролитов с разным типом химической связи | |
|---|---|
| С ионной связью | С ковалентной полярной связью |
| Ориентация молекул воды вокруг противоположно заряженных ионов электролита | Ориентация молекул воды вокруг полюсов молекулы электролита |
| Гидратация — процесс, при котором молекулы воды вступают во взаимодействие с ионами поверхностного слоя кристалла, имеющими противоположный заряд. | Гидратация — процесс, при котором молекулы воды взаимодействуют с молекулами электролита. |
| — | Ионизация — превращение ковалентной полярной связи в ионную |
| Диссоциация – распад кристалла электролита на гидратированные ионы. | Диссоциация – распад молекул электролита на гидратированные ионы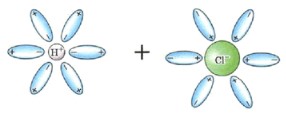
|
3) разные электролиты по-разному диссоциируют на ионы, что характеризует степень электролитической диссоциации – α
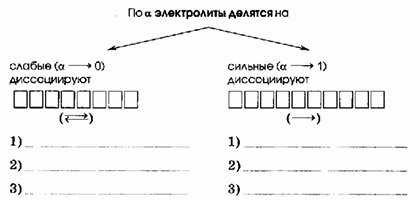
По α электролиты делятся на:
Слабые – диссоциируют ОБРАТИМО
1) H₂S
2) H₂SO₃
3) H₂CO₃
Сильные – диссоциируют НЕОБРАТИМО
1) KOH
2) NaCl
3) H₂SO₄
α зависит:
— от природы электролита, например: у растворимой сильной кислоты HCl α=1, у нерастворимой слабой H₂SiO₃ α<0,03
— от разбавления: чем больше разбавление, тем больше α
4) Как электролиты, все вещества делятся на три класса.
а) Кислоты – это электролиты, которые диссоциируют на катионы водорода и анионы кислотного остатка:
HNO₃ → H⁺ + NO₃⁻
H₂SO₄ → 2H⁺ + SO₄²⁻
б) Основания – это электролиты, которые диссоциируют на катионы металла и гидроксид-анионы:
KOH → K⁺ + OH⁻
Ba(OH)₂ → Ba²⁺ + 2OH⁻
в) Соли – это электролиты, которые диссоциируют на катионы металла и анионы кислотного остатка:
Fe(NO₃)₃ → Fe³⁺ + 3NO₃⁻
AlCl₃ → Al³⁺ + 3Cl⁻
Для более глубокого понимания представленного материала, давайте подробно разберем каждый пункт, опираясь на фундаментальные принципы химии.
Часть I
Вопрос 1
Электролиты — это особый класс химических соединений, которые обладают уникальной способностью: при растворении в подходящем растворителе (чаще всего в воде) или при расплавлении они образуют подвижные электрически заряженные частицы — ионы. Именно наличие этих свободных ионов позволяет раствору или расплаву проводить электрический ток. В отличие от металлов, где ток переносят электроны, в растворах электролитов ток переносят ионы.
Признаки электролитов:
— состоят из ИОНОВ (или способны их образовывать):
Это ключевой признак. Вещества с ионной связью (например, соли, щелочи) уже в твердом состоянии состоят из ионов, расположенных в кристаллической решетке. При растворении эти ионы освобождаются. Вещества с ковалентной полярной связью (например, кислоты) изначально состоят из нейтральных молекул, но при взаимодействии с полярным растворителем (водой) они ионизируются, то есть происходит разрыв ковалентной связи с образованием ионов.
— растворяются в ВОДЕ (или другом полярном растворителе):
Вода является полярным растворителем, что означает, что её молекулы имеют частичные положительные и отрицательные заряды (диполи). Эти диполи воды способны взаимодействовать с ионами или полярными молекулами электролита, ослабляя связи внутри вещества и «вырывая» ионы или способствуя их образованию. Этот процесс называется гидратацией (если растворитель вода) или сольватацией (для общего случая). Неполярные растворители (например, бензин) не могут растворять электролиты, так как не способны эффективно взаимодействовать с заряженными частицами.
Вопрос 2
Термин «диссоциация» в широком смысле означает распад сложного вещества на более простые части. В контексте электролитов, это процесс, при котором исходное вещество (будь то ионный кристалл или полярная молекула) распадается на положительно и отрицательно заряженные ионы при растворении или плавлении. Этот процесс является основой электропроводности растворов.
Вопрос 3
1) По способности проводить электрический ток в растворах все вещества делятся на:
Электролиты: Вещества, которые при растворении или расплавлении образуют ионы и проводят электрический ток.
- Щёлочи (сильные основания): NaOH, KOH, Ba(OH)₂. Это ионные соединения, которые полностью диссоциируют на ионы металла (катион) и гидроксид-ионы (анион) в воде. Например, NaOH → Na⁺ + OH⁻.
- Растворимые кислоты (сильные и некоторые слабые): HNO₃, H₂SO₄, HCl. Эти вещества имеют ковалентную полярную связь. В воде они ионизируются, образуя ионы водорода (H⁺, который сразу же гидратируется в H₃O⁺) и анионы кислотного остатка. Например, HCl → H⁺ + Cl⁻.
- Растворимые соли: BaCl₂, Ca(NO₃)₂, Li₂SO₄. Это ионные соединения, которые диссоциируют на катионы металла и анионы кислотного остатка. Например, NaCl → Na⁺ + Cl⁻.
Неэлектролиты: Вещества, которые при растворении или расплавлении не образуют ионов и, следовательно, не проводят электрический ток.
- Нерастворимые основания: Fe(OH)₃, Zn(OH)₂. Хотя это ионные соединения, их очень низкая растворимость в воде означает, что в раствор переходит ничтожно малое количество ионов, недостаточное для проведения тока.
- Нерастворимая кислота: H₂SiO₃ (кремниевая кислота). Аналогично нерастворимым основаниям, её очень низкая растворимость препятствует образованию достаточного количества ионов.
- Нерастворимые соли: AgBr, BaSO₄. По той же причине низкой растворимости, они не являются электролитами.
- Оксиды: Большинство оксидов (CO₂, SiO₂, Fe₂O₃ и т.д.) не образуют свободных ионов в воде. Некоторые кислотные оксиды (например, SO₃) реагируют с водой, образуя кислоты, которые уже являются электролитами, но сами оксиды — нет.
- Многие органические вещества: Сахар (сахароза), спирты (этанол), бензин, ацетон. Эти вещества имеют преимущественно ковалентные неполярные или слабополярные связи и не способны образовывать ионы в растворе.
- Простые вещества: O₂, N₂, Fe, Cu. В чистом виде или в растворе они не диссоциируют на ионы.
2) В растворах электролиты РАСПАДАЮТСЯ на ионы, т. е. ДИССОЦИИРУЮТ. Ионы различают:
По составу:
- Простые: Состоят из одного атома, который приобрел или потерял электроны. Примеры: Na⁺, K⁺, Ba²⁺, Cl⁻, Br⁻.
- Сложные (многоатомные): Состоят из нескольких атомов, связанных ковалентными связями, но несущих общий заряд. Примеры: NH₄⁺ (аммоний), SO₄²⁻ (сульфат), PO₄³⁻ (фосфат), NO₃⁻ (нитрат).
По заряду:
- Положительные, или КАТИОНЫ: Ионы, имеющие положительный заряд (потеряли электроны). Примеры: Na⁺, K⁺, NH₄⁺. В электрическом поле движутся к катоду (отрицательному полюсу).
- Отрицательные, или АНИОНЫ: Ионы, имеющие отрицательный заряд (приобрели электроны). Примеры: OH⁻ (гидроксид-ион), Cl⁻ (хлорид-ион), SO₄²⁻ (сульфат-ион), а также все кислотные остатки. В электрическом поле движутся к аноду (положительному полюсу).
По наличию водной оболочки:
- ГИДРАТИРОВАННЫЕ: Ионы, окруженные молекулами воды, которые ориентированы вокруг иона своими противоположно заряженными концами. Этот процесс называется гидратацией и стабилизирует ионы в растворе, предотвращая их обратное соединение. Пример: Cu²⁺ в растворе имеет голубой цвет из-за гидратации.
- Негидратированные: Ионы, которые не окружены молекулами воды. Это характерно для ионов в твердом кристаллическом состоянии. Пример: Cu²⁺ в кристалле CuSO₄ безводного имеет белый цвет.
Механизмы диссоциации электролитов с разным типом химической связи:
ЭЛЕКТРОЛИТЫ С ИОННОЙ СВЯЗЬЮ (ЩЕЛОЧИ, СОЛИ):
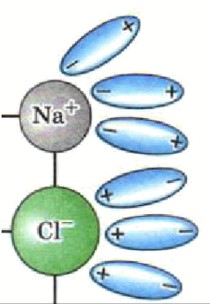
Ориентация молекул воды: Молекулы воды (диполи) окружают ионы в кристаллической решетке. Положительные полюса молекул воды (сторона водорода) ориентируются к отрицательно заряженным анионам, а отрицательные полюса (сторона кислорода) — к положительно заряженным катионам.
Гидратация: Это взаимодействие молекул воды с ионами на поверхности кристалла. Молекулы воды «вырывают» ионы из кристаллической решетке, окружают их и удерживают в растворе, предотвращая их обратное соединение. Это чисто физический процесс разделения уже существующих ионов.
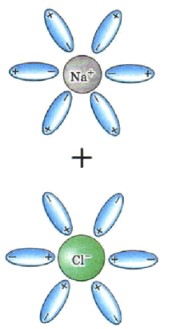
Диссоциация: Это распад кристаллической решетки электролита на гидратированные ионы. Например, при растворении NaCl в воде, ионы Na⁺ и Cl⁻, уже существующие в кристалле, отделяются друг от друга и окружаются молекулами воды.
Рисунок: Представьте Na⁺, окруженный молекулами воды, повернутыми к нему кислородом (отрицательным полюсом), и Cl⁻, окруженный молекулами воды, повернутыми к нему водородом (положительным полюсом).
ЭЛЕКТРОЛИТЫ С КОВАЛЕНТНОЙ ПОЛЯРНОЙ СВЯЗЬЮ (КИСЛОТЫ):
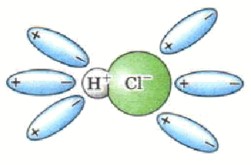
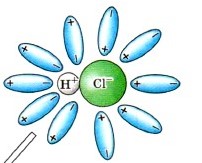
Ориентация молекул воды: Молекулы воды ориентируются вокруг полюсов молекулы электролита. Например, в молекуле HCl, водород имеет частичный положительный заряд (δ⁺), а хлор — частичный отрицательный (δ⁻). Молекулы воды будут подходить к водороду своим отрицательным полюсом и к хлору — положительным.
Гидратация: Это взаимодействие молекул воды с молекулами электролита. Вода не просто окружает молекулу, а активно взаимодействует с её полярными связями.
Ионизация: Это ключевой этап для ковалентных электролитов. Под действием полярных молекул воды происходит превращение ковалентной полярной связи в ионную. Молекула воды «отрывает» протон (H⁺) от молекулы кислоты, образуя гидроксоний-ион (H₃O⁺) и анион кислотного остатка. Это химический процесс образования ионов из нейтральных молекул.
Диссоциация: Это распад молекул электролита на гидратированные ионы, который происходит после ионизации. Например, при растворении HCl в воде, молекулы воды взаимодействуют с молекулами HCl, разрывая ковалентную связь H-Cl и образуя ионы H⁺ (который тут же становится H₃O⁺) и Cl⁻.
Рисунок: Представьте молекулу HCl, окруженную молекулами воды. Одна молекула воды «забирает» H⁺, образуя H₃O⁺, а оставшийся Cl⁻ также гидратируется.
3) Разные электролиты по-разному диссоциируют на ионы, что характеризует степень электролитической диссоциации – α.
Степень электролитической диссоциации (α): Это количественная характеристика, показывающая, какая доля молекул (или формульных единиц) электролита распалась на ионы в данном растворе.
Формула:
α = (количество вещества электролита, распавшегося на ионы) / (общее количество растворенного вещества)
Подробное объяснение: α всегда находится в диапазоне от 0 до 1 (или от 0% до 100%). Если α = 1 (или 100%), это означает, что все молекулы (или формульные единицы) электролита распались на ионы. Если α близко к 0, это означает, что лишь малая часть вещества диссоциировала.
По α электролиты делятся на:
Слабые – диссоциируют ОБРАТИМО (↔):
Это электролиты, у которых степень диссоциации α очень мала (α → 0), обычно менее 3-5%. Это означает, что лишь небольшая часть их молекул распадается на ионы. Процесс диссоциации для них является обратимым, то есть одновременно с распадом молекул на ионы происходит и обратный процесс — соединение ионов обратно в нейтральные молекулы. В растворе устанавливается динамическое равновесие.
Примеры:
1) H₂S (сероводородная кислота)
2) H₂SO₃ (сернистая кислота)
3) H₂CO₃ (угольная кислота)
Дополнительные примеры: NH₃·H₂O (гидроксид аммония), большинство органических кислот (например, уксусная кислота CH₃COOH).
Сильные – диссоциируют НЕОБРАТИМО (→):
Это электролиты, у которых степень диссоциации α близка к 1 (α → 1), то есть они практически полностью диссоциируют на ионы в растворе. Процесс диссоциации для них является необратимым (или практически необратимым), что означает, что обратный процесс (соединение ионов обратно в молекулы) практически не происходит.
Примеры:
1) KOH (гидроксид калия – сильное основание)
2) NaCl (хлорид натрия – растворимая соль)
3) H₂SO₄ (серная кислота – сильная кислота)
Дополнительные примеры: HCl, HNO₃, NaOH, K₂SO₄.
α зависит:
— от природы электролита:
Это самый важный фактор. Сила электролита определяется прочностью химической связи в его молекуле (для ковалентных соединений) или в кристаллической решетке (для ионных соединений), а также способностью растворителя (воды) взаимодействовать с этими связями/ионами. Например, у сильной кислоты HCl, связь H-Cl очень полярна и легко разрывается водой, поэтому α=1. У слабой нерастворимой кислоты H₂SiO₃, связь H-SiO прочнее, и сама молекула плохо взаимодействует с водой, а также низкая растворимость, что приводит к очень низкой диссоциации (α<0,03).
— от разбавления: чем больше разбавление, тем больше α.
Для слабых электролитов разбавление раствора (добавление большего количества растворителя) приводит к увеличению степени диссоциации. Это объясняется принципом Ле Шателье: при увеличении объема раствора, равновесие диссоциации смещается в сторону образования большего числа ионов, чтобы компенсировать уменьшение их концентрации. Для сильных электролитов этот эффект менее заметен, так как они уже практически полностью диссоциированы.
4) Как электролиты, все вещества делятся на три класса.
По своему химическому составу и по типу ионов, которые они образуют при диссоциации в водном растворе, электролиты традиционно делятся на три основные группы: кислоты, основания и соли. Эта классификация основывается на теории электролитической диссоциации шведского ученого Сванте Аррениуса.
а) Кислоты – это электролиты, которые диссоциируют на КАТИОНЫ ВОДОРОДА и АНИОНЫ КИСЛОТНОГО ОСТАТКА.
Согласно определению Аррениуса, кислотами называют вещества, которые при растворении в воде образуют в качестве единственных положительно заряженных ионов (катионов) ионы водорода (H⁺). Важно понимать, что в водном растворе свободный ион водорода (протон) не может существовать самостоятельно из-за своей высокой реакционной способности и малого размера. Он немедленно присоединяется к молекуле воды, образуя более стабильный ион гидроксония (H₃O⁺). Поэтому, хотя в уравнениях диссоциации часто пишут H⁺ для упрощения, фактически в растворе присутствует H₃O⁺.
Примеры:
HNO₃ → H⁺ + NO₃⁻
Это уравнение показывает диссоциацию азотной кислоты. Она распадается на один ион водорода (или гидроксония) и один нитрат-ион. Азотная кислота является сильной кислотой, поэтому диссоциация практически полная.
H₂SO₄ → 2H⁺ + SO₄²⁻
Это пример диссоциации серной кислоты. Она является двухосновной кислотой, что означает, что одна её молекула способна отдать два иона водорода. Диссоциация многоосновных кислот происходит ступенчато. Например, для серной кислоты первая ступень: H₂SO₄ ↔ H⁺ + HSO₄⁻ (гидросульфат-ион). А затем вторая ступень: HSO₄⁻ ↔ H⁺ + SO₄²⁻ (сульфат-ион). Поскольку серная кислота сильная, обе ступени диссоциации протекают практически полностью, и для краткости часто записывают суммарное уравнение.
б) Основания – это электролиты, которые диссоциируют на катионы металла и гидроксид-анионы.
По теории Аррениуса, основаниями являются вещества, которые при растворении в воде образуют в качестве единственных отрицательно заряженных ионов (анионов) гидроксид-ионы (OH⁻). Основания, хорошо растворимые в воде, называются щелочами.
Примеры:
KOH → K⁺ + OH⁻
Это уравнение диссоциации гидроксида калия. Он распадается на ион калия (катион металла) и гидроксид-ион. Гидроксид калия является сильным основанием (щелочью), поэтому его диссоциация в растворе практически полная.
Ba(OH)₂ → Ba²⁺ + 2OH⁻
Это пример диссоциации гидроксида бария. Он является двукислотным основанием, то есть одна его молекула способна отдать два гидроксид-иона. Гидроксид бария также относится к сильным основаниям (щелочам).
в) Соли – это электролиты, которые диссоциируют на катионы металла и анионы кислотного остатка.
Соли — это класс химических соединений, которые образуются в результате замещения атомов водорода в кислоте на атомы металла (или аммония) или замещения гидроксильных групп в основании на кислотные остатки. При растворении в воде соли распадаются на положительно заряженные ионы металла (или аммония) и отрицательно заряженные ионы кислотного остатка. Большинство растворимых солей являются сильными электролитами.
Примеры:
Fe(NO₃)₃ → Fe³⁺ + 3NO₃⁻
Это уравнение диссоциации нитрата железа(III). При растворении он распадается на один ион железа(III) (катион металла) и три нитрат-иона (анионы кислотного остатка).
AlCl₃ → Al³⁺ + 3Cl⁻
Это пример диссоциации хлорида алюминия. Он распадается на один ион алюминия(III) (катион металла) и три хлорид-иона (анионы кислотного остатка).
Таким образом, эта классификация позволяет систематизировать электролиты по их поведению в водном растворе и типу образующихся ионов, что является фундаментальным для понимания многих химических реакций и процессов.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.






Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!