
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страница 40 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
§9
Часть I
1. Связь между ______ элементов- ______ (укажите тип элементов) за счёт образования _____________ называется ___________ или атомной.
2. АЛГОРИТМ СОСТАВЛЕНИЯ СХЕМЫ ОБРАЗОВАНИЯ МОЛЕКУЛ СОЕДИНЕНИЯ С КОВАЛЕНТНОЙ СВЯЗЬЮ (на примере N₂):
1) Определите число электронов на внешнем уровне (N) у атомов неметаллов и число непарных электронов по формуле 8 — N.
2) Запишите электронные схемы атомов неметалла через знак «+» так, чтобы непарные электроны были обращены к соседнему знаку.
3) Поставьте стрелку и запишите электронную формулу молекулы, выделив обобществлённые электронные пары.
4) Запишите структурную формулу образовавшейся молекулы, обозначив каждую общую электронную пару чёрточкой.
3. По числу общих электронных пар между атомами различают (приведите примеры):
1) _______________ связь
2) __________ связь
3) __________ связь
§9
Часть I
Вопрос 1
Связь между АТОМАМИ элементов-НЕМЕТАЛЛОВ за счет образования ОБЩИХ ЭЛЕКТРОННЫХ ПАР называется КОВАЛЕНТНОЙ или атомной.
Вопрос 2
Алгоритм составления схемы образования молекул соединения с ковалентной связью (на примере N₂).
1) Определите число электронов на внешнем уровне (N) у атомов неметаллов и число непарных электронов по формуле 8-N:
8-N = 8-5 = 3
2) Запишите электронные схемы атомов неметалла через знак «+» так, чтобы непарные электроны были обращены к соседнему знаку:
3) Поставьте стрелку и запишите электронную формулу молекулы, выделив обобществленные электронные пары:
4) Запишите структурную формулу образовавшейся молекулы, обозначив каждую общую электронную пару черточкой:
N≡N
Вопрос 3
По числу общих электронных пар между атомами различают:
1) ОДИНАРНАЯ связь: H-H, F-F, Cl-Cl, Br-Br
2) ДВОЙНАЯ связь: O=O, H₂C=CH₂
3) ТРОЙНАЯ связь: N≡N, HC≡CH
§9
Часть I
Вопрос 1
Связь между атомами элементов-неметаллов за счёт образования общих электронных пар называется ковалентной или атомной.
Подробное объяснение:
1. Связь между атомами элементов-неметаллов:
— В вопросе нас просят определить тип связи между атомами. Когда мы говорим о «связи между атомами», это подразумевает взаимодействие между двумя атомами, которое держит их вместе в молекуле или соединении.
— Неметаллы — это такие элементы, как углерод (C), кислород (O), азот (N), сера (S) и другие элементы, которые обладают высоким уровнем электроотрицательности. Это означает, что они склонны принимать электроны, а не отдавать их, как металлы.
2. За счёт образования общих электронных пар:
— Ключевая особенность в химии атомов неметаллов заключается в том, что они обмениваются электронами с другими атомами, чтобы достичь более стабильной электронной конфигурации. Это называется образование общих электронных пар.
— Общие электронные пары — это когда два атома делят один или несколько электронов между собой. Например, в молекуле водорода (H₂) два атома водорода делят по одному электрону, образуя общую пару электронов.
3. Ковалентная связь или атомная связь:
— Ковалентная связь — это химическая связь, при которой два атома делят свои электроны, образуя общие электронные пары. Эта связь чаще всего встречается между неметаллами.
— Например, в молекуле воды (H₂O) атомы водорода и кислорода делят электроны, образуя ковалентные связи.
— Ковалентная связь также называется атомной, потому что атомы создают связь посредством электронов, и эта связь непосредственно связана с поведением атомов в молекуле.
4. Примеры:
— В молекуле водорода (H₂) два атома водорода (H) делят по одному электрону, образуя ковалентную связь.
— В молекуле кислорода (O₂) два атома кислорода (O) делят два электрона, образуя двойную ковалентную связь.
— В молекуле углекислого газа (CO₂) углерод (C) и кислород (O) образуют двойные ковалентные связи, деля по два электрона.
Вопрос 2
Давайте разберем каждый шаг алгоритма составления схемы образования молекул соединения с ковалентной связью на примере молекулы N₂ (азот).
1) Определите число электронов на внешнем уровне (N) у атомов неметаллов и число непарных электронов по формуле \(8 — N\):
— Азот (N) находится в 5-й группе Периодической таблицы. У атома азота 5 электронов на внешнем уровне (2s² 2p³).
— Для того чтобы определить непарные электроны, используем формулу:
\(8 — N = 8 — 5 = 3\)
Это значит, что у атома азота 3 непарных электрона на внешнем уровне, которые могут образовать связи с другими атомами.
2) Запишите электронные схемы атомов неметалла через знак «+» так, чтобы непарные электроны были обращены к соседнему знаку:
Теперь нарисуем электронные схемы для двух атомов азота. Каждый атом имеет 5 электронов на внешнем уровне, из которых 3 непарных.
Точки представляют электроны на внешнем уровне, а непарные электроны будут направлены друг к другу.
Запишем это как два атома азота, где непарные электроны (по три с каждой стороны) будут направлены к соседнему атому.
(Поставьте символ «+» между двумя атомами для обозначения того, что электроны могут быть совместно использованы).
3) Поставьте стрелку и запишите электронную формулу молекулы, выделив обобществленные электронные пары:
Теперь, когда атомы азота делят свои непарные электроны, они образуют ковалентную связь.
Стрелка будет показывать, как атомы обмениваются электронами:
Теперь атомы обмениваются электронами, и образуют общие электронные пары.
В случае молекулы N₂ образуется тройная связь между атомами азота. Это означает, что каждый атом азота делит по 3 электрона (по одному электрону от каждого атома).
4) Запишите структурную формулу образовавшейся молекулы, обозначив каждую общую электронную пару черточкой:
Теперь нам нужно записать структурную формулу молекулы N₂.
Каждый из двух атомов азота делится тремя электронами с соседним атомом, образуя тройную ковалентную связь. Структурная формула будет выглядеть так:
Тройная связь между атомами азота обозначена тремя черточками (каждая черточка представляет пару общих электронов).
Таким образом, молекула N₂ образует тройную ковалентную связь между двумя атомами азота.
Вопрос 3
По числу общих электронных пар между атомами различают три типа химических связей: одинарная, двойная и тройная. Каждая из этих связей имеет свои особенности и примеры.
1) ОДИНАРНАЯ связь
Определение: Одинарная связь образуется, когда два атома обмениваются одной парой электронов. Это самая простая форма связи, которая обеспечивает стабильность молекулы.
Примеры:
- H-H (водород): Два атома водорода соединяются, образуя молекулу H₂, где каждый атом делится одним электроном.
- F-F (фтор): Два атома фтора образуют молекулу F₂ с одной общей парой электронов.
- Cl-Cl (хлор): В молекуле Cl₂ два атома хлора также соединяются одной парой электронов.
- Br-Br (бром): В молекуле Br₂ два атома брома образуют одинарную связь.
2) ДВОЙНАЯ связь
Определение: Двойная связь возникает, когда два атома обмениваются двумя парами электронов. Это делает связь более прочной и короткой по сравнению с одинарной.
Примеры:
- O=O (кислород): В молекуле O₂ два атома кислорода соединены двумя парами электронов, что обеспечивает ему высокую реакционную способность.
- H₂C=CH₂ (этилен): В молекуле этилена два углерода соединены двойной связью, что придает молекуле плоскостную структуру.
3) ТРОЙНАЯ связь
Определение: Тройная связь образуется, когда два атома обмениваются тремя парами электронов. Это самая сильная и короткая связь из трех типов, обеспечивая высокую прочность.
Примеры:
- N≡N (азот): В молекуле N₂ два атома азота соединены тройной связью, что делает ее очень стабильной и инертной.
- HC≡CH (ацетилен): В молекуле ацетилена два углерода соединены тройной связью, что придает молекуле линейную структуру.
Заключение
Таким образом, различие между одинарной, двойной и тройной связями основывается на количестве общих электронных пар между атомами. Это различие определяет не только прочность и длину связи, но и химические свойства соединений, в которых они присутствуют.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.


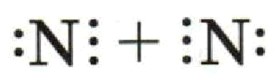
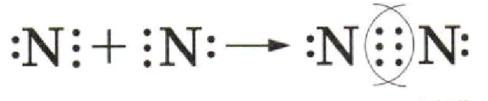



Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!