
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страница 47 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
2. Выберите формулы соединений с ковалентной полярной химической связью. Из букв, соответствующих правильным ответам, вы составите слово, означающее имитацию алмаза или другого драгоценного камня, выполненного из стекла:
1) HF ________ C
2) Al _________ X
3) FeBr₃ ______ T
4) Na₂O₂ _____ O
5) SO₂ _______ P
6) KCl _______ H
7) CO₂ _______ A
8) Ca ________ И
9) PCl₅ _______ 3
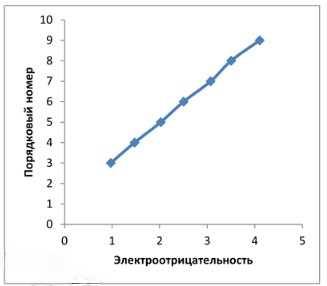
3. Постройте график зависимости порядкового номера химического элемента от электроотрицательности элементов одного периода. Точные значения электроотрицательности найдите с помощью Интернета.
Сделайте вывод.
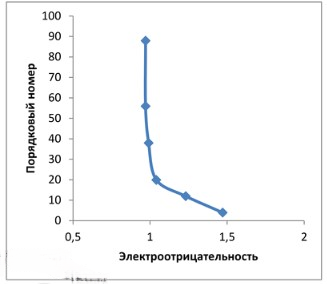
4. Постройте график зависимости порядкового номера химического элемента от электроотрицательности элементов одной главной подгруппы. Точные значения электроотрицательности найдите с помощью Интернета.
Сделайте вывод.
Вопрос 2
| 1. HF | Ковалентная полярная связь | C |
| 2. Al | Металлическая связь | X |
| 3. FeBr₃ | Ионная связь | T |
| 4. Na₂O₂ | Ионная связь | O |
| 5. SO₂ | Ковалентная полярная связь | P |
| 6. KCl | Ионная связь | H |
| 7. CO₂ | Ковалентная полярная связь | A |
| 8. Ca | Металлическая связь | И |
| 9. PCl₅ | Ковалентная полярная связь | 3 |
В условии имеется ошибка: если подразумевалось слово СТРАЗ, то букве Т соответствует соединение FeBr₃, обладающее ионной связью.
Вопрос 3
| Элемент | Порядковый номер | Электроотрицательность |
|---|---|---|
| Li | 3 | 0,97 |
| Be | 4 | 1,47 |
| B | 5 | 2,02 |
| C | 6 | 2,5 |
| N | 7 | 3,07 |
| O | 8 | 3,5 |
| F | 9 | 4,1 |
Вывод: в периодах электроотрицательность возрастает с увеличением порядкового номера элемента.
Вопрос 4
| Элемент | Порядковый номер | Электроотрицательность |
|---|---|---|
| Be | 4 | 1,47 |
| Mg | 12 | 1,23 |
| Ca | 20 | 1,04 |
| Sr | 38 | 0,99 |
| Ba | 56 | 0,97 |
| Ra | 88 | 0,97 |
Вывод: в главных подгруппах электроотрицательность элементов снижается с увеличением порядкового номера.
Вопрос 2
Для определения типа химической связи необходимо учитывать следующие критерии:
1. Ковалентная полярная связь: Образуется между атомами разных неметаллов с небольшой, но заметной разницей в электроотрицательности (обычно от 0,4 до 1,7-1,9 по Полингу). Электронная пара смещается к более электроотрицательному атому.
2. Ковалентная неполярная связь: Образуется между атомами одного и того же неметалла (например, O₂, N₂, Cl₂). Разница в электроотрицательности равна нулю.
3. Ионная связь: Образуется между металлом и неметаллом (или между катионом металла и анионом кислотного остатка). Разница в электроотрицательности большая (обычно более 1,7-1,9). Происходит полный переход электронов от металла к неметаллу, образуются ионы.
4. Металлическая связь: Образуется между атомами металлов в металлической решетке за счет обобществленных электронов.
Рассмотрим каждое соединение из списка:
1. HF (фтороводород)
— Элементы: H (неметалл) и F (неметалл).
— Электроотрицательность (ЭО): H ≈ 2.20, F ≈ 3.98. Разница = 3.98 — 2.20 = 1.78.
— Вывод: Это соединение образовано двумя разными неметаллами с большой разницей в ЭО, что указывает на ковалентную полярную связь.
— Соответствует букве: C
2. Al (алюминий)
— Элементы: Чистый металл.
— Вывод: В чистом металле присутствует металлическая связь.
— Соответствует букве: X
3. FeBr₃ (бромид железа(III))
— Элементы: Fe (металл) и Br (неметалл).
— Вывод: Соединение металла и неметалла образует ионную связь.
— Соответствует букве: T
4. Na₂O₂ (пероксид натрия)
— Элементы: Na (металл) и O (неметалл).
— Вывод: Соединение металла и неметалла образует ионную связь. (Внутри пероксид-иона O₂²⁻ есть ковалентная неполярная связь O-O, но связь между Na⁺ и O₂²⁻ является ионной, которая определяет класс соединения).
— Соответствует букве: O
5. SO₂ (оксид серы(IV))
— Элементы: S (неметалл) и O (неметалл).
— Электроотрицательность (ЭО): S ≈ 2.58, O ≈ 3.44. Разница = 3.44 — 2.58 = 0.86.
— Вывод: Это соединение образовано двумя разными неметаллами с заметной разницей в ЭО, что указывает на ковалентную полярную связь.
— Соответствует букве: P
6. KCl (хлорид калия)
— Элементы: K (металл) и Cl (неметалл).
— Вывод: Соединение металла и неметалла образует ионную связь.
— Соответствует букве: H
7. CO₂ (углекислый газ)
— Элементы: C (неметалл) и O (неметалл).
— Электроотрицательность (ЭО): C ≈ 2.55, O ≈ 3.44. Разница = 3.44 — 2.55 = 0.89.
— Вывод: Это соединение образовано двумя разными неметаллами с заметной разницей в ЭО, что указывает на ковалентную полярную связь.
— Соответствует букве: A
8. Ca (кальций)
— Элементы: Чистый металл.
— Вывод: В чистом металле присутствует металлическая связь.
— Соответствует букве: И
9. PCl₅ (пентахлорид фосфора)
— Элементы: P (неметалл) и Cl (неметалл).
— Электроотрицательность (ЭО): P ≈ 2.19, Cl ≈ 3.16. Разница = 3.16 — 2.19 = 0.97.
— Вывод: Это соединение образовано двумя разными неметаллами с заметной разницей в ЭО, что указывает на ковалентную полярную связь.
— Соответствует букве: З
Суммируем правильные ответы (соединения с ковалентной полярной связью):
— HF (C)
— SO₂ (P)
— CO₂ (A)
— PCl₅ (З)
Составляем слово:
Из букв C, P, A, З можно составить слово СТРАЗ.
Вывод по ошибке в условии:
Если целью было получить слово «СТРАЗ», то буква «Т» должна была соответствовать соединению с ковалентной полярной связью. Однако, FeBr₃ (соответствующее букве Т) является соединением с ионной связью, поскольку образовано металлом (Fe) и неметаллом (Br). Это означает, что в условии задачи есть ошибка, так как FeBr₃ не подходит под критерий ковалентной полярной связи.
Таким образом, для получения слова «СТРАЗ» в данном задании есть несоответствие в пункте 3.
Вопрос 3
Для изучения зависимости электроотрицательности химических элементов от их порядкового номера в пределах одного периода, необходимо собрать соответствующие эмпирические данные. В качестве примера рассмотрим элементы второго периода периодической системы:
1. Сбор и представление данных:
Данные для элементов второго периода (по шкале Полинга):
| Элемент | Порядковый номер | Электроотрицательность |
|---|---|---|
| Li | 3 | 0,97 |
| Be | 4 | 1,47 |
| B | 5 | 2,02 |
| C | 6 | 2,5 |
| N | 7 | 3,07 |
| O | 8 | 3,5 |
| F | 9 | 4,1 |
2. Инструкции по построению графика:
Для визуализации данной зависимости следует выполнить следующие шаги:
— Оси координат: Начертите декартову систему координат. Горизонтальная ось (ось абсцисс, X) должна быть отведена для значений Электроотрицательности. Вертикальная ось (ось ординат, Y) должна представлять Порядковый номер.
— Масштабирование осей:
- Для оси X (Электроотрицательность) выберите масштаб, охватывающий диапазон значений от 0 до 5, с равномерными делениями.
- Для оси Y (Порядковый номер) выберите масштаб, охватывающий диапазон от 0 до 10, с делениями, соответствующими целым порядковым номерам.
— Нанесение точек: Для каждого элемента из таблицы нанесите соответствующую точку на график, используя его электроотрицательность как координату X и порядковый номер как координату Y.
- Li: (0.97, 3)
- Be: (1.47, 4)
- B: (2.02, 5)
- C: (2.5, 6)
- N: (3.07, 7)
- O: (3.5, 8)
- F: (4.1, 9)
— Соединение точек: Соедините нанесенные точки последовательно, что позволит наглядно отобразить характер зависимости.
3. Анализ графика и теоретическое обоснование:
Построенный график демонстрирует четкую тенденцию: по мере увеличения порядкового номера химического элемента в пределах одного периода, его электроотрицательность возрастает.
Данная закономерность объясняется фундаментальными изменениями в строении атома при движении по периоду слева направо:
— Увеличение заряда ядра: Порядковый номер элемента соответствует числу протонов в ядре. Следовательно, при переходе от одного элемента к следующему в периоде, положительный заряд ядра увеличивается на единицу.
— Постоянное число электронных слоев: Все элементы одного периода имеют одинаковое количество главных энергетических уровней (электронных слоев), на которых располагаются электроны. Например, у всех элементов второго периода валентные электроны находятся на втором энергетическом уровне.
— Возрастание эффективного заряда ядра: Несмотря на увеличение числа электронов, которые также добавляются при движении по периоду, экранирование валентных электронов внутренними слоями остается относительно постоянным. Это приводит к увеличению эффективного положительного заряда ядра, действующего на валентные электроны.
— Уменьшение атомного радиуса: Усиление притяжения валентных электронов к ядру (из-за возросшего эффективного заряда ядра) приводит к «сжатию» электронных оболочек и, как следствие, к уменьшению атомного радиуса при движении по периоду.
— Увеличение электроотрицательности: Электроотрицательность определяется как мера способности атома притягивать электроны в химической связи. Уменьшение атомного радиуса и усиление притяжения валентных электронов к ядру делают атом более эффективным в притяжении электронов от других атомов. Таким образом, способность атома притягивать электроны (электроотрицательность) возрастает.
Графическое представление наглядно подтверждает эту периодическую закономерность, отражающую взаимосвязь между строением атома и его химическими свойствами.
Вопрос 4
Для выполнения поставленной задачи по построению и анализу зависимости порядкового номера химического элемента от его электроотрицательности в пределах одной главной подгруппы, необходимо последовательно выполнить несколько шагов.
1. Сбор и представление данных
Первым шагом является определение элементов, принадлежащих к одной главной подгруппе, и сбор их соответствующих значений порядкового номера и электроотрицательности. В данном случае, для примера, мы сосредоточимся на элементах второй главной подгруппы (щелочноземельные металлы): бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Для получения точных значений электроотрицательности (по шкале Полинга) и порядковых номеров, производится поиск в надежных химических базах данных или справочниках. После сбора данных, формируется следующая таблица:
| Элемент | Порядковый номер | Электроотрицательность |
|---|---|---|
| Be | 4 | 1,47 |
| Mg | 12 | 1,23 |
| Ca | 20 | 1,04 |
| Sr | 38 | 0,99 |
| Ba | 56 | 0,97 |
| Ra | 88 | 0,97 |
2. Инструкции по построению графика
Для наглядной демонстрации зависимости порядкового номера от электроотрицательности, следует построить график.
— Оси координат: Начертите декартову систему координат.
- Горизонтальная ось (ось абсцисс, X): Отведите для значений Электроотрицательности (ЭО).
- Вертикальная ось (ось ординат, Y): Отведите для значений Порядкового номера (Z).
— Масштабирование осей:
- Для оси X (Электроотрицательность) выберите масштаб, охватывающий диапазон значений от примерно 0,5 до 2, с равномерными делениями.
- Для оси Y (Порядковый номер) выберите масштаб, охватывающий диапазон от 0 до 100, обеспечивая адекватное отображение всех значений порядковых номеров.
— Нанесение точек: Для каждого элемента из таблицы нанесите соответствующую точку на график. Координаты каждой точки будут (ЭО, Z):
- Be: (1,47; 4)
- Mg: (1,23; 12)
- Ca: (1,04; 20)
- Sr: (0,99; 38)
- Ba: (0,97; 56)
- Ra: (0,97; 88)
— Соединение точек: Соедините нанесенные точки последовательно, чтобы визуализировать характер зависимости.
3. Анализ графика и теоретическое обоснование
Построенный график продемонстрирует следующую закономерность: при увеличении порядкового номера химического элемента в пределах одной главной подгруппы (то есть при движении сверху вниз по группе), его электроотрицательность, как правило, уменьшается.
Данная тенденция обусловлена изменениями в строении атомов по мере увеличения порядкового номера в группе:
— Увеличение числа электронных слоев: При переходе от одного элемента к другому в пределах одной группы, каждый последующий элемент имеет на один электронный слой больше. Это означает, что валентные электроны располагаются на все более удаленных от ядра энергетических уровнях.
— Увеличение атомного радиуса: Добавление новых электронных слоев приводит к значительному увеличению размера атома (атомного радиуса). Валентные электроны оказываются все дальше от ядра.
— Экранирование заряда ядра: Внутренние электронные слои эффективно экранируют (защищают) валентные электроны от полного притяжения положительно заряженного ядра. Хотя заряд ядра увеличивается с ростом порядкового номера, эффект экранирования растет еще быстрее, или, по крайней мере, компенсирует увеличение заряда ядра в части притяжения к валентным электронам.
— Уменьшение эффективного заряда ядра: В результате увеличения расстояния до ядра и усиления экранирования, эффективный положительный заряд ядра, действующий на валентные электроны, уменьшается. Это означает, что валентные электроны удерживаются ядром менее прочно.
— Снижение электроотрицательности: Электроотрицательность отражает способность атома притягивать электроны в химической связи. Поскольку валентные электроны удерживаются менее прочно, а атомный радиус увеличивается, способность атома притягивать чужие электроны также ослабевает. Следовательно, электроотрицательность уменьшается.
Вывод
На основе анализа данных и построенного графика можно сделать вывод, что в пределах одной главной подгруппы периодической системы химических элементов, с увеличением порядкового номера (то есть при движении сверху вниз по группе), электроотрицательность элементов закономерно уменьшается. Это объясняется увеличением атомного радиуса и усилением экранирования валентных электронов внутренними электронными слоями, что приводит к ослаблению притяжения валентных электронов к ядру и, как следствие, к снижению способности атома притягивать электроны в химической связи.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!