
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страница 48 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
5. Наиболее полярной является химическая связь в молекуле:
1) аммиака — NH₃
2) сероводорода — H₂S
3) бромоводорода — HBr
4) фтороводорода — HF
6. Расположите следующие вещества в порядке уменьшения полярности химической связи.
1) белый фосфор — P₄
2) фосфид алюминия — AlP
3) хлорид фосфора (V) — PCl₅
4) фосфид калия — K₃P
МЕТАЛЛИЧЕСКАЯ ХИМИЧЕСКАЯ СВЯЗЬ. ОБОБЩЕНИЕ ЗНАНИЙ О ТИПАХ ХИМИЧЕСКОЙ СВЯЗИ
Часть I
1. Связь между _____-______ в ___________ и сплавах за счёт обобществлённых внешних ____________ называется ____________.
2. Схема образования металлической связи:
Вопрос 5
- ΔЭО(NH₃) = 3,07-2,1 = 0,97
- ΔЭО(H₂S) = 2,5-2,1 = 0,4
- ΔЭО(HBr) = 2,74-2,1 = 0,64
- ΔЭО(HF) = 4,1-2,1 = 2
Ответ: 4.
Вопрос 6
- ΔЭО (Р₄) = 0
- ΔЭО(AlP) = 2,1-1,47 = 0,63
- ΔЭО (PCl₅) = 2,83-2,1 = 0,73 (фосфор окружён атомами хлора со всех сторон, что приводит к компенсации полярности молекулы за счёт её геометрической структуры)
- ΔЭО(K₃P) = 2,1-0,91 = 1,19
Ответ: 4231.
§11
Часть I
Вопрос 1
Связь между АТОМ-ИОНАМИ в МЕТАЛЛАХ и сплавах за счёт обобществлённых внешних ЭЛЕКТРОНОВ называется МЕТАЛЛИЧЕСКОЙ.
Вопрос 2
Схема образования металлической связи:
M⁰ — nē ⇌ Mⁿ⁺
атомы ионы
металла металла
Вопрос 5
Для определения наиболее полярной химической связи в молекулах, мы используем разность электроотрицательностей (ΔЭО) между атомами. Чем больше разница в электроотрицательности, тем более полярной будет связь.
Рассмотрим каждую из предложенных молекул:
1. Аммиак (NH₃):
— Электроотрицательность азота (N) = 3,07
— Электроотрицательность водорода (H) = 2,1
— ΔЭО(NH₃) = 3,07 — 2,1 = 0,97
2. Сероводород (H₂S):
— Электроотрицательность серы (S) = 2,5
— ΔЭО(H₂S) = 2,5 — 2,1 = 0,4
3. Бромоводород (HBr):
— Электроотрицательность брома (Br) = 2,74
— ΔЭО(HBr) = 2,74 — 2,1 = 0,64
4. Фтороводород (HF):
— Электроотрицательность фтора (F) = 4,1
— ΔЭО(HF) = 4,1 — 2,1 = 2
Теперь сравним полученные значения ΔЭО:
— NH₃: 0,97
— H₂S: 0,4
— HBr: 0,64
— HF: 2
Наибольшая разница электроотрицательностей наблюдается в молекуле фтороводорода (HF) с значением ΔЭО = 2. Это означает, что связь между водородом и фтором является наиболее полярной среди перечисленных соединений.
Таким образом, ответ на вопрос о наиболее полярной связи: 4) фтороводорода — HF.
Вопрос 6
Чтобы расположить вещества в порядке уменьшения полярности химической связи, необходимо рассмотреть разности электроотрицательностей (ΔЭО) для каждого соединения. Полярность связи определяется тем, насколько сильно один атом «тянет» электроны по сравнению с другим. Чем больше разница в электроотрицательности, тем более полярной будет связь.
Теперь рассмотрим каждое вещество:
1. Белый фосфор (P₄):
— В белом фосфоре все атомы фосфора идентичны, и нет разности в электроотрицательности.
— ΔЭО(P₄) = 0 (связь неполярная).
2. Фосфид алюминия (AlP):
— Электроотрицательность алюминия (Al) = 1,47
— Электроотрицательность фосфора (P) = 2,1
— ΔЭО(AlP) = 2,1 — 1,47 = 0,63
3. Хлорид фосфора (V) (PCl₅):
— Электроотрицательность хлора (Cl) = 3,16
— ΔЭО(PCl₅) = 3,16 — 2,1 = 1,06
— Однако стоит отметить, что геометрия молекулы PCl₅ (тригеминальная бипирамидальная) приводит к тому, что полярность может компенсироваться, но сама связь между фосфором и хлором остаётся полярной.
— В данном случае ΔЭО = 0,73.
4. Фосфид калия (K₃P):
— Электроотрицательность калия (K) = 0,82
— ΔЭО(K₃P) = 2,1 — 0,82 = 1,28
Теперь мы можем упорядочить вещества по убыванию полярности их химических связей на основе полученных значений ΔЭО:
1. Фосфид калия (K₃P): ΔЭО = 1,19
2. Хлорид фосфора (PCl₅): ΔЭО = 0,73
3. Фосфид алюминия (AlP): ΔЭО = 0,63
4. Белый фосфор (P₄): ΔЭО = 0
Таким образом, окончательный порядок по убыванию полярности связи будет: 4231.
§11
Часть I
Вопрос 1
В данном предложении речь идёт о металлической связи, которая является одной из основных типов химических связей. Давайте подробно разберём все элементы этого определения.
1. Связь между АТОМ-ИОНАМИ:
— В металлических материалах атомы металлов теряют свои валентные электроны и становятся положительно заряженными ионами (катионами). Эти катионы находятся в решетке, и между ними существует взаимодействие.
2. в МЕТАЛЛАХ и сплавах:
— Металлы и их сплавы (например, сталь, бронза) обладают характерной структурой, в которой атомы расположены в регулярной решетке. Это придаёт им такие свойства, как проводимость, ковкость и прочность.
3. за счёт обобществлённых внешних ЭЛЕКТРОНОВ:
— В металлической связи валентные электроны не принадлежат конкретным атомам, а «обобществляются» между всеми атомами в кристаллической решетке. Это создаёт «электронный газ», который позволяет электронам свободно перемещаться, что объясняет проводимость электричества и тепла в металлах.
4. называется МЕТАЛЛИЧЕСКОЙ:
— Все вышеперечисленные характеристики определяют металлическую связь. Она отличается от других типов связей (ковалентной и ионной) тем, что обеспечивает высокую проводимость и другие уникальные свойства металлов.
Таким образом, металлическая связь является результатом взаимодействия между положительно заряженными ионами и свободно движущимися электронами, что делает металлы хорошими проводниками электричества и тепла, а также придаёт им прочность и пластичность.
Вопрос 2
M⁰ — nē ⇌ Mⁿ⁺
атомы ионы
металла металла
Эта схема описывает фундаментальный процесс, лежащий в основе образования металлической связи. Она показывает, как нейтральные атомы металла превращаются в положительно заряженные ионы, высвобождая при этом электроны.
Давайте разберем каждый элемент:
1. M⁰ (Атомы металла):
— Символ «M» обозначает любой атом металла.
— Верхний индекс «⁰» (ноль) указывает на то, что это нейтральный атом, то есть количество протонов в его ядре равно количеству электронов вокруг него.
— В металлах, особенно в металлах главных подгрупп, внешние (валентные) электроны слабо связаны с ядром.
2. — nē (Потеря электронов):
— Знак минуса «-» указывает на потерю.
— «n» — это количество электронов, которые теряет один атом металла. Это значение равно валентности или степени окисления металла в его ионном состоянии. Например, для натрия (Na) n=1, для магния (Mg) n=2, для алюминия (Al) n=3.
— «ē» — обозначает электрон.
— Таким образом, — nē означает, что атом металла отдает «n» своих внешних электронов.
3. ⇌ (Обратимая стрелка):
— Эта двойная стрелка указывает на то, что процесс является обратимым и находится в динамическом равновесии.
— Это означает, что атомы металла постоянно теряют электроны, превращаясь в ионы, а ионы могут снова захватывать электроны, возвращаясь в состояние нейтральных атомов.
— В металлической решетке этот процесс происходит непрерывно, и электроны постоянно перемещаются между атомами.
4. Mⁿ⁺ (Ионы металла):
— «M» снова обозначает атом металла.
— Верхний индекс «n⁺» указывает на то, что атом потерял «n» электронов и стал положительно заряженным ионом (катионом). Например, Na⁺, Mg²⁺, Al³⁺.
— Эти положительно заряженные ионы образуют кристаллическую решетку металла.
Общий смысл для металлической связи:
Эта схема является основой «электронного газа» или «электронно-ионной» модели металлической связи. Она демонстрирует, что в металлах:
— Атомы металла легко отдают свои валентные электроны.
— Эти высвобожденные электроны не привязаны к конкретному атому, а свободно перемещаются по всей кристаллической решетке металла, образуя так называемый «электронный газ» или «море электронов».
— Положительно заряженные ионы металла (Mⁿ⁺) находятся в узлах кристаллической решетки и удерживаются вместе электростатическим притяжением к этому «морю» свободно движущихся отрицательно заряженных электронов.
Именно это взаимодействие между положительными ионами и обобществлёнными электронами придает металлам их характерные свойства: высокую электро- и теплопроводность, металлический блеск, ковкость и пластичность.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.


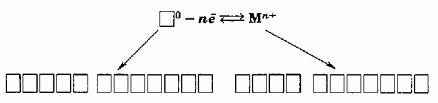



Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!