
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страница 62 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
2. Моль — это также количество вещества, в котором содержится 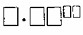
3. Чтобы отмерить вещество количеством в 1 моль, нужно взять столько граммов этого вещества, какова его 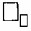
4. Масса 1 моль вещества называется □ □ □ □ □ □ □ □ массой — □. Она измеряется в □ / □ □ □ □ и численно равна 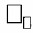
5. Количество вещества — это величина, равная отношению массы вещества к его □ □ □ □ □ □ □ □ □ □ □ □ □ :
□ = □ / □ => m = □ · □.
6. Число частиц вещества равно произведению числа Авогадро на количество вещества: N = 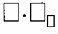
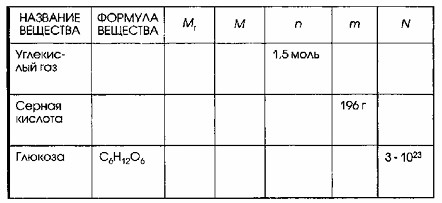
7. Дополните таблицу, делая необходимые вычисления.
Вопрос 2
Моль — это также количество вещества, в котором содержится 6•10²³ молекул или частиц вещества. Это число называется числом Авогадро и обозначается Nᴬ.
Вопрос 3
Чтобы отмерить вещество количеством в 1 моль, нужно взять столько граммов этого вещества, какова его Mᵣ или Aᵣ.
Вопрос 4
Масса 1 моль вещества называется МОЛЯРНОЙ массой — M. Она измеряется в г/моль и численно равна Mᵣ вещества.
Вопрос 5
Количество вещества — это величина, равная отношению массы вещества к его МОЛЯРНОЙ МАССЕ:
n = m/M → m = n·M
Вопрос 6
Число частиц вещества равно произведению числа Авогадро на количество вещества:
N = n·Nᴬ → n = N/Nᴬ
Вопрос 7
Вопрос 2
Моль — это также количество вещества, в котором содержится 6•10²³ молекул или частиц вещества. Это число называется числом Авогадро и обозначается Nᴬ.
1. Что означает «6•10²³»?
— Это число является фундаментальной физической константой, известной как число Авогадро (или постоянная Авогадро).
— Оно определяет точное количество структурных единиц (таких как атомы, молекулы, ионы, электроны и т.д.), содержащихся в одном моле любого вещества.
— Значение 6.02214076 × 10²³ моль⁻¹ было точно определено Международной системой единиц (СИ) в 2019 году и является одним из семи определяющих констант СИ. Для большинства расчетов часто используется округленное значение 6•10²³.
— Эта константа служит мостом между микроскопическим миром атомов и молекул (которые слишком малы, чтобы их можно было измерить по отдельности) и макроскопическим миром, который мы можем измерять (например, в граммах).
— Например, 1 моль воды (H₂O) содержит 6.022 × 10²³ молекул воды и имеет массу примерно 18 граммов (что численно равно ее относительной молекулярной массе).
2. Почему это число называется «числом Авогадро»?
— Это число названо в честь итальянского учёного Амедео Авогадро (1776–1856).
— Хотя сам Авогадро не рассчитывал это число, он сформулировал важный закон (закон Авогадро), который гласит, что равные объемы любых газов при одинаковых условиях температуры и давления содержат одинаковое число молекул.
— Работы Авогадро заложили теоретическую основу для понимания количества частиц в веществе и концепции моля. Позднее, уже после его смерти, другие учёные (например, Йозеф Лошмидт и Жан Перрен) экспериментально определили это число, и оно было названо в честь Авогадро в знак признания его фундаментального вклада в развитие молекулярной теории.
3. Что означает обозначение «Nᴬ»?
— N в данном обозначении происходит от английского слова «Number» (число) и используется для обозначения количества частиц.
— Верхний индекс ᴬ (или иногда L, в честь Йозефа Лошмидта, который одним из первых оценил это число) указывает на то, что это число Авогадро.
— Это стандартное обозначение для данной константы в химии и физике, обеспечивающее однозначность и универсальность в научных текстах и расчетах.
Таким образом, определение моля как количества вещества, содержащего 6•10²³ частиц, является центральным для понимания стехиометрии, количественных отношений в химических реакциях и перехода от атомно-молекулярного уровня к измеряемым массам веществ.
Вопрос 3
Чтобы отмерить вещество количеством в 1 моль, нужно взять столько граммов этого вещества, какова его Mᵣ или Aᵣ.
1. Что такое Mᵣ?
— Mᵣ (читается как «эм-эр») — это относительная молекулярная масса вещества.
— Она показывает, во сколько раз масса одной молекулы данного вещества больше 1/12 массы атома углерода-12 (стандарт, используемый для определения относительных атомных и молекулярных масс).
— Mᵣ рассчитывается как сумма относительных атомных масс всех атомов, входящих в состав молекулы.
— Пример: Для воды (H₂O): Aᵣ(H) ≈ 1, Aᵣ(O) ≈ 16. Тогда Mᵣ(H₂O) = 2 — Aᵣ(H) + Aᵣ(O) = 2 — 1 + 16 = 18.
— Mᵣ — это безразмерная величина (у неё нет единиц измерения).
2. Что такое Aᵣ?
— Aᵣ (читается как «а-эр») — это относительная атомная масса элемента.
— Она показывает, во сколько раз средняя масса атома данного элемента больше 1/12 массы атома углерода-12.
— Значения Aᵣ для всех элементов можно найти в Периодической системе химических элементов (таблице Менделеева).
— Пример: Aᵣ(C) ≈ 12 (для углерода), Aᵣ(Na) ≈ 23 (для натрия).
— Aᵣ — это также безразмерная величина.
3. Как Mᵣ и Aᵣ связаны с массой в граммах для 1 моля?
— Концепция молярной массы (M) является ключевой здесь. Молярная масса — это масса одного моля вещества.
— Численно молярная масса (M) в граммах на моль (г/моль) равна относительной молекулярной массе (Mᵣ) или относительной атомной массе (Aᵣ).
— То есть:
- Если вещество состоит из молекул (например, H₂O, CO₂, C₆H₁₂O₆), то его молярная масса (M) численно равна его относительной молекулярной массе (Mᵣ).Пример: Mᵣ(H₂O) = 18. Значит, 1 моль H₂O имеет массу 18 граммов (M(H₂O) = 18 г/моль).
- Если вещество является простым веществом, состоящим из атомов (например, Fe, Na, C), или ионным соединением, где мы рассматриваем формульную единицу, то его молярная масса (M) численно равна его относительной атомной массе (для элементов) или относительной формульной массе (для ионных соединений, которая рассчитывается аналогично Mᵣ).Пример: Aᵣ(Fe) ≈ 56. Значит, 1 моль железа (Fe) имеет массу 56 граммов (M(Fe) = 56 г/моль).Пример: Для NaCl (хлорид натрия): Aᵣ(Na) ≈ 23, Aᵣ(Cl) ≈ 35.5. Относительная формульная масса NaCl = 23 + 35.5 = 58.5. Значит, 1 моль NaCl имеет массу 58.5 граммов (M(NaCl) = 58.5 г/моль).
Таким образом, чтобы отмерить 1 моль вещества, вы просто берете его относительную молекулярную (или атомную/формульную) массу и выражаете её в граммах. Это и будет масса 1 моля данного вещества.
Вопрос 4
Масса 1 моль вещества называется МОЛЯРНОЙ массой — M. Она измеряется в г/моль и численно равна Mᵣ вещества.
1. Что такое «Молярная масса»?
— Определение: Молярная масса (обозначается символом M) — это масса одного моля любого вещества.
— Значение: Это фундаментальная физико-химическая величина, которая связывает макроскопические свойства вещества (массу, которую можно измерить) с микроскопическими (количеством атомов или молекул). Молярная масса является «мостом» между количеством вещества (в молях) и его массой (в граммах или килограммах).
— Применение: Молярная масса необходима для большинства количественных расчетов в химии:
- Для перевода массы вещества в количество вещества (моли) и наоборот.
- Для стехиометрических расчетов в химических реакциях (например, сколько граммов одного вещества потребуется для реакции с определенным количеством другого).
- Для приготовления растворов с заданной концентрацией.
2. Почему обозначается «M»?
— Стандартное обозначение: Символ «M» является общепринятым международным обозначением для молярной массы. Это часть системы СИ (Международная система единиц).
— Отличие от Mᵣ: Важно не путать молярную массу (M) с относительной молекулярной массой (Mᵣ). Хотя они численно равны (как будет объяснено ниже), M имеет единицу измерения (г/моль), а Mᵣ — безразмерная величина.
3. Почему измеряется в «г/моль»?
— Логика единицы: Единица измерения «грамм на моль» (г/моль) напрямую вытекает из определения молярной массы: это масса (в граммах) деленная на количество вещества (в молях).
— Практичность: Граммы являются удобной и широко используемой единицей массы в химических лабораториях для измерения веществ, а моль — стандартной единицей количества вещества. Таким образом, г/моль является практичной и интуитивно понятной единицей для химических расчетов.
4. Почему «численно равна Mᵣ вещества»?
— Определение моля: Моль был определён таким образом, чтобы масса одного моля вещества в граммах численно совпадала с его относительной молекулярной массой (Mᵣ) или относительной атомной массой (Aᵣ).
— Пример для молекул:
- Относительная молекулярная масса воды (H₂O), Mᵣ(H₂O) = 18. Это означает, что одна молекула воды в 18 раз тяжелее 1/12 массы атома углерода-12.
- Следовательно, молярная масса воды, M(H₂O) = 18 г/моль. Это означает, что 1 моль (т.е. 6.022 × 10²³ молекул) воды весит 18 граммов.
— Пример для атомов (простых веществ):
- Относительная атомная масса железа (Fe), Aᵣ(Fe) ≈ 55.85.
- Следовательно, молярная масса железа, M(Fe) ≈ 55.85 г/моль. Это означает, что 1 моль (т.е. 6.022 × 10²³ атомов) железа весит примерно 55.85 граммов.
— Пример для ионных соединений:
- Для хлорида натрия (NaCl), относительная формульная масса (рассчитывается как сумма относительных атомных масс ионов) = Aᵣ(Na) + Aᵣ(Cl) ≈ 23 + 35.5 = 58.5.
- Следовательно, молярная масса NaCl, M(NaCl) = 58.5 г/моль. Это означает, что 1 моль NaCl (т.е. 6.022 × 10²³ формульных единиц NaCl) весит 58.5 граммов.
Таким образом, молярная масса является центральным понятием, позволяющим легко переходить от относительных (безразмерных) масс атомов и молекул к измеряемым массам веществ в лаборатории.
Вопрос 5
Количество вещества — это величина, равная отношению массы вещества к его МОЛЯРНОЙ МАССЕ:
n = m/M → m = n·M
1. Что такое «Количество вещества» (n)?
— Определение: Количество вещества (обозначается символом n) — это физическая величина, которая характеризует число структурных единиц (атомов, молекул, ионов, электронов или любых других частиц) в данной порции вещества.
— Единица измерения: Основной единицей измерения количества вещества в Международной системе единиц (СИ) является моль (mol).
— Значение моля: Один моль любого вещества содержит число Авогадро (Nₐ ≈ 6.022 × 10²³) структурных единиц. Моль является «мостиком» между микромиром (отдельными атомами и молекулами) и макромиром (измеряемыми массами веществ).
— Важность: Эта величина критически важна для стехиометрических расчетов в химических реакциях, поскольку химические уравнения описывают соотношения между веществами именно в молях.
2. Что такое «Масса вещества» (m)?
— Определение: Масса вещества (обозначается символом m) — это мера инертности тела, которая показывает, сколько вещества содержится в данном объекте.
— Единица измерения: В химических расчетах чаще всего используется грамм (г) или килограмм (кг). Масса — это то, что мы можем непосредственно измерить на весах в лаборатории.
3. Что такое «Молярная масса» (M)?
— Определение: Молярная масса (обозначается символом M) — это масса одного моля вещества. Мы уже подробно рассматривали это понятие в предыдущем вопросе.
— Единица измерения: грамм на моль (г/моль).
— Роль: Молярная масса выступает в роли коэффициента пересчета, связывающего массу вещества (в граммах) с его количеством (в молях).
4. Формула: n = m/M (Количество вещества = Масса вещества / Молярная масса)
— Логика формулы: Эта формула логически вытекает из определений. Если молярная масса (M) показывает, сколько граммов содержится в одном моле, то для того чтобы узнать, сколько молей (n) содержится в определенной массе (m), нужно разделить общую массу на массу одного моля.
— Пример с единицами:
- n (моль) = m (г) / M (г/моль)
- Как видно, граммы (г) сокращаются, и остается моль (моль), что соответствует единице измерения количества вещества.
— Пример использования:
- Допустим, у нас есть 36 граммов воды (H₂O).
- Молярная масса воды M(H₂O) = 18 г/моль (поскольку Mᵣ(H₂O) = 18).
- Количество вещества воды n(H₂O) = m / M = 36 г / 18 г/моль = 2 моль.
- Это означает, что в 36 граммах воды содержится 2 моля молекул воды, или 2 × (6.022 × 10²³) молекул.
5. Перегруппированная формула: m = n·M (Масса вещества = Количество вещества · Молярная масса)
— Логика формулы: Эта формула является прямым следствием первой и используется, когда известно количество вещества (в молях), и нужно найти его массу (в граммах).
— Пример использования:
- Допустим, нам нужно узнать массу 0.5 моль хлорида натрия (NaCl).
- Молярная масса NaCl M(NaCl) = 58.5 г/моль (поскольку Mᵣ(NaCl) ≈ 58.5).
- Масса NaCl m(NaCl) = n · M = 0.5 моль · 58.5 г/моль = 29.25 г.
- Это означает, что 0.5 моль хлорида натрия весит 29.25 граммов.
Общий вывод:
Эти две формулы (n = m/M и m = n·M) являются краеугольными камнями количественной химии. Они позволяют химикам переводить между массой (легко измеряемой величиной) и количеством вещества (фундаментальной величиной для понимания химических реакций), что необходимо для проведения экспериментов, расчета выходов реакций, приготовления растворов и многих других задач.
Вопрос 6
Число частиц вещества равно произведению числа Авогадро на количество вещества:
N = n·Nᴬ → n = N/Nᴬ
1. Что такое «Число частиц» (N)?
— Определение: Число частиц (обозначается символом N) — это просто количество отдельных структурных единиц (атомов, молекул, ионов, электронов и т.д.) в данной порции вещества.
— Единица измерения: Эта величина безразмерна, так как выражает просто подсчет объектов. Однако иногда указывают «частиц», «атомов», «молекул» для ясности.
— Важность: Хотя мы не можем напрямую считать отдельные атомы или молекулы в повседневной жизни, эта величина является ключевой для понимания состава вещества на атомно-молекулярном уровне.
2. Что такое «Число Авогадро» (Nᴬ)?
— Определение: Число Авогадро (обозначается символом Nᴬ) — это фундаментальная физическая константа, которая определяет количество структурных единиц в одном моле любого вещества.
— Значение: Nᴬ ≈ 6.022 × 10²³ моль⁻¹. Это очень большое число, отражающее огромное количество атомов или молекул даже в небольших порциях вещества.
— Единица измерения: моль⁻¹ (обратный моль), что означает «на моль» или «частиц на моль».
— Роль: Число Авогадро является «переводным коэффициентом» между количеством вещества (в молях) и числом частиц. Оно играет ту же роль, что и число 12 для «дюжины» (1 дюжина = 12 штук).
3. Что такое «Количество вещества» (n)?
— Определение: Количество вещества (обозначается символом n) — это физическая величина, которая характеризует число структурных единиц в данной порции вещества, выраженное в молях.
— Единица измерения: моль (mol).
4. Формула: N = n·Nᴬ (Число частиц = Количество вещества · Число Авогадро)
— Логика формулы: Эта формула логически вытекает из определения моля и числа Авогадро. Если один моль содержит Nᴬ частиц, то n молей будут содержать n раз больше частиц.
— Аналогия: Если 1 дюжина = 12 штук, то 3 дюжины = 3 × 12 = 36 штук. Здесь «дюжина» — это «моль», «12» — это «число Авогадро», а «штуки» — это «частицы».
— Пример с единицами:
- N (частиц) = n (моль) · Nᴬ (частиц/моль)
- Как видно, моли (моль) сокращаются, и остается «частиц», что соответствует единице измерения числа частиц.
— Пример использования:
- Допустим, у нас есть 0.5 моль углекислого газа (CO₂).
- Число молекул CO₂ N(CO₂) = n · Nᴬ = 0.5 моль · (6.022 × 10²³ моль⁻¹) = 3.011 × 10²³ молекул.
- Это означает, что в 0.5 моль CO₂ содержится 3.011 × 10²³ отдельных молекул CO₂.
5. Перегруппированная формула: n = N/Nᴬ (Количество вещества = Число частиц / Число Авогадро)
— Логика формулы: Эта формула является прямым следствием первой и используется, когда известно число частиц, и нужно найти соответствующее количество вещества в молях.
— Аналогия: Если у вас есть 36 штук, и вы знаете, что 1 дюжина = 12 штук, то количество дюжин = 36 / 12 = 3 дюжины.
— Пример использования:
- Допустим, в образце железа содержится 1.2044 × 10²⁴ атомов Fe.
- Количество вещества железа n(Fe) = N / Nᴬ = (1.2044 × 10²⁴ атомов) / (6.022 × 10²³ атомов/моль) = 2 моль.
- Это означает, что 1.2044 × 10²⁴ атомов железа составляют 2 моля железа.
Общий вывод:
Эти две формулы (N = n·Nᴬ и n = N/Nᴬ) являются ключевыми для понимания количественных соотношений в химии. Они позволяют химикам переходить между числом отдельных, невидимых частиц и измеряемым количеством вещества (в молях), что является основой для всех стехиометрических расчетов и понимания химических процессов на микроскопическом уровне.
Вопрос 7
Для заполнения таблицы используются следующие основные формулы и соотношения в химии:
— Молярная масса (M): Численно равна относительной молекулярной массе (Mr), но выражается в граммах на моль (г/моль).
— Масса вещества (m): Рассчитывается как произведение количества вещества (n) на его молярную массу (M). Формула:
m = n · M
— Количество вещества (n):
- Если известна масса: Рассчитывается как отношение массы вещества (m) к его молярной массе (M). Формула:
n = m / M - Если известно число частиц: Рассчитывается как отношение числа частиц (N) к числу Авогадро (Nᴬ). Формула:
n = N / Nᴬ
— Число частиц (N): Рассчитывается как произведение количества вещества (n) на число Авогадро (Nᴬ). Формула:
N = n · Nᴬ
— Число Авогадро (Nᴬ): Приблизительно равно 6,022 × 10²³ моль⁻¹. В данных расчетах используется округленное значение 6 × 10²³ моль⁻¹.
Применим эти правила для каждого вещества в таблице:
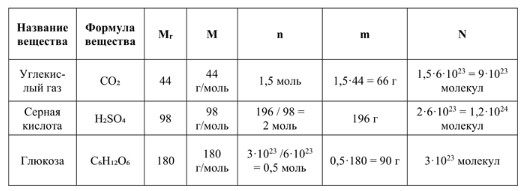
Углекислый газ (CO₂)
1. Название вещества: Углекислый газ
2. Формула вещества: CO₂
3. Mr (Относительная молекулярная масса): 44 (Это значение дано и соответствует сумме атомных масс: C=12, O=16; 12 + 2·16 = 44).
4. M (Молярная масса): 44 г/моль (Численно равна Mr).
5. n (Количество вещества): 1,5 моль (Это значение дано).
6. m (Масса):
— Расчет:
m = n · M
— m = 1,5 моль · 44 г/моль = 66 г
7. N (Число молекул):
— Расчет:
N = n · Nᴬ
— N = 1,5 моль · (6 · 10²³ молекул/моль) = 9 · 10²³ молекул
Серная кислота (H₂SO₄)
1. Название вещества: Серная кислота
2. Формула вещества: H₂SO₄
3. Mr (Относительная молекулярная масса): 98 (Это значение дано и соответствует сумме атомных масс: H=1, S=32, O=16; 2·1 + 32 + 4·16 = 2 + 32 + 64 = 98).
4. M (Молярная масса): 98 г/моль (Численно равна Mr).
5. m (Масса): 196 г (Это значение дано).
6. n (Количество вещества):
— Расчет:
n = m / M
— n = 196 г / 98 г/моль = 2 моль
7. N (Число молекул):
— Расчет:
N = n · Nᴬ
— N = 2 моль · (6 · 10²³ молекул/моль) = 1,2 · 10²⁴ молекул
Глюкоза (C₆H₁₂O₆)
1. Название вещества: Глюкоза
2. Формула вещества: C₆H₁₂O₆
3. Mr (Относительная молекулярная масса): 180 (Это значение дано и соответствует сумме атомных масс: C=12, H=1, O=16; 6·12 + 12·1 + 6·16 = 72 + 12 + 96 = 180).
4. M (Молярная масса): 180 г/моль (Численно равна Mr).
5. N (Число молекул): 3 · 10²³ молекул (Это значение дано).
6. n (Количество вещества):
— Расчет:
n = N / Nᴬ
— n = (3 · 10²³ молекул) / (6 · 10²³ молекул/моль) = 0,5 моль
7. m (Масса):
— Расчет:
m = n · M
— m = 0,5 моль · 180 г/моль = 90 г
Таким образом, все значения в таблице получены путем применения этих фундаментальных химических соотношений.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.


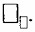

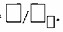



Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!