
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страница 65 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
8. Придумайте условие задачи, используя величины из задания 2.
Решите её любым способом.
МОЛЯРНЫЙ ОБЪЁМ ГАЗОВ
Часть I
1. 1 моль любого газа при ____ занимает одинаковый объём, равный ____, ____ л. Этот объём называется ____ и обозначается ____.
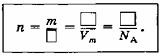
2. Количество вещества (n) — отношение объёма газа при н. у. к ____:
n = ____ / ____ → ____ измеряется в ____/____.
3. Следовательно, количество вещества
Вопрос 8
Найти, сколько молекул содержится в 360 г глюкозы.
Дано:
m(C₆H₁₂O₆) = 360 г
N_A = 6 • 10²³ молекул/моль
N(C₆H₁₂O₆) = ?
1 способ:
M(C₆H₁₂O₆) = 6 • 12 + 12 + 6 • 16 = 180 (г/моль)
n(C₆H₁₂O₆) = m/M = 360/180 = 2 (моль)
N(C₆H₁₂O₆) = n • \(N_A\) = 2 • 6 • 10²³ = 1,2 • 10²⁴ (молекул)
2 способ:
N(C₆H₁₂O₆) = m • \(N_A\) / M = 360 • 6 • 10²³ / 180 =
1,2 • 10²⁴ (молекул)
Ответ: 1,2 • 10²⁴ молекул.
§15
Часть I
Вопрос 1
1 моль любого газа при н.у. занимает одинаковый объем, равный 22,4 л. Этот объем называется МОЛЯРНЫМ и обозначается Vm.
Вопрос 2
Количество вещества (n) – отношение объема газа при н.у. к МОЛЯРНОМУ ОБЪЕМУ:
n = V/Vm → Vm измеряется в л/моль
Вопрос 3
Следовательно, количество вещества
n = m/M = V/Vm = N/NA
Вопрос 8
Данная задача требует найти количество молекул глюкозы (C₆H₁₂O₆) в заданной массе вещества. Для этого используются основные химические понятия: молярная масса, количество вещества и число Авогадро.
Условие задачи: Найти, сколько молекул содержится в 360 г глюкозы.
Дано:
— Масса глюкозы, m(C₆H₁₂O₆) = 360 г
— Число Авогадро, \(N_A\) = 6 • 10²³ молекул/моль (это константа, определяющая количество структурных единиц в одном моле любого вещества)
— Требуется найти количество молекул глюкозы, N(C₆H₁₂O₆) = ?
1 способ: Пошаговое решение
Этот способ разбивает решение на несколько логических шагов.
1. Определение молярной массы глюкозы (M):
— Что это: Молярная масса (M) – это масса одного моля вещества, выраженная в граммах на моль (г/моль). Она рассчитывается как сумма атомных масс всех элементов, входящих в состав молекулы, с учетом их количества.
— Расчет: Молекула глюкозы C₆H₁₂O₆ состоит из 6 атомов углерода (C), 12 атомов водорода (H) и 6 атомов кислорода (O).
Атомная масса углерода (C) ≈ 12 г/моль
Атомная масса водорода (H) ≈ 1 г/моль
Атомная масса кислорода (O) ≈ 16 г/моль
M(C₆H₁₂O₆) = (6 • 12) + (12 • 1) + (6 • 16) = 72 + 12 + 96 = 180 (г/моль)
— Смысл: Это означает, что 1 моль глюкозы весит 180 граммов.
2. Расчет количества вещества (молей) глюкозы (n):
— Что это: Количество вещества (n) – это мера количества материи, выраженная в молях. Она связывает массу вещества с его молярной массой.
— Формула: n = m/M, где m – заданная масса, M – молярная масса.
— Расчет: n(C₆H₁₂O₆) = 360 г / 180 г/моль = 2 (моль)
— Смысл: Это означает, что в 360 граммах глюкозы содержится 2 моля вещества.
3. Расчет количества молекул глюкозы (N):
— Что это: Количество молекул (N) – это фактическое число молекул в данном количестве вещества. Оно связано с количеством вещества (в молях) через число Авогадро.
— Формула: N = n • \(N_A\), где n – количество вещества в молях, \(N_A\) – число Авогадро.
— Расчет: N(C₆H₁₂O₆) = 2 моль • 6 • 10²³ молекул/моль = 1,2 • 10²⁴ (молекул)
— Смысл: Это означает, что в 360 граммах глюкозы содержится 1,2 • 10²⁴ молекул.
2 способ: Использование объединенной формулы
Этот способ является более быстрым, так как он объединяет все шаги в одну формулу.
— Вывод формулы: Мы знаем, что n = m/M и N = n • \(N_A\). Подставив первое выражение во второе, получаем:
N = (m/M) • \(N_A\)
или N = m • \(N_A\) / M
— Расчет:
N(C₆H₁₂O₆) = (360 г • 6 • 10²³ молекул/моль) / 180 г/моль
N(C₆H₁₂O₆) = 2160 • 10²³ / 180
N(C₆H₁₂O₆) = 12 • 10²³ = 1,2 • 10²⁴ (молекул)
-Примечание: 2160 / 180 = 12. Затем 12 * 10²³ можно записать в стандартной форме как 1.2 * 10²⁴.
Ответ: В 360 граммах глюкозы содержится 1,2 • 10²⁴ молекул.
Оба способа приводят к одному и тому же результату, подтверждая правильность расчетов. Первый способ более нагляден для понимания каждого этапа, второй – более компактен для быстрого вычисления.
§15
Часть I
Вопрос 1
Заполненное предложение: «1 моль любого газа при н.у. занимает одинаковый объём, равный 22,4, л. Этот объём называется МОЛЯРНЫМ и обозначается Vm.»
Давайте разберем каждую часть этого утверждения:
1. «н.у.» (нормальные условия)
— Что это: «н.у.» – это сокращение от «нормальные условия». В химии это стандартизированный набор условий температуры и давления, при которых проводятся измерения или расчеты, чтобы результаты были сопоставимы.
— Значение: Нормальные условия определяются как:
- Температура: 0 °C (или 273,15 K)
- Давление: 1 атмосфера (атм) или 101,325 кПа (килопаскалей).
— Почему важно: Объем газа сильно зависит от температуры и давления. Чтобы иметь возможность сравнивать объемы разных газов, необходимо привести их к одинаковым стандартным условиям.
2. «22,4» и «л» (22,4 литра)
— Что это: Это конкретное значение объема.
— Почему именно 22,4 л: Согласно закону Авогадро, равные объемы любых газов при одинаковых температуре и давлении содержат одинаковое число молекул. Из этого следует, что 1 моль любого газа (т.е. 6,022 x 10²³ молекул) при нормальных условиях занимает один и тот же объем, который экспериментально определен и составляет приблизительно 22,4 литра.
— Единица измерения: «л» означает литры – стандартную единицу измерения объема.
3. «МОЛЯРНЫМ» (молярный объем)
— Что это: Молярный объем – это объем, который занимает один моль вещества.
— Смысл: Поскольку 1 моль любого газа при н.у. занимает 22,4 л, этот объем и называется молярным объемом газа при нормальных условиях. Для жидкостей и твердых веществ молярный объем будет другим и зависит от плотности конкретного вещества.
4. «Vm»
— Что это: «Vm» – это общепринятое обозначение для молярного объема.
— Расшифровка: «V» обозначает объем (от латинского «Volumen»), а нижний индекс «m» обозначает «молярный» (от «моль»).
— Единицы измерения: Единицы измерения молярного объема обычно указываются как литры на моль (л/моль) или кубические метры на моль (м³/моль). В данном случае это 22,4 л/моль.
Вопрос 2
Заполненное предложение: «Количество вещества (n) — отношение объёма газа при н. у. к МОЛЯРНОМУ ОБЪЕМУ:
n = V / Vm → Vm измеряется в л/моль.»
Давайте разберем каждую часть этого утверждения:
1. «Количество вещества (n)»
— Что это: Количество вещества (обозначается «n» или «ν» (ню)) – это физическая величина, которая характеризует число структурных единиц (атомов, молекул, ионов, электронов и т.д.) в данной порции вещества.
— Единица измерения: Основной единицей измерения количества вещества в Международной системе единиц (СИ) является моль. 1 моль содержит 6,022 x 10²³ структурных единиц (число Авогадро).
2. «объёма газа при н. у. (V)»
— Что это: «V» здесь обозначает объем газа, измеренный при нормальных условиях (н.у.). Как уже было сказано, нормальные условия – это 0 °C (273,15 K) и 1 атмосфера (101,325 кПа).
— Единица измерения: Объем обычно измеряется в литрах (л) или кубических метрах (м³).
3. «МОЛЯРНОМУ ОБЪЕМУ (Vm)»
— Что это: Молярный объем (Vm) – это объем, который занимает один моль вещества. Для газов при нормальных условиях молярный объем является константой и равен примерно 22,4 л/моль.
— Почему важно: Это значение является ключевым для расчетов с газами, так как оно позволяет связать количество вещества (в молях) с объемом, который этот газ занимает.
— Единица измерения: Молярный объем измеряется в литрах на моль (л/моль) или кубических метрах на моль (м³/моль).
4. Формула: n = V / Vm
— Смысл формулы: Эта формула выражает прямое соотношение: чтобы найти количество вещества газа, нужно разделить измеренный объем этого газа (при н.у.) на объем, который занимает один моль любого газа при тех же условиях (т.е. на молярный объем).
— Пример: Если у вас есть 44,8 л кислорода при н.у., то количество вещества будет n = 44,8 л / 22,4 л/моль = 2 моль.
5. «Vm измеряется в л/моль»
— Подтверждение единиц: Это уточнение единиц измерения для молярного объема, которое было объяснено выше. Оно подтверждает, что в данной формуле, если V измеряется в литрах, то Vm должен быть в литрах на моль, чтобы в результате получить количество вещества в молях (л / (л/моль) = моль).
В итоге: Эта формула является основополагающей для стехиометрических расчетов, включающих газы, позволяя легко переходить от объема газа к его количеству в молях и наоборот, при условии, что газ находится в нормальных условиях.
Вопрос 3
Формула:
\( n = \frac{m}{M} = \frac{V}{V_m} = \frac{N}{N_A} \)
Давайте разберем каждую часть этой формулы:
1. \( n \) — Количество вещества (моль)
— Что это: Количество вещества (обозначается «n» или «ν» (ню)) – это физическая величина, которая характеризует число структурных единиц (атомов, молекул, ионов, электронов и т.д.) в данной порции вещества.
— Единица измерения: Основной единицей измерения количества вещества в Международной системе единиц (СИ) является моль. Один моль содержит \( 6,022 \times 10^{23} \) структурных единиц (число Авогадро).
2. \( n = \frac{m}{M} \) — Расчет через массу
\( m \) — Масса вещества:
— Что это: Фактическая масса данной порции вещества.
— Единица измерения: Обычно измеряется в граммах (г) или килограммах (кг).
\( M \) — Молярная масса:
— Что это: Масса одного моля вещества. Численно равна относительной молекулярной (или атомной) массе, выраженной в г/моль. Например, молярная масса воды (H₂O) = \( 2 \times 1 + 16 = 18 \) г/моль.
— Единица измерения: грамм на моль (г/моль).
— Смысл формулы: Эта часть формулы показывает, что количество вещества можно найти, разделив массу вещества на его молярную массу.
3. \( n = \frac{V}{V_m} \) — Расчет через объем газа
\( V \) — Объем газа:
— Что это: Объем, который занимает газ при определенных условиях.
— Единица измерения: Обычно измеряется в литрах (л) или кубических метрах (м³).
\( V_m \) — Молярный объем газа:
— Что это: Объем, который занимает один моль газа. Для идеальных газов при нормальных условиях (н.у.: 0 °C и 101,325 кПа) молярный объем является константой и равен примерно \( 22,4 \) л/моль.
— Единица измерения: литр на моль (л/моль) или кубический метр на моль (м³/моль).
— Смысл формулы: Эта часть формулы позволяет рассчитать количество вещества для газов, зная их объем и молярный объем при данных условиях (чаще всего при нормальных условиях).
4. \( n = \frac{N}{N_A} \) — Расчет через число частиц
\( N \) — Число частиц:
— Что это: Фактическое количество структурных единиц (атомов, молекул, ионов) в данной порции вещества.
— Единица измерения: Безразмерная величина, просто число.
\( N_A \) — Число Авогадро:
— Что это: Фундаментальная физическая константа, определяющая число структурных единиц в одном моле любого вещества. Ее значение составляет приблизительно \( 6,022 \times 10^{23} \) моль⁻¹.
— Единица измерения: моль⁻¹.
— Смысл формулы: Эта часть формулы связывает макроскопическую величину (количество вещества) с микроскопической (число отдельных частиц). Она показывает, что количество вещества можно найти, разделив общее число частиц на число Авогадро.
В итоге:
Данная формула объединяет три основных способа определения количества вещества, используя разные физические характеристики: массу, объем (для газов) и число частиц. Это позволяет химикам переходить от одной величины к другой в расчетах, что является основой стехиометрии.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!