
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страница 66 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
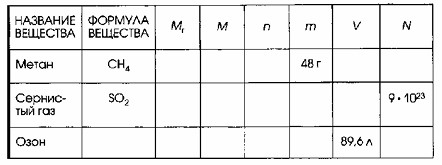
4. Дополните таблицу «Количественные характеристики веществ», делая необходимые вычисления.
Часть II
1. Установите соотношение между названием и размерностью величины.
НАЗВАНИЕ ВЕЛИЧИНЫ
А) количество вещества
Б) объём
В) молярная масса
Г) масса вещества
Д) молярный объём
РАЗМЕРНОСТЬ ВЕЛИЧИНЫ
1) г/моль
2) г
3) моль
4) л/моль
5) л
2. Укажите формулы, которые являются производными от основной формулы
n = V/Vₘ
1) V = m/ρ
2) V = n • Vₘ
3) Vₘ = V/n
4) M = m • Vₘ / V
Вопрос 4
Количественные характеристики веществ
Часть II
Вопрос 1
| А | Б | В | Г | Д |
|---|---|---|---|---|
| 3 | 5 | 1 | 2 | 4 |
Вопрос 2
n = V/Vₘ → V = n · Vₘ
n = V/Vₘ → Vₘ = V / n
n = V/Vₘ = m/M → M = m · Vₘ/V
Ответ: 2, 3, 4.
Вопрос 4
Количественные характеристики веществ
Для заполнения таблицы «Количественные характеристики веществ» используются следующие основные формулы и константы:
Молярная масса (M): Численно равна относительной молекулярной массе (Mr), но выражается в г/моль.
Количество вещества (n):
- n = m / M (масса / молярная масса)
- n = V / Vₘ (объем / молярный объем газа при нормальных условиях)
- n = N / Nₐ (количество молекул / число Авогадро)
Масса (m): m = n · M
Объем (V): V = n · Vₘ (для газов при нормальных условиях)
Число молекул (N): N = n · Nₐ
Константы:
— Молярный объем газа при нормальных условиях (Vₘ) ≈ 22,4 л/моль
— Число Авогадро (Nₐ) ≈ 6 · 10²³ молекул/моль (в данном примере используется упрощенное значение)
Давайте подробно рассмотрим вычисления для каждого вещества:
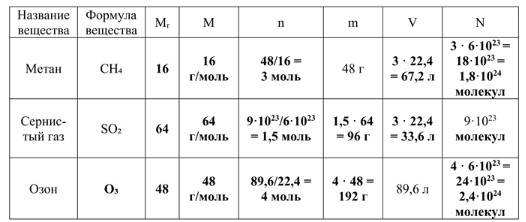
1. Метан (CH₄)
— Название вещества: Метан
— Формула вещества: CH₄
— Mr (Относительная молекулярная масса):
- Mr(CH₄) = Ar(C) + 4 · Ar(H) = 12 + 4 · 1 = 16.
— M (Молярная масса):
- M(CH₄) = 16 г/моль. (Численно равно Mr.)
— m (Масса):
- В таблице указано, что масса метана составляет 48 г. Это исходное данное для расчета количества вещества.
— n (Количество вещества, моль):
- Используем формулу n = m / M.
- n = 48 г / 16 г/моль = 3 моль.
— V (Объем, л):
- Используем формулу V = n · Vₘ.
- V = 3 моль · 22,4 л/моль = 67,2 л.
— N (Число молекул):
- Используем формулу N = n · Nₐ.
- N = 3 моль · (6 · 10²³ молекул/моль) = 18 · 10²³ молекул = 1,8 · 10²⁴ молекул.
2. Сернистый газ (SO₂)
— Название вещества: Сернистый газ
— Формула вещества: SO₂
— Mr (Относительная молекулярная масса):
- Mr(SO₂) = Ar(S) + 2 · Ar(O) = 32 + 2 · 16 = 32 + 32 = 64.
— M (Молярная масса):
- M(SO₂) = 64 г/моль. (Численно равно Mr.)
— N (Число молекул):
- В таблице указано, что число молекул сернистого газа составляет 9 · 10²³ молекул. Это исходное данное для расчета количества вещества.
— n (Количество вещества, моль):
- Используем формулу n = N / Nₐ.
- n = (9 · 10²³ молекул) / (6 · 10²³ молекул/моль) = 1,5 моль.
— m (Масса, г):
- Используем формулу m = n · M.
- m = 1,5 моль · 64 г/моль = 96 г.
— V (Объем, л):
- Используем формулу V = n · Vₘ.
- V = 1,5 моль · 22,4 л/моль = 33,6 л.
3. Озон (O₃)
— Название вещества: Озон
— Формула вещества: O₃
— Mr (Относительная молекулярная масса):
- Mr(O₃) = 3 · Ar(O) = 3 · 16 = 48.
- M (Молярная масса):
- M(O₃) = 48 г/моль. (Численно равно Mr.)
— V (Объем, л):
- В таблице указано, что объем озона составляет 89,6 л. Это исходное данное для расчета количества вещества.
— n (Количество вещества, моль):
- Используем формулу n = V / Vₘ.
- n = 89,6 л / 22,4 л/моль = 4 моль.
— m (Масса, г):
- Используем формулу m = n · M.
- m = 4 моль · 48 г/моль = 192 г.
— N (Число молекул):
- Используем формулу N = n · Nₐ.
- N = 4 моль · (6 · 10²³ молекул/моль) = 24 · 10²³ молекул = 2,4 · 10²⁴ молекул.
Таким образом, таблица заполнена путем последовательного применения химических формул, исходя из одного известного количественного параметра для каждого вещества (масса для метана, число молекул для сернистого газа, объем для озона) и использования молярной массы, молярного объема и числа Авогадро.
Часть II
Вопрос 1
Для каждой физической величины существует определенная единица измерения (размерность), которая отражает ее природу.
А) Количество вещества
Количество вещества — это фундаментальная величина в химии, которая измеряет число структурных единиц (атомов, молекул, ионов и т.д.). Ее стандартной единицей измерения является моль.
Следовательно, А соответствует 3 (моль).
Б) Объём
Объём — это мера пространства, занимаемого веществом. В химии, особенно при работе с газами, стандартной единицей объёма является литр.
Следовательно, Б соответствует 5 (л).
В) Молярная масса
Молярная масса (M) — это масса одного моля вещества. Она выражается как отношение массы к количеству вещества. Единицей измерения молярной массы является грамм на моль.
Следовательно, В соответствует 1 (г/моль).
Г) Масса вещества
Масса вещества — это мера количества материи в объекте. В химии масса обычно измеряется в граммах.
Следовательно, Г соответствует 2 (г).
Д) Молярный объём
Молярный объём (Vₘ) — это объём одного моля вещества. Для газов при нормальных условиях он является постоянной величиной (≈ 22,4 л/моль). Он выражается как отношение объёма к количеству вещества. Единицей измерения молярного объёма является литр на моль.
Следовательно, Д соответствует 4 (л/моль).
Итоговое соотношение:
| А | Б | В | Г | Д |
|---|---|---|---|---|
| 3 | 5 | 1 | 2 | 4 |
Вопрос 2
Исходная (основная) формула: n = V/Vₘ (количество вещества равно отношению объёма к молярному объёму).
Рассмотрим каждую из предложенных формул:
1) V = m/ρ
Эта формула связывает объём (V) с массой (m) и плотностью (ρ). Она является определением плотности (ρ = m/V).
Данная формула не является производной непосредственно из n = V/Vₘ, поскольку в ней отсутствуют n или Vₘ.
Следовательно, это неверный вариант.
2) V = n · Vₘ
Чтобы получить эту формулу из основной n = V/Vₘ, необходимо умножить обе части уравнения на Vₘ:
n · Vₘ = (V/Vₘ) · Vₘ
n · Vₘ = V
Это прямое алгебраическое преобразование исходной формулы.
Следовательно, это верный вариант.
3) Vₘ = V/n
Чтобы получить эту формулу из основной n = V/Vₘ, сначала умножим обе части на Vₘ (как в предыдущем пункте): n · Vₘ = V.
Затем разделим обе части на n:
(n · Vₘ) / n = V / n
Vₘ = V / n
Это прямое алгебраическое преобразование исходной формулы.
Следовательно, это верный вариант.
4) M = m · Vₘ / V
Эта формула связывает молярную массу (M) с массой (m), молярным объёмом (Vₘ) и объёмом (V).
Для ее вывода необходимо использовать не только основную формулу n = V/Vₘ, но и другую фундаментальную формулу для количества вещества: n = m/M (количество вещества равно отношению массы к молярной массе).
Приравняем два выражения для n:
m/M = V/Vₘ
Теперь выразим M. Перемножим «крест-накрест»:
m · Vₘ = M · V
Разделим обе части на V, чтобы выразить M:
M = (m · Vₘ) / V
Поскольку эта формула получена путем комбинации основной формулы n = V/Vₘ с другой базовой формулой (n = m/M), она считается производной в контексте решения химических задач.
Следовательно, это верный вариант.
Итоговый ответ:
Производными от основной формулы n = V/Vₘ являются формулы: 2, 3, 4.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!