
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страница 71 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
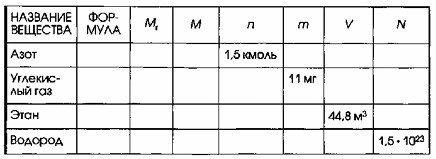
6. Дополните таблицу, делая необходимые вычисления.
Часть II
1. Сколько молекул содержится в 513 мг сахарозы C₁₂H₂₂O₁₁?
2. Вычислите массу (н. у.) 89,6 м³ азота.
Вопрос 6
Часть II
Вопрос 1
Дано:
m(C₁₂H₂₂O₁₁)=513 мг
M(C₁₂H₂₂O₁₁)= 342 г/моль
\(N_A\)=6·10²³ молекул/моль
N(C₁₂H₂₂O₁₁)=?
m(C₁₂H₂₂O₁₁)=513 мг = 0,513 г
n(C₁₂H₂₂O₁₁)=m/M=0,513 /342=0,0015 (моль)
N(C₁₂H₂₂O₁₁)= n · \(N_A\)=0,0015 · 6·10²³ = 9·10²⁰ (молекул)
Ответ: 9·10²⁰ молекул.
Вопрос 2
Дано:
V(N₂)=89,6 м³
M(N₂)=28 г/моль
\(V_m\)= 22,4 л/моль
m(N₂)=?
V(N₂)=89,6 м³ = 89600 л
n(N₂)= V/\(V_m\)=89600/22,4=4000 (моль)
m(N₂)= n · M=4000 · 28= 112000 (г) =112 (кг)
Ответ: 112 кг.
Вопрос 6
Для успешного заполнения таблицы, нам понадобятся следующие ключевые понятия и формулы:
1. Относительная Атомная Масса (\(A_r\)) и Относительная Молекулярная Масса (\(M_r\))
Относительная Атомная Масса (\(A_r\)):
Это безразмерная величина, которая показывает, во сколько раз масса атома данного элемента больше \(1/12\) массы атома углерода-12. Значения \(A_r\) для каждого элемента можно найти в Периодической системе химических элементов. Например:
\(
A_r(N) \approx 14 \, (\text{азот}), \, A_r(C) \approx 12 \, (\text{углерод}), \, A_r(O) \approx 16 \, (\text{кислород}),\)
\(\, A_r(H) \approx 1 \, (\text{водород}).
\)
Важно: \(A_r\) не имеет единиц измерения, так как это отношение масс.
Относительная Молекулярная Масса (\(M_r\)):
Это безразмерная величина, которая показывает, во сколько раз масса молекулы данного вещества больше \(1/12\) массы атома углерода-12. Она рассчитывается как сумма относительных атомных масс всех атомов, входящих в состав молекулы. Например, для углекислого газа (\(CO_2\)):
\(
M_r(CO_2) = A_r(C) + 2 \cdot A_r(O) = 12 + 2 \cdot 16 = 44.
\)
Как и \(A_r\), \(M_r\) не имеет единиц измерения.
2. Молярная Масса (\(M\))
Определение:
Молярная масса – это масса одного моля вещества.
Единицы измерения:
\(
\text{г/моль}
\)
Связь с \(M_r\):
Численно молярная масса (\(M\)) равна относительной молекулярной массе
(\(M_r\)), но имеет определенные единицы измерения. Например:
\(
M(CO_2) = 44 \, \text{г/моль}.
\)
Это означает, что 1 моль углекислого газа весит 44 грамма.
3. Количество Вещества (\(n\))
Определение:
Моль – это основная единица измерения количества вещества в Международной системе единиц (СИ). Один моль любого вещества содержит определенное количество структурных единиц (атомов, молекул, ионов и т.д.).
Единицы измерения:
\(
\text{моль} \, (\text{mol})
\)
Конвертация:
Иногда количество вещества может быть дано в киломолях (\(кмоль\)) или миллимолях (\(ммоль\)):
\(
1 \, \text{кмоль} = 1000 \, \text{моль}, \, 1 \, \text{моль} = 1000 \, \text{ммоль}.
\)
4. Масса (\(m\))
Определение:
Количество вещества, выраженное в единицах массы.
Единицы измерения:
\(
\text{г} \, (\text{граммы}), \, \text{кг} \, (\text{килограммы}), \, \text{мг} \, (\text{миллиграммы}).
\)
Конвертация:
\(
1 \, \text{кг} = 1000 \, \text{г}, \, 1 \, \text{г} = 1000 \, \text{мг} \, (\text{или} \, 1 \, \text{мг} = 0,001 \, \text{г}).
\)
5. Объем (\(V\))
Определение:
Пространство, занимаемое веществом. В данной задаче объем рассматривается для газов при определенных условиях.
Единицы измерения:
\(
\text{л} \, (\text{литры}), \, \text{м}^3 \, (\text{кубические метры}), \, \text{мл} \, (\text{миллилитры}).
\)
Нормальные Условия (н.у.):
Для газов очень важны условия, при которых измеряется объем. Нормальные условия (н.у.) определены как:
Температура: \(0 \, °C \, (\text{или} \, 273,15 \, K)\).
Давление: \(1 \, \text{атмосфера} \, (\text{101,325 кПа})\).
Конвертация:
\(
1 \, \text{м}^3 = 1000 \, \text{л}, \, 1 \, \text{л} = 1000 \, \text{мл}.
\)
6. Число Частиц (\(N\))
Определение:
Фактическое количество атомов, молекул или других структурных единиц в образце вещества.
Единицы измерения:
\(
\text{молекулы}, \, \text{атомы}, \, \text{ионы}.
\)
7. Константы
Молярный Объем Газов (\(V_m\)):
При нормальных условиях (н.у.) один моль любого идеального газа занимает объем \(22,4 \, \text{литра}\). Это универсальная константа для газов при н.у.:
\(
V_m = 22,4 \, \text{л/моль}.
\)
Число Авогадро (\(N_A\)):
Это количество структурных единиц (атомов, молекул, ионов) в одном моле любого вещества:
\(
N_A \approx 6,022 \cdot 10^{23} \, \text{частиц/моль}.
\)
В данной таблице для упрощения расчетов используется округленное значение:
\(
N_A = 6 \cdot 10^{23} \, \text{молекул/моль}.
\)
Основные Формулы для Расчетов
Эти формулы связывают все вышеперечисленные величины и являются основой для заполнения таблицы:
1. Связь между массой (\(m\)), количеством вещества (\(n\)) и молярной массой
(\(M\)):
\(
n = \frac{m}{M}
\)
(Если известны масса и молярная масса, можно найти количество вещества).
\(
m = n \cdot M
\)
(Если известны количество вещества и молярная масса, можно найти массу).
2. Связь между объемом газа (\(V\)), количеством вещества (\(n\)) и молярным объемом (\(V_m\)) (только для газов при н.у.):
\(
n = \frac{V}{V_m}
\)
(Если известен объем газа при н.у., можно найти количество вещества).
\(
V = n \cdot V_m
\)
(Если известно количество вещества, можно найти объем газа при н.у.).
3. Связь между числом частиц (\(N\)), количеством вещества (\(n\)) и числом Авогадро (\(N_A\)):
\(
n = \frac{N}{N_A}
\)
(Если известно число частиц, можно найти количество вещества).
\(
N = n \cdot N_A
\)
(Если известно количество вещества, можно найти число частиц).
Теперь, вооружившись этими знаниями, пройдемся по каждой строке таблицы, подробно объясняя каждый шаг вычислений.
1. Азот (N₂)
Дано: n = 1,5 кмоль.
Цель: Найти Mr, M, m, V, N.
1. Проверка Mr и M:
Молекула азота N₂ состоит из двух атомов азота.
Относительная атомная масса азота Ar(N) ≈ 14.
\(
M_r(N_2) = 2 \cdot A_r(N) = 2 \cdot 14 = 28.
\)
Молярная масса \(M(N_2) = 28 \, \text{г/моль}\).
2. Расчет \(n\) (Количество вещества):
Дано: 1,5 кмоль.
Для использования в формулах, нам нужны моли.
Конвертация: 1 кмоль = 1000 моль.
\(
n = 1,5 \, \text{кмоль} \cdot \frac{1000 \, \text{моль}}{1 \, \text{кмоль}} = 1500 \, \text{моль}.
\)
(Это значение используется в дальнейших расчетах).
3. Расчет \(m\) (Масса):
Мы знаем \(n \, (1500 \, \text{моль})\) и \(M \, (28 \, \text{г/моль})\).
Используем формулу: \(m = n \cdot M\).
\(
m = 1500 \, \text{моль} \cdot 28 \, \text{г/моль} = 42000 \, \text{г}.
\)
Для удобства переводим в килограммы (1 кг = 1000 г):
\(
m = \frac{42000 \, \text{г}}{1000 \, \text{г/кг}} = 42 \, \text{кг}.
\)
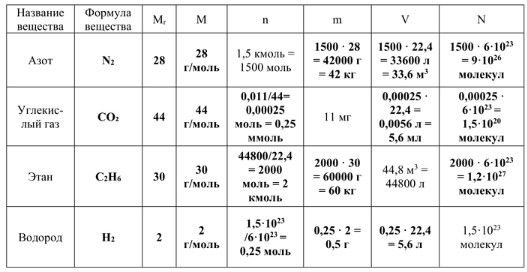
Результат в таблице: 1500 ⋅ 28 = 42000 г = 42 кг.
4. Расчет \(V\) (Объем):
Мы знаем \(n \, (1500 \, \text{моль})\) и \(V_m \, (22,4 \, \text{л/моль})\).
Используем формулу (для газов при н.у.): \(V = n \cdot V_m\).
\(
V = 1500 \, \text{моль} \cdot 22,4 \, \text{л/моль} = 33600 \, \text{л}.
\)
Для удобства переводим в кубические метры (1 м³ = 1000 л):
\(
V = \frac{33600 \, \text{л}}{1000 \, \text{л/м}^3} = 33,6 \, \text{м}^3.
\)
Результат в таблице: 1500 ⋅ 22,4 = 33600 л = 33,6 м³.
5. Расчет \(N\) (Число молекул):
Мы знаем \(n \, (1500 \, \text{моль})\) и \(N_A \, (6 \cdot 10^{23} \, \text{молекул/моль})\).
Используем формулу: \(N = n \cdot N_A\).
\(
N = 1500 \, \text{моль} \cdot (6 \cdot 10^{23} \, \text{молекул/моль}) = 9000 \cdot 10^{23} \, \text{молекул}.
\)
Записываем в стандартной научной нотации (переносим запятую на 3 знака влево, увеличивая степень на 3):
\(
N = 9 \cdot 10^3 \cdot 10^{23} = 9 \cdot 10^{26} \, \text{молекул}.
\)
Результат в таблице: 1500 ⋅ 6 ⋅ 10²³ = 9 ⋅ 10²⁶ молекул.
2. Углекислый газ (CO₂)
Дано: m = 11 мг.
Цель: Найти Mr, M, n, V, N.
1. Проверка Mr и M:
Молекула CO₂ состоит из одного атома углерода и двух атомов кислорода.
Ar(C) ≈ 12, Ar(O) ≈ 16.
\(
M_r(CO_2) = A_r(C) + 2 \cdot A_r(O) = 12 + 2 \cdot 16 = 12 + 32 = 44.
\)
Молярная масса \(M(CO_2) = 44 \, \text{г/моль}\).
2. Подготовка \(m\) (Масса):
Дано: 11 мг.
Для использования в формулах с \(M\) в г/моль, нам нужны граммы.
Конвертация: 1 мг = 0,001 г.
\(
m = 11 \, \text{мг} \cdot \frac{0,001 \, \text{г}}{1 \, \text{мг}} = 0,011 \, \text{г}.
\)
3. Расчет \(n\) (Количество вещества):
Мы знаем \(m \, (0,011 \, \text{г})\) и \(M \, (44 \, \text{г/моль})\).
Используем формулу: \(n = \frac{m}{M}\).
\(
n = \frac{0,011 \, \text{г}}{44 \, \text{г/моль}} = 0,00025 \, \text{моль}.
\)
В таблице также указано в миллимолях: \(0,00025 \, \text{моль} \cdot \frac{1000 \, \text{ммоль}}{1 \, \text{моль}} = 0,25 \, \text{ммоль}.\)
Результат в таблице: 0,011/44 = 0,00025 моль = 0,25 ммоль.
4. Расчет \(V\) (Объем):
Мы знаем \(n \, (0,00025 \, \text{моль})\) и \(V_m \, (22,4 \, \text{л/моль})\).
Используем формулу (для газов при н.у.): \(V = n \cdot V_m\).
\(
V = 0,00025 \, \text{моль} \cdot 22,4 \, \text{л/моль} = 0,0056 \, \text{л}.
\)
Для удобства переводим в миллилитры (1 л = 1000 мл):
\(
V = 0,0056 \, \text{л} \cdot \frac{1000 \, \text{мл}}{1 \, \text{л}} = 5,6 \, \text{мл}.
\)
Результат в таблице: 0,00025 ⋅ 22,4 = 0,0056 л = 5,6 мл.
5. Расчет \(N\) (Число молекул):
Мы знаем \(n \, (0,00025 \, \text{моль})\) и \(N_A \, (6 \cdot 10^{23} \, \text{молекул/моль})\).
Используем формулу: \(N = n \cdot N_A\).
\(
N = 0,00025 \, \text{моль} \cdot (6 \cdot 10^{23} \, \text{молекул/моль}) = 0,0015 \cdot 10^{23} \, \text{молекул}.
\)
Записываем в стандартной научной нотации (переносим запятую на 3 знака вправо, уменьшая степень на 3):
\(
N = 1,5 \cdot 10^{-3} \cdot 10^{23} = 1,5 \cdot 10^{20} \, \text{молекул}.
\)
Результат в таблице: 0,00025 ⋅ 6 ⋅ 10²³ = 1,5 ⋅ 10²⁰ молекул.
3. Этан (C₂H₆)
Дано: V = 44,8 м³.
Цель: Найти Mr, M, n, m, N.
1. Проверка Mr и M:
Молекула этана C₂H₆ состоит из двух атомов углерода и шести атомов водорода.
Ar(C) ≈ 12, Ar(H) ≈ 1.
\(
M_r(C_2H_6) = 2 \cdot A_r(C) + 6 \cdot A_r(H) = 2 \cdot 12 + 6 \cdot 1 = 24 + 6 = 30.
\)
Молярная масса \(M(C_2H_6) = 30 \, \text{г/моль}\).
2. Подготовка \(V\) (Объем):
Дано: 44,8 м³.
Для использования в формуле с \(V_m\) в л/моль, нам нужны литры.
Конвертация: 1 м³ = 1000 л.
\(
V = 44,8 \, \text{м}^3 \cdot \frac{1000 \, \text{л}}{1 \, \text{м}^3} = 44800 \, \text{л}.
\)
3. Расчет \(n\) (Количество вещества):
Мы знаем \(V \, (44800 \, \text{л})\) и \(V_m \, (22,4 \, \text{л/моль})\).
Используем формулу (для газов при н.у.): \(n = \frac{V}{V_m}\).
\(
n = \frac{44800 \, \text{л}}{22,4 \, \text{л/моль}} = 2000 \, \text{моль}.
\)
В таблице также указано в киломолях: \(2000 \, \text{моль} / \frac{1000 \, \text{моль}}{1 \, \text{кмоль}} = 2 \, \text{кмоль}.\)
Результат в таблице: 44800/22,4 = 2000 моль = 2 кмоль.
4. Расчет \(m\) (Масса):
Мы знаем \(n \, (2000 \, \text{моль})\) и \(M \, (30 \, \text{г/моль})\).
Используем формулу: \(m = n \cdot M\).
\(
m = 2000 \, \text{моль} \cdot 30 \, \text{г/моль} = 60000 \, \text{г}.
\)
Для удобства переводим в килограммы (1 кг = 1000 г):
\(
m = \frac{60000 \, \text{г}}{1000 \, \text{г/кг}} = 60 \, \text{кг}.
\)
Результат в таблице: 2000 ⋅ 30 = 60000 г = 60 кг.
5. Расчет \(N\) (Число молекул):
Мы знаем \(n \, (2000 \, \text{моль})\) и \(N_A \, (6 \cdot 10^{23} \, \text{молекул/моль})\).
Используем формулу: \(N = n \cdot N_A\).
\(
N = 2000 \, \text{моль} \cdot (6 \cdot 10^{23} \, \text{молекул/моль}) = 12000 \cdot 10^{23} \, \text{молекул}.
\)
Записываем в стандартной научной нотации (переносим запятую на 4 знака влево, увеличивая степень на 4):
\(
N = 1,2 \cdot 10^4 \cdot 10^{23} = 1,2 \cdot 10^{27} \, \text{молекул}.
\)
Результат в таблице: 2000 ⋅ 6 ⋅ 10²³ = 1,2 ⋅ 10²⁷ молекул.
4. Водород (H₂)
Дано: N = 1,5 ⋅ 10²³ молекул.
Цель: Найти Mr, M, n, m, V.
1. Проверка Mr и M:
Молекула водорода H₂ состоит из двух атомов водорода.
Ar(H) ≈ 1.
\(
M_r(H_2) = 2 \cdot A_r(H) = 2 \cdot 1 = 2.
\)
Молярная масса \(M(H_2) = 2 \, \text{г/моль}\).
2. Расчет \(n\) (Количество вещества):
Мы знаем \(N \, (1,5 \cdot 10^{23} \, \text{молекул})\) и \(N_A \, (6 \cdot 10^{23} \, \text{молекул/моль})\).
Используем формулу: \(n = \frac{N}{N_A}\).
\(
n = \frac{1,5 \cdot 10^{23} \, \text{молекул}}{6 \cdot 10^{23} \, \text{молекул/моль}}.
\)
Здесь \(10^{23}\) сокращаются, и остается: \(n = \frac{1,5}{6} = 0,25 \, \text{моль}.\)
Результат в таблице: 1,5 ⋅ 10²³ / 6 ⋅ 10²³ = 0,25 моль.
3. Расчет \(m\) (Масса):
Мы знаем \(n \, (0,25 \, \text{моль})\) и \(M \, (2 \, \text{г/моль})\).
Используем формулу: \(m = n \cdot M\).
\(
m = 0,25 \, \text{моль} \cdot 2 \, \text{г/моль} = 0,5 \, \text{г}.
\)
Результат в таблице: 0,25 ⋅ 2 = 0,5 г.
4. Расчет \(V\) (Объем):
Мы знаем \(n \, (0,25 \, \text{моль})\) и \(V_m \, (22,4 \, \text{л/моль})\).
Используем формулу (для газов при н.у.): \(V = n \cdot V_m\).
\(
V = 0,25 \, \text{моль} \cdot 22,4 \, \text{л/моль} = 5,6 \, \text{л}.
\)
Результат в таблице: 0,25 ⋅ 22,4 = 5,6 л.
Таким образом, каждый пропуск в таблице был заполнен путем последовательного применения основных химических формул, используя данные из других столбцов и известные константы (молярный объем и число Авогадро), а также учитывая необходимые конвертации единиц измерения. Эта методика позволяет решать широкий круг задач по химическим расчетам.
Часть II
Вопрос 1
Дано:
Масса сахарозы (\(m(C₁₂H₂₂O₁₁)\)) = 513 мг
Молярная масса сахарозы (\(M(C₁₂H₂₂O₁₁)\)) = 342 г/моль
Число Авогадро (\(N_A\)) = \(6 \cdot 10^{23}\) молекул/моль
Решение:
1. Перевод массы из миллиграммов в граммы:
Молярная масса дана в \(г/моль\), поэтому для согласованности единиц необходимо перевести массу сахарозы из миллиграммов (мг) в граммы (г).
\(1 \, г = 1000 \, мг\)
\(m(C₁₂H₂₂O₁₁) = 513 \, мг = \frac{513}{1000} \, г = 0{,}513 \, г\)
2. Вычисление количества вещества (молей) сахарозы (\(n\)):
Количество вещества (\(моль\)) рассчитывается по формуле:
\(n = \frac{m}{M}\)
где \(m\) — масса вещества, \(M\) — его молярная масса.
\(n(C₁₂H₂₂O₁₁) = \frac{0{,}513 \, г}{342 \, г/моль} = 0{,}0015 \, моль\)
3. Вычисление числа молекул сахарозы (\(N\)):
Число молекул (\(N\)) рассчитывается по формуле:
\(N = n \cdot N_A\)
где \(n\) — количество вещества в молях, \(N_A\) — число Авогадро.
\(N(C₁₂H₂₂O₁₁) = 0{,}0015 \, моль \cdot 6 \cdot 10^{23} \, молекул/моль = 9 \cdot 10^{20} \, молекул\)
Ответ: \(9 \cdot 10^{20}\) молекул.
Вопрос 2
Дано:
Объем азота (\(V(N₂)\)) = 89,6 м³
Молярная масса азота (\(M(N₂)\)) = 28 г/моль
Молярный объем газов при н. у. (\(V_m\)) = 22,4 л/моль
Решение:
1. Перевод объема из кубических метров в литры:
Молярный объем газов (\(V_m\)) дан в \(л/моль\), поэтому для согласованности единиц необходимо перевести объем азота из кубических метров (\(м³\)) в литры (\(л\)).
\(1 \, м³ = 1000 \, л\)
\(V(N₂) = 89{,}6 \, м³ = 89{,}6 \cdot 1000 \, л = 89600 \, л\)
2. Вычисление количества вещества (молей) азота (\(n\)):
Количество вещества (\(моль\)) для газов при нормальных условиях рассчитывается по формуле:
\(n = \frac{V}{V_m}\)
где \(V\) — объем газа, \(V_m\) — молярный объем газа.
\(n(N₂) = \frac{89600 \, л}{22{,}4 \, л/моль} = 4000 \, моль\)
3. Вычисление массы азота (\(m\)):
Масса вещества (\(m\)) рассчитывается по формуле:
\(m = n \cdot M\)
где \(n\) — количество вещества в молях, \(M\) — его молярная масса.
\(m(N₂) = 4000 \, моль \cdot 28 \, г/моль = 112000 \, г\)
4. Перевод массы из граммов в килограммы:
\(1 \, кг = 1000 \, г\)
\(m(N₂) = \frac{112000 \, г}{1000} = 112 \, кг\)
Ответ: \(112 \, кг.\)

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!