
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страница 91 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
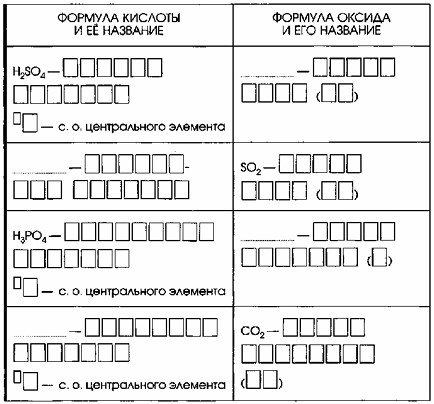
5. Каждой кислоте соответствует свой оксид. Дополните таблицу «Кислоты и соответствующие им оксиды».
Вопрос 5
Кислоты и соответствующие им оксиды
| Формула кислоты и ее название | Формула оксида и его название |
|---|---|
| H₂SO₄ – серная кислота +6 – с.о. центрального элемента | SO₃ – оксид серы (VI) |
| H₂SO₃ – сернистая кислота +4 – с.о. центрального элемента | SO₂ – оксид серы (IV) |
| H₃PO₄ – фосфорная кислота +5 – с.о. центрального элемента | P₂O₅ – оксид фосфора (V) |
| H₂CO₃ – угольная кислота +4 – с.о. центрального элемента | CO₂ – оксид углерода (IV) |
Вопрос 5
Решение данного задания заключается в заполнении таблицы, устанавливающей соответствие между кислотами и их оксидами, а также указывающей степень окисления центрального элемента.
Для этого необходимо:
- Определить степень окисления (с.о.) центрального элемента в кислоте.
Водород (H) в кислотах обычно имеет с.о. +1.
Кислород (O) в кислотах обычно имеет с.о. -2.
Сумма степеней окисления всех элементов в нейтральной молекуле равна нулю. - Назвать кислоту в соответствии с правилами номенклатуры (используя суффиксы «-ная», «-овая» для высших степеней окисления и «-истая» для более низких).
- Определить формулу соответствующего оксида.
Оксид, соответствующий кислоте, содержит тот же центральный элемент в той же степени окисления. - Назвать оксид по систематической номенклатуре (оксид + название элемента + степень окисления элемента римской цифрой в скобках).
Применим эти шаги для каждой строки таблицы:
Строка 1:
Кислота: H₂SO₄
Определение с.о. серы (S):
2 * (+1) (для H) + S + 4 * (-2) (для O) = 0
2 + S — 8 = 0
S — 6 = 0
S = +6
Название кислоты: Серная кислота (сера в высшей степени окисления +6).
Оксид:
Формула оксида: Сера со степенью окисления +6 и кислород со степенью окисления -2. Для нейтральной молекулы: S(+6)O₂(-2) => SO₃ (1 * (+6) + 3 * (-2) = 0).
Название оксида: Оксид серы (VI).
Строка 2:
Кислота: H₂SO₃
Определение с.о. серы (S):
2 * (+1) (для H) + S + 3 * (-2) (для O) = 0
2 + S — 6 = 0
S — 4 = 0
S = +4
Название кислоты: Сернистая кислота (сера в более низкой степени окисления +4 по сравнению с +6).
Оксид:
Формула оксида: Сера со степенью окисления +4 и кислород со степенью окисления -2. Для нейтральной молекулы: S(+4)O₂(-2) => SO₂ (1 * (+4) + 2 * (-2) = 0).
Название оксида: Оксид серы (IV).
Строка 3:
Кислота: H₃PO₄
Определение с.о. фосфора (P):
3 * (+1) (для H) + P + 4 * (-2) (для O) = 0
3 + P — 8 = 0
P — 5 = 0
P = +5
Название кислоты: Фосфорная кислота (фосфор в высшей степени окисления +5).
Оксид:
Формула оксида: Фосфор со степенью окисления +5 и кислород со степенью окисления -2. Для нейтральной молекулы: P₂O₅ (2 * (+5) + 5 * (-2) = 0).
Название оксида: Оксид фосфора (V).
Строка 4:
Кислота: H₂CO₃
Определение с.о. углерода (C):
2 * (+1) (для H) + C + 3 * (-2) (для O) = 0
2 + C — 6 = 0
C — 4 = 0
C = +4
Название кислоты: Угольная кислота (углерод в высшей степени окисления +4).
Оксид:
Формула оксида: Углерод со степенью окисления +4 и кислород со степенью окисления -2. Для нейтральной молекулы: C(+4)O₂(-2) => CO₂ (1 * (+4) + 2 * (-2) = 0).
Название оксида: Оксид углерода (IV).
Таким образом, заполненная таблица выглядит следующим образом:
| Формула кислоты и ее название | Формула оксида и его название |
|---|---|
| H₂SO₄ – серная кислота +6 – с.о. центрального элемента | SO₃ – оксид серы (VI) |
| H₂SO₃ – сернистая кислота +4 – с.о. центрального элемента | SO₂ – оксид серы (IV) |
| H₃PO₄ – фосфорная кислота +5 – с.о. центрального элемента | P₂O₅ – оксид фосфора (V) |
| H₂CO₃ – угольная кислота +4 – с.о. центрального элемента | CO₂ – оксид углерода (IV) |

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!