
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страница 98 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
4.
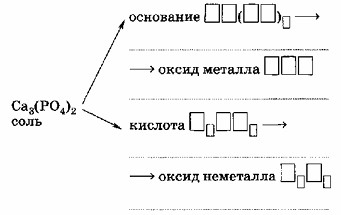
6. Каждой соли кислородсодержащей кислоты соответствуют основание и кислота, а также оксиды металла и неметалла:
Вопрос 4
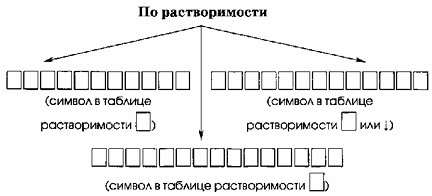
По растворимости:
- РАСТВОРИМЫЕ (символ в таблице растворимости Р)
- НЕРАСТВОРИМЫЕ (символ в таблице растворимости Н)
- МАЛОРАСТВОРИМЫЕ (символ в таблице растворимости М)
Вопрос 6
| Ca₃(PO₄)₂ | Основание Ca(OH)₂ – гидроксид кальция |
| Оксид СаО – оксид кальция | |
| Кислота Н₃РО₄ — фосфорная | |
| Оксид P₂O₅ – оксид фосфора (V) |
Вопрос 4
Данная часть задания направлена на проверку знаний основных категорий растворимости веществ в воде и их условных обозначений, которые используются в таблицах растворимости. Диаграмма на картинке иллюстрирует классификацию веществ по растворимости.
Ответ на этот вопрос является стандартным определением из курса химии. Вещества делятся на три основные категории по их растворимости:
РАСТВОРИМЫЕ (Р): Вещества, которые хорошо растворяются в воде. Обычно это соли щелочных металлов, нитраты, большинство солей аммония и некоторые другие. В таблицах растворимости обозначаются символом «Р«.
НЕРАСТВОРИМЫЕ (Н): Вещества, которые практически не растворяются в воде (их растворимость настолько мала, что ею можно пренебречь). Примеры: большинство оксидов, гидроксидов металлов, некоторые соли (например, сульфиды, карбонаты, фосфаты многих металлов). В таблицах растворимости обозначаются символом «Н«.
МАЛОРАСТВОРИМЫЕ (М): Вещества, которые растворяются в воде в очень незначительных количествах, но все же заметно больше, чем нерастворимые. Примеры: гидроксид кальция Ca(OH)₂, сульфат кальция CaSO₄. В таблицах растворимости обозначаются символом «М«.
Вопрос 6
Каждой соли кислородсодержащей кислоты соответствуют основание и кислота, а также оксиды металла и неметалла.
Задание просит определить «родительские» соединения (основание, кислоту, оксид металла, оксид неметалла) для данной соли — фосфата кальция (Ca₃(PO₄)₂). Это фундаментальное понятие в неорганической химии, связывающее соли с их исходными веществами, из которых они могли бы быть образованы.
Решение:
1. Анализ соли Ca₃(PO₄)₂:
Соль состоит из катиона металла (Ca²⁺) и аниона кислотного остатка (PO₄³⁻).
Катион кальция (Ca²⁺) происходит от металла кальция (Ca).
Анион фосфата (PO₄³⁻) происходит от неметалла фосфора (P), входящего в состав кислотного остатка.
2. Определение соответствующего основания:
Основание образуется из катиона металла и гидроксид-ионов (OH⁻).
Металл в соли — кальций (Ca). Кальций — элемент II группы, образует катион Ca²⁺ (валентность II).
Следовательно, соответствующее основание — гидроксид кальция Ca(OH)₂. (Ca²⁺ + 2OH⁻ → Ca(OH)₂)
3. Определение соответствующего оксида металла:
Оксид металла образуется из металла и кислорода.
Для кальция (Ca) с валентностью II соответствующий оксид — оксид кальция СаО. (Ca + O → CaO)
4. Определение соответствующей кислоты:
Кислота образуется из кислотного остатка и водорода.
Кислотный остаток в соли — фосфат (PO₄³⁻). Заряд -3 указывает на то, что для нейтрализации требуется 3 атома водорода.
Этот кислотный остаток соответствует фосфорной кислоте Н₃РО₄.
5. Определение соответствующего оксида неметалла:
Оксид неметалла образуется из неметалла, входящего в состав кислотного остатка, и кислорода.
Неметалл в фосфорной кислоте — фосфор (P).
Чтобы определить степень окисления фосфора в H₃PO₄: (3 * +1) + X + (4 * -2) = 0 => 3 + X — 8 = 0 => X = +5.
Соответствующий оксид фосфора со степенью окисления +5 — оксид фосфора (V) P₂O₅. (Два атома фосфора с +5 и пять атомов кислорода с -2 дают суммарный заряд 0: 2*(+5) + 5*(-2) = 10 — 10 = 0).

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!