
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страница 99 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
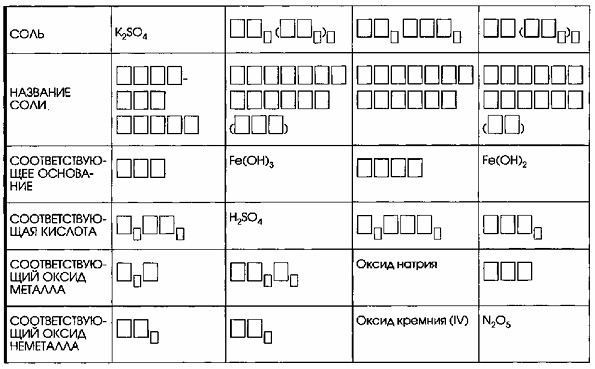
7. Дополните таблицу «Соли и соответствующие им гидроксиды и оксиды».
Вопрос 7
Соли и соответствующие им гидроксиды и оксиды
| Соль | K₂SO₄ | Fe₂(SO₄)₃ | Na₂SiO₃ | Fe(NO₃)₂ |
|---|---|---|---|---|
| Название соли | Сульфат калия | Сульфат железа (III) | Силикрат натрия | Нитрат железа (II) |
| Соответствующее основание | KOH | Fe(OH)₃ | NaOH | Fe(OH)₂ |
| Соответствующая кислота | H₂SO₄ | H₂SO₄ | H₂SiO₃ | HNO₃ |
| Соответствующий оксид металла | K₂O | Fe₂O₃ | Оксид натрия Na₂O | FeO |
| Соответствующий оксид неметалла | SO₃ | SO₃ | Оксид кремния (IV) SiO₂ | N₂O₅ |
Вопрос 7
Для того чтобы заполнить и понять эту таблицу, давайте разберем каждый элемент шаг за шагом, основываясь на фундаментальных правилах неорганической химии.
Общие принципы, которые мы будем использовать:
1. Состав соли: Соль состоит из катиона металла (или аммония NH₄⁺) и аниона кислотного остатка.
2. Степень окисления: Сумма степеней окисления всех атомов в нейтральном соединении равна нулю.
- Кислород (O) в оксидах и большинстве соединений имеет степень окисления -2.
- Водород (H) в кислотах и гидроксидах имеет степень окисления +1.
- Гидроксид-ион (OH⁻) имеет заряд -1.
- Катионы металлов имеют положительную степень окисления, равную номеру группы для металлов главных подгрупп (например, K⁺, Na⁺) или переменные для металлов побочных подгрупп (например, Fe²⁺, Fe³⁺).
- Анионы кислотных остатков имеют отрицательный заряд, равный числу атомов водорода в соответствующей кислоте (например, SO₄²⁻ от H₂SO₄, NO₃⁻ от HNO₃).
3. Соответствующее основание: Образуется из катиона металла соли и гидроксид-ионов (OH⁻). Степень окисления металла в основании такая же, как в соли.
4. Соответствующая кислота: Образуется из аниона кислотного остатка соли и атомов водорода (H).
5. Соответствующий оксид металла (основный оксид): Образуется из атомов металла соли и кислорода (O). Степень окисления металла в оксиде такая же, как в соли.
6. Соответствующий оксид неметалла (кислотный оксид, или кислотный ангидрид): Это оксид, который при взаимодействии с водой образует соответствующую кислоту. Чтобы найти его, обычно «отнимают» молекулы воды от формулы кислоты.
Колонка 1: Соль K₂SO₄
1. Соль: K₂SO₄
Анализ:
K (Калий) — это металл из первой группы, его степень окисления всегда +1.
SO₄ (Сульфат) — это кислотный остаток. Чтобы определить его заряд, вспомним серную кислоту H₂SO₄. Поскольку в ней 2 атома водорода, заряд сульфат-иона равен -2 (SO₄²⁻).
Проверка нейтральности: В K₂SO₄ у нас 2 атома K (+1 * 2 = +2) и 1 сульфат-ион (-2). Сумма зарядов: +2 + (-2) = 0. Формула верна.
2. Название соли: Сульфат калия
Название соли образуется из названия аниона (сульфат) и названия катиона (калия). Поскольку калий имеет фиксированную степень окислеления (+1), римская цифра в названии не требуется.
3. Соответствующее основание: KOH
Металл: Калий (K). Его степень окисления в соли +1.
Гидроксид-ион: OH⁻ (заряд -1).
Чтобы скомбинировать K⁺ и OH⁻ в нейтральное соединение, нужен один K⁺ и один OH⁻.
Формула: KOH (Гидроксид калия).
4. Соответствующая кислота: H₂SO₄
Кислотный остаток: SO₄²⁻.
Этот кислотный остаток происходит от серной кислоты.
Чтобы нейтрализовать заряд -2 у SO₄²⁻, нужно добавить 2 атома водорода (H⁺).
Формула: H₂SO₄ (Серная кислота).
5. Соответствующий оксид металла: K₂O
Металл: Калий (K). Его степень окисления +1.
Кислород: O (степень окисления -2).
Чтобы скомбинировать K⁺ и O²⁻ в нейтральное соединение, нужно 2 атома K (+1 * 2 = +2) и 1 атом O (-2).
Формула: K₂O (Оксид калия).
6. Соответствующий оксид неметалла: SO₃
Кислота: H₂SO₄ (Серная кислота).
Чтобы получить кислотный ангидрид, нужно «отнять» воду от формулы кислоты.
H₂SO₄ — H₂O = SO₃.
Формула: SO₃ (Оксид серы(VI) или серный ангидрид).
Колонка 2: Соль Fe₂(SO₄)₃
В этой колонке нам даны соответствующее основание Fe(OH)₃ и соответствующая кислота H₂SO₄. Мы будем использовать их, чтобы определить соль и другие соединения.
1. Соль: Fe₂(SO₄)₃
Из Fe(OH)₃: Мы видим, что железо (Fe) имеет степень окисления +3, так как к нему присоединено три гидроксид-иона (OH⁻), каждый из которых имеет заряд -1. Значит, катион железа здесь Fe³⁺.
Из H₂SO₄: Мы знаем, что это серная кислота, и ее кислотный остаток — сульфат (SO₄²⁻).
Комбинирование: Нам нужно скомбинировать Fe³⁺ и SO₄²⁻ так, чтобы суммарный заряд был равен нулю. Наименьшее общее кратное для зарядов 3 и 2 равно 6.
Для Fe³⁺: нужно 2 иона Fe³⁺ (2 * +3 = +6).
Для SO₄²⁻: нужно 3 иона SO₄²⁻ (3 * -2 = -6).
Формула: Fe₂(SO₄)₃.
2. Название соли: Сульфат железа (III)
Металл: Железо (Fe).
Кислотный остаток: Сульфат (SO₄).
Поскольку железо может иметь разные степени окисления (например, +2 и +3), мы должны указать его степень окисления в скобках римской цифрой. Здесь это +3.
Название: Сульфат железа (III).
3. Соответствующее основание: Fe(OH)₃
Дано.
Металл: Железо (Fe). Его степень окисления в соли +3.
Гидроксид-ион: OH⁻.
Чтобы скомбинировать Fe³⁺ и OH⁻, нужно 1 Fe³⁺ и 3 OH⁻.
Формула: Fe(OH)₃ (Гидроксид железа (III)).
4. Соответствующая кислота: H₂SO₄
Дано.
Кислотный остаток: SO₄²⁻.
Формула: H₂SO₄ (Серная кислота).
5. Соответствующий оксид металла: Fe₂O₃
Металл: Железо (Fe). Его степень окисления в соли +3.
Кислород: O (степень окисления -2).
Чтобы скомбинировать Fe³⁺ и O²⁻ в нейтральное соединение, нужно 2 атома Fe (+3 * 2 = +6) и 3 атома O (-2 * 3 = -6).
Формула: Fe₂O₃ (Оксид железа (III)).
6. Соответствующий оксид неметалла: SO₃
Кислота: H₂SO₄ (Серная кислота).
Кислотный ангидрид: H₂SO₄ — H₂O = SO₃.
Формула: SO₃ (Оксид серы(VI)).
Колонка 3: Na₂SiO₃ (Силикат натрия)
Исходные данные для этой колонки:
Соответствующий оксид металла: Оксид натрия (дано только название)
Соответствующий оксид неметалла: Оксид кремния (IV) (дано только название)
Пошаговый вывод:
1. Анализ «Оксида натрия»:
Элемент: Натрий (Na).
Степень окисления натрия: Натрий — щелочной металл (группа 1), всегда проявляет степень окисления +1.
Степень окисления кислорода: В оксидах кислород обычно имеет степень окисления -2.
Формула оксида: Чтобы суммарный заряд был равен нулю (2 * (+1) + 1 * (-2) = 0), формула оксида натрия — Na₂O.
Вывод: Металл — натрий (Na), его степень окисления +1.
2. Анализ «Оксида кремния (IV)»:
Элемент: Кремний (Si).
Степень окисления кремния: Римская цифра (IV) в названии «Оксид кремния (IV)» указывает на степень окисления кремния, которая равна +4.
Степень окисления кислорода: -2.
Формула оксида: Чтобы суммарный заряд был равен нулю (1 * (+4) + 2 * (-2) = 0), формула оксида кремния (IV) — SiO₂.
Определение соответствующей кислоты: Оксиды неметаллов являются кислотными оксидами. Соответствующая кислота образуется при их взаимодействии с водой: SiO₂ + H₂O → H₂SiO₃ (Кремниевая кислота).
Вывод: Кислотный остаток из H₂SiO₃ — силикат (SiO₃), имеющий заряд -2 (SiO₃²⁻).
3. Формирование соли:
Катион металла: Na⁺ (из Na₂O).
Анион кислотного остатка: SiO₃²⁻ (из SiO₂).
Для образования электронейтральной соли, нам нужно 2 иона Na⁺ (2 * +1 = +2) и 1 ион SiO₃²⁻ (1 * -2 = -2).
Формула соли: Na₂SiO₃.
4. Название соли:
Металл: Натрий.
Кислотный остаток: Силикат.
Название: Силикат натрия. (Натрий имеет постоянную степень окисления, поэтому римская цифра не нужна).
5. Формирование соответствующего основания:
Металл: Натрий (Na), степень окисления +1.
Гидроксид-ион: OH⁻.
Формула: NaOH (Гидроксид натрия).
6. Формирование соответствующей кислоты:
Уже определено на шаге 2.
Формула: H₂SiO₃ (Кремниевая кислота).
7. Соответствующий оксид металла:
Дано в условии как «Оксид натрия».
Формула: Na₂O.
8. Соответствующий оксид неметалла:
Дано в условии как «Оксид кремния (IV)».
Формула: SiO₂.
Колонка 4: Fe(NO₃)₂ (Нитрат железа (II))
Исходные данные для этой колонки:
Соответствующее основание: Fe(OH)₂ (дана формула)
Соответствующий оксид неметалла: N₂O₅ (дана формула)
Пошаговый вывод:
1. Анализ «Соответствующего основания»: Fe(OH)₂
Формула: Fe(OH)₂ (Гидроксид железа (II)).
Гидроксид-ион (OH⁻) имеет заряд -1. Поскольку в формуле два гидроксид-иона, их суммарный заряд равен -2.
Для нейтральности молекулы, атом железа (Fe) должен иметь заряд +2.
Вывод: Металл — железо (Fe), его степень окисления +2. Катион — Fe²⁺.
2. Анализ «Соответствующего оксида неметалла»: N₂O₅
Формула: N₂O₅ (Оксид азота(V) или пентаоксид диазота).
Это кислотный оксид. Соответствующая кислота образуется при его взаимодействии с водой: N₂O₅ + H₂O → 2HNO₃ (Азотная кислота).
Вывод: Кислотный остаток из HNO₃ — нитрат (NO₃), имеющий заряд -1 (NO₃⁻).
3. Формирование соли:
Катион металла: Fe²⁺ (из Fe(OH)₂).
Анион кислотного остатка: NO₃⁻ (из N₂O₅ через HNO₃).
Для образования электронейтральной соли, нам нужен 1 ион Fe²⁺ (1 * +2 = +2) и 2 иона NO₃⁻ (2 * -1 = -2).
Формула соли: Fe(NO₃)₂.
4. Название соли:
Металл: Железо (Fe).
Кислотный остаток: Нитрат.
Поскольку железо может иметь разные степени окисления (здесь +2), мы указываем его степень окисления в скобках римской цифрой.
Название: Нитрат железа (II).
5. Соответствующее основание:
Это было дано в условии.
Формула: Fe(OH)₂ (Гидроксид железа (II)).
6. Соответствующая кислота:
Уже определено на шаге 2.
Формула: HNO₃ (Азотная кислота).
7. Соответствующий оксид металла:
Металл: Железо (Fe), его степень окисления +2 (из Fe(OH)₂ или Fe(NO₃)₂).
Кислород: O (степень окисления -2).
Для образования нейтрального соединения из Fe²⁺ и O²⁻, нужен 1 атом Fe (+2) и 1 атом O (-2).
Формула: FeO (Оксид железа (II)).
8. Соответствующий оксид неметалла:
Это было дано в условии.
Формула: N₂O₅ (Оксид азота(V)).
Соли и соответствующие им гидроксиды и оксиды
| Соль | K₂SO₄ | Fe₂(SO₄)₃ | Na₂SiO₃ | Fe(NO₃)₂ |
|---|---|---|---|---|
| Название соли | Сульфат калия | Сульфат железа (III) | Силикат натрия | Нитрат железа (II) |
| Соответствующее основание | KOH | Fe(OH)₃ | NaOH | Гидроксид железа (II) Fe(OH)₂ |
| Соответствующая кислота | H₂SO₄ | H₂SO₄ | H₂SiO₃ | Азотная кислота HNO₃ |
| Соответствующий оксид металла | K₂O | Fe₂O₃ | Оксид натрия Na₂O | Оксид железа (II) FeO |
| Соответствующий оксид неметалла | SO₃ | SO₃ | Оксид кремния (IV) SiO₂ | Оксид азота(V) N₂O₅ |

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!