
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 105-106 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
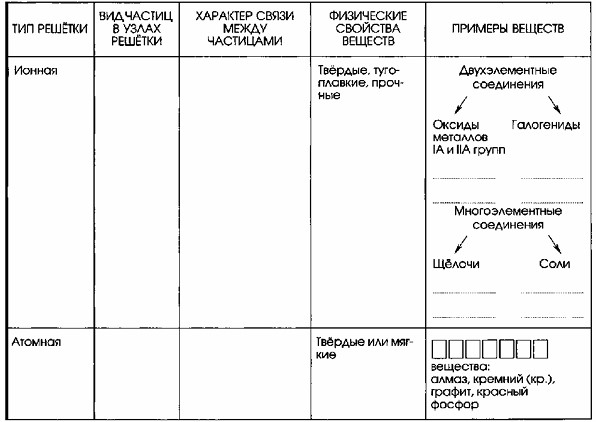
2. Заполните таблицу «Виды химических связей и типы кристаллических решёток».
Вопрос 2
Виды химических связей и типы кристаллических решеток
| Тип решетки | Вид частиц в узлах решетки | Характер связи между частицами | Физические свойства | Примеры веществ |
|---|---|---|---|---|
| Ионная | Катионы и анионы | Ионная | Вещества твердые, тугоплавкие, прочные | Двухэлементные соединения: -Оксиды металлов IA и IIA групп Na2O, BaO -Галогениды NaCl, CaCl₂ Многоэлементные соединения: -Щелочи: NaOH, KOH -Соли: CaCO3, K2SO4 |
| Атомная | Атомы | Ковалентная неполярная | Твердые или мягкие | ПРОСТЫЕ вещества: алмаз, кремний, графит, красный фосфор |
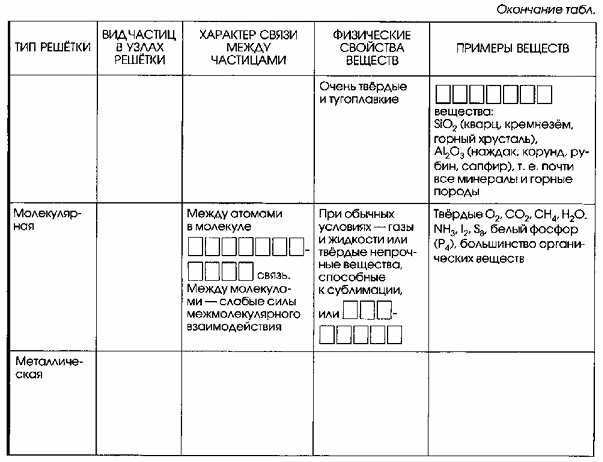
| Ковалентная полярная | Очень твердые и тугоплавкие | СЛОЖНЫЕ вещества: кварц, кремнезем, горный хрусталь, наждак, корунд, рубин, сапфир, т. е. почти все минералы и горные породы | ||
| Молекулярная | Молекулы | Между атомами в молекуле КОВАЛЕНТНАЯ связь. Между молекулами — слабые силы межмолекулярного взаимодействия. | При обычных условиях — газы и жидкости или твердые непрочные вещества, способные к сублимации, или ВОЗГОНКЕ | Твердые O2, CO2, CH4, H2O, NH3, I2, S8, белый фосфор (P4), большинство органических веществ |
| Металлическая | Атомы и положительно заряженные ионы | Металлическая | Твердые (кроме ртути), блестящие, ковкие, электропроводные, теплопроводные, пластичные | Fe, Cu, Al, Na, Hg, Au, Ag |
Вопрос 2
1. Тип решётки: Ионная
Вид частиц в узлах решётки:
Состояние в задании: Пусто.
Заполняем: Катионы и анионы
Подробное объяснение: Ионная кристаллическая решётка образуется за счёт электростатического притяжения между положительно заряженными ионами (катионами) и отрицательно заряженными ионами (анионами). Эти ионы и располагаются в узлах решётки.
Характер связи между частицами:
Состояние в задании: Пусто.
Заполняем: Ионная
Подробное объяснение: Название типа решётки напрямую указывает на характер связи, которая удерживает частицы в ней. Ионная связь образуется между атомами с большой разницей в электроотрицательности (обычно между типичными металлами и неметаллами) путём полной передачи электронов.
Физические свойства веществ:
Состояние в задании: Уже заполнено: «Твёрдые, тугоплавкие, прочные».
Подробное объяснение: Эти свойства обусловлены сильным электростатическим притяжением между ионами, требующим большой энергии для разрушения решётки.
Примеры веществ:
Состояние в задании: Указаны категории («Двухэлементные соединения: Оксиды металлов IA и IIA групп, Галогениды» и «Многоэлементные соединения: Щелочи, Соли»), но конкретные примеры веществ отсутствуют (пустые линии).
Заполняем:
- Под «Оксиды металлов IA и IIA групп»: Na₂O, BaO (Например, оксид натрия, оксид бария – типичные ионные оксиды).
- Под «Галогениды»: NaCl, CaCl₂ (Например, хлорид натрия, хлорид кальция – классические ионные соединения).
- Под «Щелочи»: NaOH, KOH (Например, гидроксид натрия, гидроксид калия – гидроксиды щелочных металлов).
- Под «Соли»: K₂SO₄, CaCO₃ (Например, сульфат калия, карбонат кальция – большинство солей являются ионными соединениями).
Подробное объяснение: Приведенные примеры являются распространёнными веществами, образующими ионные кристаллические решётки.
2. Тип решётки: Атомная (первый подтип — для простых веществ)
Вид частиц в узлах решётки:
Состояние в задании: Пусто.
Заполняем: Атомы
Подробное объяснение: В атомных кристаллических решётках узлы занимают сами атомы, связанные между собой прочными ковалентными связями, образуя единую пространственную структуру.
Характер связи между частицами:
Состояние в задании: Пусто.
Заполняем: Ковалентная неполярная
Подробное объяснение: Для простых веществ (например, алмаз, графит, кремний), состоящих из атомов одного элемента, связь между атомами является ковалентной и неполярной, так как электроотрицательность атомов одинакова.
Физические свойства веществ:
Состояние в задании: Уже заполнено: «Твёрдые или мягкие».
Подробное объяснение: Свойства могут варьироваться (например, алмаз очень твёрдый, графит мягкий), но общая черта – это твёрдое состояние при обычных условиях.
Примеры веществ:
Состояние в задании: Указаны конкретные примеры («алмаз, кремний (кр.), графит, красный фосфор»), но пустое поле с квадратами перед словом «вещества:».
Заполняем: ПРОСТЫЕ вещества: алмаз, кремний (кр.), графит, красный фосфор.
Подробное объяснение: Данные вещества являются простыми (состоят из атомов одного химического элемента) и имеют атомную кристаллическую решётку.
3. Тип решётки: Атомная (второй подтип — для сложных веществ)
Вид частиц в узлах решётки:
Состояние в задании: Пусто.
Заполняем: Атомы
Подробное объяснение: Как и в предыдущем случае, в атомных решётках узлы всегда занимают атомы.
Характер связи между частицами:
Состояние в задании: Пусто.
Заполняем: Ковалентная полярная
Подробное объяснение: Для сложных веществ (например, SiO₂, Al₂O₃), состоящих из атомов разных элементов, связь между атомами является ковалентной и полярной, так как электроотрицательность атомов различна.
Физические свойства веществ:
Состояние в задании: Уже заполнено: «Очень твёрдые и тугоплавкие».
Подробное объяснение: Прочные ковалентные связи по всей структуре обусловливают высокую твёрдость и температуры плавления.
Примеры веществ:
Состояние в задании: Указаны конкретные примеры («SiO₂ (кварц, кремнезём, горный хрусталь), Al₂O₃ (наждак, корунд, рубин, сапфир), т. е. почти все минералы и горные породы»), но пустое поле с квадратами перед словом «вещества:».
Заполняем: СЛОЖНЫЕ вещества: SiO₂ (кварц, кремнезём, горный хрусталь), Al₂O₃ (наждак, корунд, рубин, сапфир), т. е. почти все минералы и горные породы.
Подробное объяснение: Данные вещества являются сложными (состоят из атомов разных химических элементов) и имеют атомную кристаллическую решётку.
4. Тип решётки: Молекулярная
Вид частиц в узлах решётки:
Состояние в задании: Пусто.
Заполняем: Молекулы
Подробное объяснение: Молекулярные кристаллические решётки состоят из отдельных, дискретных молекул, которые располагаются в узлах.
Характер связи между частицами:
Состояние в задании: Частично заполнено: «Между атомами в молекуле [пустые квадраты] связь. Между молекулами — слабые силы межмолекулярного взаимодействия.» Пустое поле с квадратами находится внутри фразы.
Заполняем: Между атомами в молекуле КОВАЛЕНТНАЯ связь. Между молекулами — слабые силы межмолекулярного взаимодействия.
Подробное объяснение: Внутри каждой молекулы атомы связаны прочными ковалентными связями (как полярными, так и неполярными). Однако между самими молекулами действуют значительно более слабые силы межмолекулярного взаимодействия (силы Ван-дер-Ваальса, водородные связи и т.д.), которые и определяют свойства молекулярных веществ.
Физические свойства веществ:
Состояние в задании: Частично заполнено: «При обычных условиях — газы и жидкости или твёрдые непрочные вещества, способные к сублимации, или [пустые квадраты]». Пустое поле с квадратами находится в конце фразы.
Заполняем: При обычных условиях — газы и жидкости или твёрдые непрочные вещества, способные к сублимации, или ВОЗГОНКЕ.
Подробное объяснение: Слабые межмолекулярные силы обусловливают низкие температуры плавления и кипения, поэтому многие молекулярные вещества при обычных условиях являются газами или жидкостями. Твёрдые молекулярные вещества обычно легкоплавкие и могут сублимировать (переходить из твёрдого состояния сразу в газообразное), что также называется возгонкой.
Примеры веществ:
Состояние в задании: Уже заполнено: «Твёрдые O₂, CO₂, CH₄, H₂O, NH₃, I₂, S₈, белый фосфор (P₄), большинство органических веществ».
Подробное объяснение: Все перечисленные вещества состоят из дискретных молекул.
5. Тип решётки: Металлическая
Вид частиц в узлах решётки:
Состояние в задании: Пусто.
Заполняем: Атомы и положительно заряженные ионы
Подробное объяснение: В узлах металлической кристаллической решётки находятся атомы металла и положительно заряженные ионы (катионы), образовавшиеся в результате отдачи валентных электронов. Эти электроны становятся общими и образуют так называемый «электронный газ», свободно перемещающийся по всему кристаллу.
Характер связи между частицами:
Состояние в задании: Пусто.
Заполняем: Металлическая
Подробное объяснение: Название типа решётки напрямую указывает на характер связи. Металлическая связь возникает между атомами металлов за счёт обобществлённых валентных электронов.
Физические свойства веществ:
Состояние в задании: Пусто.
Заполняем: Твёрдые (кроме ртути), блестящие, ковкие, электропроводные, теплопроводные, пластичные
Подробное объяснение: Эти уникальные свойства металлов (металлический блеск, высокая электро- и теплопроводность, ковкость, пластичность) объясняются наличием «электронного газа» и особенностями металлической связи.
Примеры веществ:
Состояние в задании: Пусто.
Заполняем: Fe, Cu, Al, Na, Hg, Au, Ag (Можно привести любые примеры металлов).
Подробное объяснение: Все металлы имеют металлическую кристаллическую решётку.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!