
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 107-109 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
Часть II
1. Поиграйте в «крестики-нолики». Покажите выигрышный путь, который составляют простые вещества с атомной кристаллической решёткой.
| Li | O2 | Te |
| Sn | Si | Ca |
| C | F2 | I2 |
Распределите данные простые вещества по соответствующим столбцам.
| АТОМНАЯ КРИСТАЛЛИЧЕСКАЯ РЕШЁТКА | МОЛЕКУЛЯРНАЯ КРИСТАЛЛИЧЕСКАЯ РЕШЁТКА |
|---|---|
2. Запишите формулу вещества, которое является «лишним» в следующем ряду:
оксид кремния (IV), оксид алюминия, алюминий, графит.
3. Верны ли следующие суждения?
А. Мокрое бельё высыхает на морозе потому, что вещества молекулярного строения способны к сублимации (возгонке).
Б. Мокрое бельё высыхает на морозе потому, что молекулы воды имеют низкую Мr.
1) оба суждения верны
2) верно только А
3) верно только Б
4) оба суждения неверны
4. Верны ли следующие суждения?
А. При обычных условиях хлор — газ, бром — жидкость, иод — твёрдое вещество с металлическим блеском, потому что у них разные кристаллические решётки: у хлора — атомная, у брома — молекулярная, у иода — металлическая.
Б. При обычных условиях хлор — газ, бром — жидкость, иод — твёрдое вещество с металлическим блеском, потому что у них одинаковое молекулярное строение, но разная плотность.
1) оба суждения верны
2) верно только А
3) верно только Б
4) оба суждения неверны
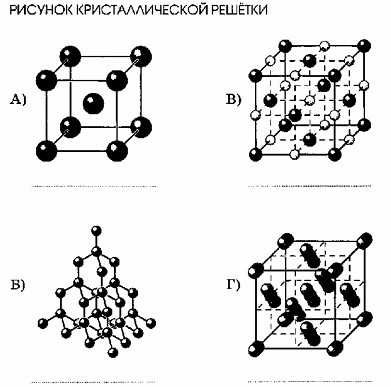
5. Установите соответствие между рисунком кристаллической решётки и названием вещества.
НАЗВАНИЕ ВЕЩЕСТВА
1) фторид лития
2) иод
3) литий
4) красный фосфор
Под каждым рисунком укажите формулу соответствующего вещества.
6. С помощью Интернета и других источников информации (укажите) сделайте презентацию о жизни и научных достижениях Ж. Л. Пруста по следующему плану:
1) детство;
2) учёба в юношеские годы;
3) научная деятельность, основные научные достижения.
Часть II
Вопрос 1
| Li | O2 | Te |
| Sn | Si | Ca |
| C | F2 | I2 |
| АТОМНАЯ КРИСТАЛЛИЧЕСКАЯ РЕШЁТКА | МОЛЕКУЛЯРНАЯ КРИСТАЛЛИЧЕСКАЯ РЕШЁТКА |
|---|---|
| C, Si, Te | O2, F2, I2 |
Вопрос 2
В кристаллической решетке алюминия присутствует металлическая связь, тогда как у остальных веществ из списка наблюдается ковалентная.
Ответ: Алюминий.
Вопрос 3
А. Мокрое белье высыхает на морозе потому, что вещества молекулярного строения способны к сублимации (возгонке). Верно.
Б. Мокрое белье высыхает на морозе потому, что молекулы воды имеют низкую Mr. Верно.
Оба суждения верны.
Ответ: 1.
Вопрос 4
А. При обычных условиях хлор — газ, бром — жидкость, иод — твёрдое вещество с металлическим блеском, потому что у них разные кристаллические решётки: у хлора — атомная, у брома — молекулярная, у иода — металлическая. Неверно, у всех этих веществ молекулярная кристаллическая решётка.
Б. При обычных условиях хлор — газ, бром — жидкость, иод — твёрдое вещество с металлическим блеском, потому что у них одинаковое молекулярное строение, но разная плотность. Верно.
Верно только Б.
Ответ: 3.
Вопрос 5
| А | Б | В | Г |
|---|---|---|---|
| 3 | 4 | 1 | 2 |
| Рисунок | Формула |
|---|---|
| А | Li |
| Б | P |
| В | LiF |
| Г | I₂ |
Вопрос 6
1. Жозеф Луи Пруст появился на свет 26 сентября 1754 года в городе Анже (Франция) в семье аптекаря, что пробудило у него интерес к химии с ранних лет.
2. В юности Пруст отправился в Париж, где обучался у выдающегося химика и аптекаря Г. Ф. Руэля. В 1775 году он получил назначение на должность управляющего аптекой при больнице Сальпетриер. В 1777 году был приглашен занять кафедру химии и металлургии в Королевской семинарии города Вергара (Испания), где работал до 1780 года. После этого Пруст вернулся в Париж и продолжил заниматься научными исследованиями.
3. Наиболее значительным вкладом Пруста в науку стало открытие закона постоянства состава. Согласно этому закону, химически чистое вещество, независимо от способа его получения, состоит из одинаковых химических элементов, причем их массовые соотношения остаются неизменными, а относительные числа атомов выражаются целыми числами. Помимо этого, Пруст занимался изучением сахаров, металлов и разнообразных химических соединений.
5 июля 1826 года Жозеф Луи Пруст ушел из жизни в родном Анже, Франция. В его честь был назван минерал прустит (Ag₃AsS₃).
Часть II
Вопрос 1
Для выполнения этого задания необходимо определить тип кристаллической решётки для каждого простого вещества, представленного в таблице.
Атомная кристаллическая решётка: Характерна для веществ, в узлах решётки которых находятся атомы, связанные между собой прочными ковалентными связями, образуя единое целое (макромолекулу). Такие вещества обычно очень твёрдые и тугоплавкие.
- C (Углерод): В виде алмаза или графита имеет атомную кристаллическую решётку.
- Si (Кремний): Имеет атомную кристаллическую решётку.
- Te (Теллур): Является полуметаллом и образует атомную кристаллическую решётку.
Молекулярная кристаллическая решётка: Характерна для веществ, в узлах решётки которых находятся дискретные молекулы, связанные между собой слабыми межмолекулярными силами (Ван-дер-Ваальса). Такие вещества обычно легкоплавкие, летучие, могут быть газами, жидкостями или мягкими твёрдыми телами при обычных условиях.
- O₂ (Кислород): Существует в виде двухатомных молекул, имеет молекулярную решётку.
- F₂ (Фтор): Существует в виде двухатомных молекул, имеет молекулярную решётку.
- I₂ (Иод): Существует в виде двухатомных молекул, имеет молекулярную решётку.
Металлическая кристаллическая решётка: Характерна для металлов. В узлах решётки находятся атомы и положительно заряженные ионы, а между ними свободно перемещаются обобществлённые электроны.
- Li (Литий): Металл, имеет металлическую решётку.
- Sn (Олово): Металл, имеет металлическую решётку.
- Ca (Кальций): Металл, имеет металлическую решётку.
Выигрышный путь, состоящий из простых веществ с атомной кристаллической решёткой, образует диагональ: C, Si, Te.
АТОМНАЯ КРИСТАЛЛИЧЕСКАЯ РЕШЁТКА: C, Si, Te
МОЛЕКУЛЯРНАЯ КРИСТАЛЛИЧЕСКАЯ РЕШЁТКА: O₂, F₂, I₂
Вопрос 2
Для определения «лишнего» вещества необходимо проанализировать тип кристаллической решётки каждого из них.
- Оксид кремния (IV) (SiO₂): Известен как кварц, кремнезём. Имеет атомную кристаллическую решётку (ковалентный каркас).
- Оксид алюминия (Al₂O₃): Известен как корунд, наждак. Имеет атомную кристаллическую решётку (ковалентный каркас, хотя и с существенной долей ионности).
- Алюминий (Al): Является металлом. Имеет металлическую кристаллическую решётку.
- Графит (C): Одна из аллотропных модификаций углерода. Имеет атомную кристаллическую решётку (слоистый ковалентный каркас).
Вывод:
Три из четырёх веществ (оксид кремния (IV), оксид алюминия, графит) имеют атомную кристаллическую решётку. Алюминий является металлом и имеет металлическую кристаллическую решётку.
Ответ: Алюминий.
Вопрос 3
Проанализируем каждое суждение.
А. «Мокрое бельё высыхает на морозе потому, что вещества молекулярного строения способны к сублимации (возгонке).»
Вода (H₂O) является веществом молекулярного строения. При замерзании на морозе вода превращается в лёд. Лёд, как и другие молекулярные твёрдые тела, способен переходить непосредственно из твёрдого состояния в газообразное, минуя жидкое, что называется сублимацией или возгонкой. Именно этот процесс объясняет высыхание белья на морозе.
Суждение А верно.
Б. «Мокрое бельё высыхает на морозе потому, что молекулы воды имеют низкую Mr.»
Относительная молекулярная масса воды (Mr(H₂O)) равна 18. Это действительно низкое значение по сравнению со многими другими веществами. Низкая Mr обычно коррелирует с относительно слабыми межмолекулярными силами (хотя для воды водородные связи достаточно сильны по сравнению с другими веществами с аналогичной Mr). Слабые межмолекулярные силы облегчают переход вещества из твёрдого состояния в газообразное (сублимацию). Таким образом, низкая Mr является фактором, способствующим способности воды к сублимации при низких температурах.
Суждение Б верно.
Вывод: Оба суждения верны.
Ответ: 1) оба суждения верны.
Вопрос 4
Проанализируем каждое суждение.
А. «При обычных условиях хлор – газ, бром – жидкость, иод – твёрдое вещество с металлическим блеском, потому что у них разные кристаллические решётки: у хлора – атомная, у брома – молекулярная, у иода – металлическая.»
Состояния агрегации и блеск: Действительно, при обычных условиях Cl₂ – газ, Br₂ – жидкость, I₂ – твёрдое вещество с металлическим блеском. Эта часть суждения верна.
Типы кристаллических решёток:
Хлор (Cl₂): Существует в виде дискретных двухатомных молекул. Имеет молекулярную кристаллическую решётку. Утверждение «атомная» – неверно.
Бром (Br₂): Существует в виде дискретных двухатомных молекул. Имеет молекулярную кристаллическую решётку. Утверждение «молекулярная» – верно.
Иод (I₂): Существует в виде дискретных двухатомных молекул. Имеет молекулярную кристаллическую решётку. Утверждение «металлическая» – неверно.
Общий вывод по суждению А: Поскольку объяснение причин (разные типы решёток) содержит неверные утверждения о типах решёток для хлора и иода, суждение А в целом неверно. Все галогены (Cl₂, Br₂, I₂) в элементарном состоянии имеют молекулярную кристаллическую решётку. Различия в их агрегатном состоянии обусловлены увеличением силы межмолекулярных (ван-дер-ваальсовых) взаимодействий с ростом размера и массы молекул.
Б. «При обычных условиях хлор – газ, бром – жидкость, иод – твёрдое вещество с металлическим блеском, потому что у них одинаковое молекулярное строение, но разная плотность.»
Состояния агрегации и блеск: Эта часть суждения верна, как и в А.
Причина: «одинаковое молекулярное строение» (все существуют в виде двухатомных молекул, X₂). Это верно. «но разная плотность» – плотность действительно увеличивается от хлора к иоду. Увеличение плотности и изменение агрегатного состояния связаны с усилением межмолекулярных сил (дисперсионных взаимодействий) по мере увеличения размера и числа электронов в молекуле, что приводит к повышению температур плавления и кипению. Это объяснение более корректно отражает причину наблюдаемых различий.
Общий вывод по суждению Б: Суждение Б верно.
Вывод: Верно только суждение Б.
Ответ: 3) верно только Б.
Вопрос 5
Для выполнения этого задания необходимо соотнести изображения кристаллических решёток с их химическими типами и соответствующими веществами.
Типы кристаллических решёток и их характерные изображения:
Металлическая решётка: В узлах находятся атомы одного типа, расположенные в плотной упаковке. Изображаются одинаковыми сферами. Характеризуются высокой электро- и теплопроводностью, пластичностью.
Ионная решётка: В узлах чередуются положительные и отрицательные ионы, расположенные в строгом порядке. Изображаются сферами разных размеров и/или цветов. Характеризуются высокой твёрдостью, тугоплавкостью, хрупкостью.
Атомная решётка: В узлах находятся атомы, связанные между собой прочными ковалентными связями, образуя единую трёхмерную сеть (макромолекулу). Характеризуются очень высокой твёрдостью и тугоплавкостью.
Молекулярная решётка: В узлах находятся дискретные молекулы, связанные между собой слабыми межмолекулярными силами. Характеризуются низкой твёрдостью, легкоплавкостью, летучестью.
Анализ веществ:
1) Фторид лития (LiF): Это ионное соединение (образовано щелочным металлом Li и галогеном F). Имеет ионную кристаллическую решётку.
2) Иод (I₂): Это простое вещество, состоящее из двухатомных молекул. Имеет молекулярную кристаллическую решётку.
3) Литий (Li): Это щелочной металл. Имеет металлическую кристаллическую решётку.
4) Красный фосфор (P): Это аллотропная модификация фосфора. Имеет атомную кристаллическую решётку (сложную полимерную структуру).
Соотнесение рисунков с веществами:
A) Рисунок: Изображена простая кубическая упаковка одинаковых сфер. Это характерное изображение металлической кристаллической решётки.
Соответствие: 3) Литий (Li). Это соответствие логично и типично.
Б) Рисунок: Изображена сложная, разветвлённая трёхмерная сеть из атомов, соединённых множеством связей. Это типичное изображение атомной кристаллической решётки (например, алмаза или других сложных полимерных структур).
Соответствие: 4) Красный фосфор (P). Это соответствие логично, так как красный фосфор имеет полимерную атомную кристаллическую решётку.
В) Рисунок: Изображена кубическая решётка с чередующимися сферами двух разных типов (чёрные и белые). Это классическое изображение ионной кристаллической решётки (например, типа NaCl).
Соответствие: 1) Фторид лития (LiF). Это соответствие логично, так как LiF является ионным соединением и имеет ионную кристаллическую решётку.
Г) Рисунок: Изображена решётка, состоящая из дискретных единиц, каждая из которых представляет собой пару соединённых атомов (две маленькие сферы). Эти пары затем упакованы в общую решётку. Это характерно для молекулярной кристаллической решётки, где узлы занимают двухатомные молекулы.
Соответствие: 2) Иод (I₂). Это соответствие логично и типично, так как иод существует в виде молекул I₂.
Вопрос 6
Данное задание требует углублённого и детализированного изложения биографии и научных заслуг выдающегося французского химика Жозефа Луи Пруста.
1. Детство:
Жозеф Луи Пруст появился на свет 26 сентября 1754 года в городе Анже, расположенном в западной части Франции. Его отец был аптекарем, что в XVIII веке означало не просто продавца лекарств, а скорее химика-практика, который самостоятельно готовил большинство препаратов. Аптеки того времени часто служили небольшими химическими лабораториями, где проводились эксперименты по извлечению веществ из растений, минералов, а также синтезу простых соединений. Такое домашнее окружение, наполненное запахами химикатов, процессами дистилляции, растворения и кристаллизации, несомненно, пробудило в юном Жозефе ранний и глубокий интерес к химии. Он мог наблюдать за работой отца, помогать ему, а возможно, и проводить свои первые опыты, что заложило прочный фундамент для его будущей научной карьеры. Это раннее знакомство с практической химией отличало его от многих теоретиков того времени и способствовало развитию его экспериментальных навыков.
2. Учёба в юношеские годы:
В юношеском возрасте, стремясь получить более систематическое и глубокое химическое образование, Пруст отправился в Париж – центр научной мысли того времени. Там он обучался под руководством выдающегося химика и аптекаря Гийома Франсуа Руэля (Guillaume François Rouelle). Руэль был одним из самых влиятельных химиков своего поколения, известным своими новаторскими лекциями в Jardin du Roi (Королевском саду), которые привлекали множество студентов, включая таких будущих светил, как Антуан Лавуазье и братья Фаусто и Хуан Хосе де Элуяр (первооткрыватели вольфрама). Обучение у Руэля означало получение передового для того времени химического образования, основанного на экспериментальном подходе.
В 1775 году, демонстрируя высокий уровень знаний и практических навыков, Пруст получил престижное назначение на должность управляющего аптекой при знаменитой больнице Сальпетриер в Париже. Эта позиция не только обеспечивала его средствами к существованию, но и предоставляла доступ к обширным ресурсам и возможность проводить собственные химические исследования в условиях, приближенных к лабораторным.
Уже в 1777 году, всего через два года после назначения в Сальпетриер, Пруст получил приглашение занять кафедру химии и металлургии в Королевской семинарии города Вергара (Испания). Это приглашение было свидетельством его быстро растущей репутации и признания его таланта на международном уровне. Семинария в Вергаре была одним из передовых научных центров в Европе, особенно в области минералогии и металлургии, где, кстати, и был открыт вольфрам. Работа в Испании до 1780 года дала Прусту ценный опыт преподавания и дальнейшего развития своих исследовательских интересов, особенно в области анализа минералов и руд. После возвращения в Париж, он продолжил активно заниматься научными исследованиями, постепенно сосредотачиваясь на вопросах состава химических соединений.
3. Научная деятельность, основные научные достижения:
Наиболее значительным и фундаментальным вкладом Жозефа Луи Пруста в химию стало открытие и формулирование Закона постоянства состава, также известного как Закон определённых пропорций. Этот закон гласит, что *любое химически чистое вещество, независимо от способа его получения или его источника, всегда имеет один и тот же качественный и количественный состав*. То есть, оно состоит из одних и тех же химических элементов, причём их массовые соотношения остаются неизменными, а относительные числа атомов, входящих в состав молекулы или формульной единицы, выражаются целыми числами.
Открытие этого закона не было простым. В конце XVIII века в химии существовала острая дискуссия между Прустом и другим видным французским химиком, Клодом Луи Бертолле. Бертолле придерживался мнения, что состав химических соединений может варьироваться в определённых пределах. Пруст, напротив, путём тщательных и многократных экспериментов, в частности, изучая различные оксиды меди и железа, а также сульфиды, показал, что состав этих соединений всегда строго фиксирован. Например, он демонстрировал, что независимо от того, как был получен оксид меди (II) (CuO) – будь то путём нагревания меди на воздухе, разложения карбоната меди или восстановления оксида меди (I) – соотношение массы меди к массе кислорода в нём всегда оставалось постоянным. Эта строгая экспериментальная точность и настойчивость в доказательствах позволили Прусту убедительно опровергнуть точку зрения Бертолле.
Значение Закона постоянства состава для развития химии трудно переоценить. Он стал одним из краеугольных камней количественной химии и послужил важнейшей эмпирической основой для создания Джоном Дальтоном его атомной теории в начале XIX века. Дальтон использовал закон Пруста как одно из ключевых положений, объясняющих, почему атомы соединяются в определённых, фиксированных соотношениях. Этот закон позволил химикам перейти от качественного описания веществ к строгому количественному анализу и прогнозированию химических реакций.
Помимо своего главного открытия, Пруст активно занимался изучением различных классов веществ. Он проводил значительные исследования сахаров, внося вклад в понимание их химической природы. Например, он был одним из первых, кто выделил и охарактеризовал глюкозу (виноградный сахар) из винограда, а также изучал другие виды сахаров, отличая их друг от друга. Он также глубоко исследовал металлы и разнообразные химические соединения, включая их оксиды и сульфиды, что постоянно подкрепляло его убеждение в постоянстве состава. Его работы были отмечены тщательностью и точностью, что сделало его одним из пионеров аналитической химии.
Жозеф Луи Пруст скончался 5 июля 1826 года в своём родном городе Анже, Франция. В знак признания его выдающихся заслуг перед наукой, в его честь был назван минерал прустит (Ag₃AsS₃) – сульфосоль серебра и мышьяка. Это посмертное увековечивание его имени в минералогии подчёркивает значимость его вклада в химию и, в частности, его работы по составу различных соединений, включая те, что встречаются в природе.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!