
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 131-133 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
4. Что показывает химическое уравнение?
1) Какие вещества ____________ в реакцию.
2) Какие вещества ____________ в результате.
3) Количественные отношения веществ в реакции, т. е. количества ____________ и ____________ веществ в реакции.
4) Тип химической реакции.
5. Правила расстановки коэффициентов в схеме химической реакции на примере взаимодействия гидроксида бария и фосфорной кислоты с образованием фосфата бария и воды.
а) Запишите схему реакции, т. е. формулы реагирующих и образующихся веществ:
б) начинайте уравнивать схему реакции с формулы соли (если она имеется). При этом помните, что несколько сложных ионов в составе основания или соли обозначаются скобками, а их число — индексами за скобками:
в) водород уравняйте в предпоследнюю очередь:
г) кислород уравняйте последним — это индикатор верной расстановки коэффициентов.
Перед формулой простого вещества возможна запись дробного коэффициента, после чего уравнение необходимо переписать с удвоенными коэффициентами.
Например:
C6H6 + ___ O2 = ___ CO2 + __ H2O (x 2)
___ C2H6 + ___ O2 — ___ CO2 + ___ H2O
Часть II
1. Составьте уравнения реакций, схемы которых:
1) Ca(OH)2 + __ HBr -> CaBr2 + __ H2O
2) H3PO4 + __ NaOH -> Na3PO4 + __ H2O
3) Na2CO3 + __ HCl -> __ NaCl + CO2 + H2O
4) Fe2(SO4)3 + __ BaCl2 -> __ BaSO4 + __ FeCl3
2. Напишите уравнения химических реакций:
1) между серной кислотой и гидроксидом калия с образованием сульфата калия и воды
2) разложения иодида серебра на свету на серебро и иод
3) между магнием и соляной кислотой с образованием водорода и хлорида магния
4) между натрием и водой с образованием гидроксида натрия и водорода
3. Установите соответствие между схемой и суммой коэффициентов в химической реакции.
СХЕМА ХИМИЧЕСКОЙ РЕАКЦИИ
A) Ca + __ HCl → CaCl2 + H2
Б) SO3 + H2O → H2SO4
В) __ Li + __ N2 → __ Li3N
Г) __ CO + O2 → CO2
СУММА КОЭФФИЦИЕНТОВ В УРАВНЕНИИ РЕАКЦИИ
1) 5
2) 3
3) 9
4) 0
5) 2
Ответ.
| А | Б | В | Г |
|---|---|---|---|
4. Установите соответствие между исходными веществами и продуктами реакции.
ИСХОДНЫЕ ВЕЩЕСТВА
А) фосфорная кислота и гидроксид калия
Б) нитрат бария
В) оксид азота (V) и вода
Г) оксид кальция и углекислый газ
ПРОДУКТЫ РЕАКЦИИ
1) сульфат бария и нитрат калия
2) карбонат кальция
3) азотная кислота
4) фосфат калия и вода
Ответ.
| A | Б | В | Г |
|---|---|---|---|
Запишите уравнения соответствующих химических реакций:
5. Что показывает уравнение следующей химической реакции:
Cu(OH)2 + 2HCl = CuCl2 + H2O?
Вопрос 4
Химическое уравнение показывает:
1) Какие вещества ВСТУПАЮТ в реакцию
2) Какие вещества ОБРАЗУЮТСЯ в результате
3) Количественные отношения веществ в реакции, т. е. количества РЕАГИРУЮЩИХ и ОБРАЗУЮЩИХСЯ веществ в реакции.
4) Тип химической реакции.
Вопрос 5
А) Схема реакции, т.е. формулы реагирующих и образующихся веществ:
\(Ba(OH)_2 + H_3PO_4 \to Ba_3(PO_4)_2 + H_2O\)
Б) Начинают уравнивать схему реакции с формулы соли:
\(3Ba(OH)_2 + 2H_3PO_4 \to Ba_3(PO_4)_2 + H_2O\)
В) Водород уравнивают в предпоследнюю очередь:
\(3Ba(OH)_2 + 2H_3PO_4 \to Ba_3(PO_4)_2 + 6H_2O\)
Г) Перед формулой простого вещества возможна запись дробного коэффициента, после чего уравнение необходимо переписать с удвоенными коэффициентами.
Например:
\(C_6H_6 + 7.5O_2 \to 6CO_2 + 3H_2O (x2)\)
\(2C_6H_6 + 15O_2 \to 12CO_2 + 6H_2O\)
\(C_6H_6 + 3.5O_2 \to 2CO_2 + 3H_2O (x2)\)
\(2C_6H_6 + 7O_2 \to 4CO_2 + 6H_2O\)
Часть II
Вопрос 1
1. Ca(OH)₂ + 2HBr → CaBr₂ + 2H₂O
2. H₃PO₄ + 3NaOH → Na₃PO₄ + 3H₂O
3. Na₂CO₃ + 2HCl → 2NaCl + CO₂↑ + H₂O
4. Fe₂(SO₄)₃ + 3BaCl₂ → 3BaSO₄↓ + 2FeCl₃
Вопрос 2
1. H₂SO₄ + 2KOH → K₂SO₄ + 2H₂O
2. 2AgI → 2Ag + I₂
3. Mg + 2HCl → MgCl₂ + H₂↑
4. 2Na + 2H₂O → 2NaOH + H₂↑
Вопрос 3
A) Ca + 2 HCl → CaCl₂ + H₂
1+2+1+1=5
Б) SO₂ + H₂O → H₂SO₄
1+1+1=3
В) 6 Li + N₂ → 2 Li₃N
6+1+2=9
Г) 2 CO + O₂ → 2 CO₂
2+1+2=5
| А | Б | В | Г |
|---|---|---|---|
| 1 | 2 | 3 | 1 |
Вопрос 4
| А | Б | В | Г |
|---|---|---|---|
| 4 | 1 | 3 | 2 |
А) H₃PO₄ + 3KOH → K₃PO₄ + 3H₂O
Б) Ba(NO₃)₂ + K₂SO₄ → BaSO₄↓ + 2KNO₃
В) N₂O₅ + H₂O → 2HNO₃
Г) CaO + CO₂ → CaCO₃
Вопрос 5
1. В результате химической реакции взаимодействовали гидроксид меди (II) и соляная кислота.
2. В ходе реакции были получены хлорид меди (II) и вода.
3. Одна молекула гидроксида меди (II) вступает в реакцию с двумя молекулами соляной кислоты, в результате чего образуются одна молекула хлорида меди (II) и одна молекула воды.
Вопрос 4
Химическое уравнение — это символическая запись химической реакции, которая показывает, какие вещества реагируют и какие образуются, а также в каких количественных соотношениях. Оно является фундаментальным инструментом в химии.
1. Какие вещества ВСТУПАЮТ в реакцию.
Левая часть химического уравнения всегда содержит формулы исходных веществ, или реагентов. Например, в реакции H₂ + O₂ → H₂O, водород (H₂) и кислород (O₂) являются реагентами. Уравнение четко указывает на их химический состав. Это позволяет химику знать, что именно нужно взять для проведения реакции.
2. Какие вещества ОБРАЗУЮТСЯ в результате.
Правая часть химического уравнения содержит формулы продуктов реакции. В том же примере H₂ + O₂ → H₂O, вода (H₂O) является продуктом. Это критически важно, так как химик должен знать, что получится в результате взаимодействия, чтобы, например, выделить нужный продукт или предсказать свойства полученной смеси.
3. Количественные отношения веществ в реакции, т.е. количества РЕАГИРУЮЩИХ и ОБРАЗУЮЩИХСЯ веществ в реакции.
Коэффициенты (большие числа перед формулами веществ) в сбалансированном химическом уравнении показывают молярные или молекулярные соотношения между реагентами и продуктами. Например, в уравнении 2H₂ + O₂ → 2H₂O, коэффициенты 2, 1 (подразумевается) и 2 означают, что 2 молекулы водорода реагируют с 1 молекулой кислорода, образуя 2 молекулы воды. Или, что 2 моля водорода реагируют с 1 молем кислорода, образуя 2 моля воды. Это позволяет проводить стехиометрические расчеты — например, сколько граммов одного вещества потребуется для реакции с определенным количеством другого, или сколько продукта можно получить. Это основа для количественного анализа и синтеза в химии.
4. Тип химической реакции.
Хотя уравнение напрямую не называет тип реакции, его форма и состав реагентов/продуктов часто позволяют определить тип реакции (например, соединение, разложение, замещение, обмен, горение, нейтрализация и т.д.). Например, если из двух простых веществ образуется одно сложное (A + B → AB), это реакция соединения. Если кислота реагирует с основанием, образуя соль и воду (HA + BOH → BA + H₂O), это реакция нейтрализации. Понимание типа реакции помогает предсказать её свойства и условия протекания.
Вопрос 5
Расстановка коэффициентов (балансировка уравнения) основана на законе сохранения массы, который гласит, что атомы не создаются и не исчезают в ходе химической реакции; они лишь перегруппировываются. Поэтому количество атомов каждого элемента должно быть одинаковым в обеих частях уравнения (до и после стрелки).
а) Запишите схему реакции, т.е. формулы реагирующих и образующихся веществ:
- Гидроксид бария: Барий (Ba) имеет валентность II, гидроксидная группа (OH) имеет валентность I. Чтобы сумма валентностей была равна нулю, нужна одна Ba и две OH группы. Формула: Ba(OH)₂.
- Фосфорная кислота: Водород (H) имеет валентность I, фосфатный остаток (PO₄) имеет валентность III. Для уравнивания валентностей нужны три H и одна PO₄ группа. Формула: H₃PO₄.
- Фосфат бария: Барий (Ba) имеет валентность II, фосфатный остаток (PO₄) имеет валентность III. Наименьшее общее кратное для 2 и 3 равно 6. Значит, нужно 3 атома Ba (3 * II = 6) и 2 фосфатных остатка (2 * III = 6). Формула: Ba₃(PO₄)₂.
- Вода: Продукт реакции нейтрализации. Формула: H₂O.
Итак, исходная схема реакции:
Ba(OH)₂ + H₃PO₄ → Ba₃(PO₄)₂ + H₂O
б) Начинайте уравнивать схему реакции с формулы соли (если она имеется). При этом помните, что несколько сложных ионов в составе основания или соли обозначаются скобками, а их число — индексами за скобками.
Принцип: Часто начинают уравнивать с самого сложного вещества в уравнении, особенно если это соль или оксид, содержащий много разных атомов. В данном случае это Ba₃(PO₄)₂.
Шаг 1: Уравняем атомы бария (Ba).
В продуктах (справа) у нас 3 атома Ba (в Ba₃(PO₄)₂).
В реагентах (слева) у нас 1 атом Ba (в Ba(OH)₂).
Чтобы уравнять, поставим коэффициент 3 перед Ba(OH)₂:
3Ba(OH)₂ + H₃PO₄ → Ba₃(PO₄)₂ + H₂O
Шаг 2: Уравняем фосфатные группы (PO₄).
В продуктах (справа) у нас 2 фосфатные группы (в Ba₃(PO₄)₂).
В реагентах (слева) у нас 1 фосфатная группа (в H₃PO₄).
Чтобы уравнять, поставим коэффициент 2 перед H₃PO₄:
3Ba(OH)₂ + 2H₃PO₄ → Ba₃(PO₄)₂ + H₂O
в) Водород уравняйте в предпоследнюю очередь.
Принцип: Водород и кислород часто уравнивают в конце, потому что они часто присутствуют в нескольких соединениях (например, в воде, кислотах, основаниях), и их балансировка может быть сложной, если начинать с них.
Шаг 3: Уравняем атомы водорода (H).
Подсчитаем количество атомов H в левой части уравнения:
В 3Ba(OH)₂: 3 * (2 атома H в OH группе) = 6 атомов H.
В 2H₃PO₄: 2 * (3 атома H) = 6 атомов H.
Всего слева: 6 + 6 = 12 атомов H.
Подсчитаем количество атомов H в правой части уравнения:
В Ba₃(PO₄)₂: 0 атомов H.
В H₂O: 2 атома H.
Чтобы получить 12 атомов H справа, нам нужно 12 / 2 = 6 молекул H₂O.
Поставим коэффициент 6 перед H₂O:
3Ba(OH)₂ + 2H₃PO₄ → Ba₃(PO₄)₂ + 6H₂O
г) Кислород уравняйте последним — это индикатор верной расстановки коэффициентов.
Принцип: Кислород (как и водород) часто участвует во многих соединениях. Если баланс по всем остальным атомам достигнут, то баланс по кислороду должен получиться автоматически, и это служит проверкой правильности всей расстановки коэффициентов.
Шаг 4: Проверим баланс атомов кислорода (O).
Подсчитаем количество атомов O в левой части уравнения:
В 3Ba(OH)₂: 3 * (2 атома O в OH группе) = 6 атомов O.
В 2H₃PO₄: 2 * (4 атома O) = 8 атомов O.
Всего слева: 6 + 8 = 14 атомов O.
Подсчитаем количество атомов O в правой части уравнения:
В Ba₃(PO₄)₂: 2 * (4 атома O в PO₄ группе) = 8 атомов O.
В 6H₂O: 6 * (1 атом O) = 6 атомов O.
Всего справа: 8 + 6 = 14 атомов O.
Количество атомов кислорода одинаково с обеих сторон (14 = 14), что подтверждает, что уравнение сбалансировано правильно.
Окончательное уравнение:
3Ba(OH)₂ + 2H₃PO₄ → Ba₃(PO₄)₂ + 6H₂O
Пример (из задания: горение углеводородов)
Перед формулой простого вещества возможна запись дробного коэффициента, после чего уравнение необходимо переписать с удвоенными коэффициентами.
Иногда, при балансировке кислорода (особенно в реакциях горения органических веществ), может получиться нечетное число атомов кислорода, требующее дробного коэффициента (например, 7.5 или 3.5) перед O₂. Химические уравнения всегда должны содержать только целые числа в качестве коэффициентов, так как они представляют собой соотношения целых молекул. В таких случаях, чтобы избавиться от дроби, все коэффициенты в уравнении умножают на наименьшее целое число, которое сделает дробный коэффициент целым (обычно это 2).
1. C₆H₆ + O₂ → CO₂ + H₂O (Горение бензола)
Шаг 1: Баланс углерода (C).
Слева: 6 атомов C. Справа: 1 атом C в CO₂.
Ставим коэффициент 6 перед CO₂:
C₆H₆ + O₂ → 6CO₂ + H₂O
Шаг 2: Баланс водорода (H).
Слева: 6 атомов H. Справа: 2 атома H в H₂O.
Ставим коэффициент 3 перед H₂O (3 * 2 = 6):
C₆H₆ + O₂ → 6CO₂ + 3H₂O
Шаг 3: Баланс кислорода (O).
Справа: (6 * 2 атома O из CO₂) + (3 * 1 атом O из H₂O) = 12 + 3 = 15 атомов O.
Слева: 2 атома O в O₂.
Чтобы получить 15 атомов O из O₂, нам нужно 15 / 2 = 7.5 молекул O₂.
C₆H₆ + 7.5O₂ → 6CO₂ + 3H₂O
Шаг 4: Устранение дробного коэффициента.
Умножаем все коэффициенты на 2:
(1 * 2)C₆H₆ + (7.5 * 2)O₂ → (6 * 2)CO₂ + (3 * 2)H₂O
Окончательное уравнение: 2C₆H₆ + 15O₂ → 12CO₂ + 6H₂O
2. C₂H₆ + O₂ → CO₂ + H₂O (Горение этана)
Шаг 1: Баланс углерода (C).
Слева: 2 атома C. Справа: 1 атом C в CO₂.
Ставим коэффициент 2 перед CO₂:
C₂H₆ + O₂ → 2CO₂ + H₂O
Шаг 2: Баланс водорода (H).
Слева: 6 атомов H. Справа: 2 атома H в H₂O.
Ставим коэффициент 3 перед H₂O (3 * 2 = 6):
C₂H₆ + O₂ → 2CO₂ + 3H₂O
Шаг 3: Баланс кислорода (O).
Справа: (2 * 2 атома O из CO₂) + (3 * 1 атом O из H₂O) = 4 + 3 = 7 атомов O.
Слева: 2 атома O в O₂.
Чтобы получить 7 атомов O из O₂, нам нужно 7 / 2 = 3.5 молекул O₂.
C₂H₆ + 3.5O₂ → 2CO₂ + 3H₂O
Шаг 4: Устранение дробного коэффициента.
Умножаем все коэффициенты на 2:
(1 * 2)C₂H₆ + (3.5 * 2)O₂ → (2 * 2)CO₂ + (3 * 2)H₂O
Окончательное уравнение: 2C₂H₆ + 7O₂ → 4CO₂ + 6H₂O
Часть II
Вопрос 1
1. Ca(OH)₂ + HBr → CaBr₂ + H₂O
Тип реакции: Реакция нейтрализации (обмена) между основанием (гидроксид кальция) и кислотой (бромоводородная кислота).
Балансировка:
Ca: 1 слева, 1 справа (уже сбалансировано).
Br: 1 слева (в HBr), 2 справа (в CaBr₂). Ставим 2 перед HBr.
Ca(OH)₂ + 2HBr → CaBr₂ + H₂O
H: Слева (2 из Ca(OH)₂ + 2 из 2HBr) = 4 атома H. Справа (2 из H₂O). Ставим 2 перед H₂O.
Ca(OH)₂ + 2HBr → CaBr₂ + 2H₂O
O: Слева (2 из Ca(OH)₂). Справа (2 из 2H₂O). Кислород сбалансирован.
Итоговое уравнение: Ca(OH)₂ + 2HBr → CaBr₂ + 2H₂O
2. H₃PO₄ + NaOH → Na₃PO₄ + H₂O
Тип реакции: Реакция нейтрализации (обмена) между кислотой (фосфорная кислота) и основанием (гидроксид натрия).
Балансировка:
Na: 1 слева (в NaOH), 3 справа (в Na₃PO₄). Ставим 3 перед NaOH.
H₃PO₄ + 3NaOH → Na₃PO₄ + H₂O
PO₄: 1 слева, 1 справа (уже сбалансировано).
H: Слева (3 из H₃PO₄ + 3 из 3NaOH) = 6 атомов H. Справа (2 из H₂O). Ставим 3 перед H₂O.
H₃PO₄ + 3NaOH → Na₃PO₄ + 3H₂O
O: Слева (4 из H₃PO₄ + 3 из 3NaOH) = 7 атомов O. Справа (4 из Na₃PO₄ + 3 из 3H₂O) = 7 атомов O. Кислород сбалансирован.
Итоговое уравнение: H₃PO₄ + 3NaOH → Na₃PO₄ + 3H₂O
3. Na₂CO₃ + HCl → NaCl + CO₂ + H₂O
Тип реакции: Реакция обмена между солью (карбонат натрия) и кислотой (соляная кислота) с образованием соли, углекислого газа (газ) и воды. Это реакция, при которой образуется неустойчивая угольная кислота (H₂CO₃), которая сразу разлагается на CO₂ и H₂O.
Балансировка:
Na: 2 слева (в Na₂CO₃), 1 справа (в NaCl). Ставим 2 перед NaCl.
Na₂CO₃ + HCl → 2NaCl + CO₂ + H₂O
Cl: 1 слева (в HCl), 2 справа (в 2NaCl). Ставим 2 перед HCl.
Na₂CO₃ + 2HCl → 2NaCl + CO₂ + H₂O
C: 1 слева, 1 справа (уже сбалансировано).
H: Слева (2 из 2HCl). Справа (2 из H₂O). Водород сбалансирован.
O: Слева (3 из Na₂CO₃). Справа (2 из CO₂ + 1 из H₂O) = 3 атома O. Кислород сбалансирован.
Итоговое уравнение: Na₂CO₃ + 2HCl → 2NaCl + CO₂↑ + H₂O (Стрелка ↑ указывает на выделение газа)
4. Fe₂(SO₄)₃ + BaCl₂ → BaSO₄ + FeCl₃
Тип реакции: Реакция обмена между двумя солями. Образуется нерастворимый сульфат бария (осадок).
Балансировка:
Fe: 2 слева (в Fe₂(SO₄)₃), 1 справа (в FeCl₃). Ставим 2 перед FeCl₃.
Fe₂(SO₄)₃ + BaCl₂ → BaSO₄ + 2FeCl₃
SO₄: 3 слева (в Fe₂(SO₄)₃), 1 справа (в BaSO₄). Ставим 3 перед BaSO₄.
Fe₂(SO₄)₃ + BaCl₂ → 3BaSO₄ + 2FeCl₃
Ba: 1 слева (в BaCl₂), 3 справа (в 3BaSO₄). Ставим 3 перед BaCl₂.
Fe₂(SO₄)₃ + 3BaCl₂ → 3BaSO₄ + 2FeCl₃
Cl: Слева (3 * 2 = 6 из 3BaCl₂). Справа (2 * 3 = 6 из 2FeCl₃). Хлор сбалансирован.
Все элементы сбалансированы.
Итоговое уравнение: Fe₂(SO₄)₃ + 3BaCl₂ → 3BaSO₄↓ + 2FeCl₃ (Стрелка ↓ указывает на образование осадка)
Вопрос 2
Это задание требует составления химических уравнений на основе словесного описания реакции, а затем их балансировки.
1) между серной кислотой и гидроксидом калия с образованием сульфата калия и воды
Определение реагентов и продуктов:
- Серная кислота: H₂SO₄
- Гидроксид калия: KOH (Калий K имеет валентность I, гидроксидная группа OH имеет валентность I)
- Сульфат калия: K₂SO₄ (Калий K имеет валентность I, сульфат-ион SO₄ имеет валентность II. Для уравнивания валентностей требуются два атома калия)
- Вода: H₂O
Запись схемы реакции:
H₂SO₄ + KOH → K₂SO₄ + H₂O
Балансировка уравнения:
1. Калий (K): В продуктах, в K₂SO₄, содержится 2 атома калия, тогда как в реагентах, в KOH, только 1 атом. Для уравнивания, поставим коэффициент 2 перед KOH:
H₂SO₄ + 2KOH → K₂SO₄ + H₂O
2. Сульфатные группы (SO₄): Количество сульфатных групп с обеих сторон уравнения уже одинаково (по одной).
3. Водород (H): Подсчитаем атомы водорода в реагентах: 2 атома из H₂SO₄ и (2 * 1) = 2 атома из 2KOH. Всего 2 + 2 = 4 атома водорода. В продуктах, в H₂O, содержится 2 атома водорода. Чтобы получить 4 атома водорода в продуктах, поставим коэффициент 2 перед H₂O:
H₂SO₄ + 2KOH → K₂SO₄ + 2H₂O
4. Кислород (O): Проверим баланс атомов кислорода. В реагентах: 4 атома из H₂SO₄ и (2 * 1) = 2 атома из 2KOH. Всего 4 + 2 = 6 атомов кислорода. В продуктах: 4 атома из K₂SO₄ и (2 * 1) = 2 атома из 2H₂O. Всего 4 + 2 = 6 атомов кислорода. Баланс кислорода подтверждает правильность расстановки коэффициентов.
Итоговое уравнение:
H₂SO₄ + 2KOH → K₂SO₄ + 2H₂O
2) разложения иодида серебра на свету на серебро и иод
Определение реагентов и продуктов:
- Иодид серебра: AgI (Серебро Ag имеет валентность I, иод I имеет валентность I)
- Серебро: Ag (простое вещество)
- Иод: I₂ (иод, как и другие галогены, существует в виде двухатомной молекулы)
Запись схемы реакции:
AgI → Ag + I₂
Балансировка уравнения:
1. Иод (I): В продуктах, в I₂, содержится 2 атома иода, тогда как в реагентах, в AgI, только 1 атом. Для уравнивания, поставим коэффициент 2 перед AgI:
2AgI → Ag + I₂
2. Серебро (Ag): Теперь в реагентах, в 2AgI, содержится 2 атома серебра, тогда как в продуктах, в Ag, только 1 атом. Для уравнивания, поставим коэффициент 2 перед Ag:
2AgI → 2Ag + I₂
Итоговое уравнение:
2AgI → 2Ag + I₂
3) между магнием и соляной кислотой с образованием водорода и хлорида магния
Определение реагентов и продуктов:
- Магний: Mg (простое вещество, металл)
- Соляная кислота: HCl
- Водород: H₂ (газ)
- Хлорид магния: MgCl₂ (Магний Mg имеет валентность II, хлор Cl имеет валентность I. Требуются два атома хлора)
Запись схемы реакции:
Mg + HCl → MgCl₂ + H₂
Балансировка уравнения:
1. Магний (Mg): Количество атомов магния с обеих сторон уравнения уже одинаково (по одному).
2. Хлор (Cl): В продуктах, в MgCl₂, содержится 2 атома хлора, тогда как в реагентах, в HCl, только 1 атом. Для уравнивания, поставим коэффициент 2 перед HCl:
Mg + 2HCl → MgCl₂ + H₂
3. Водород (H): Теперь в реагентах, в 2HCl, содержится 2 атома водорода, и в продуктах, в H₂, также 2 атома. Водород уже сбалансирован.
Итоговое уравнение:
Mg + 2HCl → MgCl₂ + H₂↑ (Стрелка ↑ указывает на выделение газа)
4) между натрием и водой с образованием гидроксида натрия и водорода
Определение реагентов и продуктов:
- Натрий: Na (простое вещество, металл)
- Вода: H₂O
- Гидроксид натрия: NaOH (Натрий Na имеет валентность I, гидроксидная группа OH имеет валентность I)
- Водород: H₂ (газ)
Запись схемы реакции:
Na + H₂O → NaOH + H₂
Балансировка уравнения:
1. Натрий (Na): Количество атомов натрия с обеих сторон уравнения пока одинаково (по одному).
2. Водород (H): Это часто самый сложный элемент для балансировки в таких реакциях, так как водород из H₂O распределяется между двумя продуктами (NaOH и H₂). В реагентах, в H₂O, содержится 2 атома водорода. В продуктах: 1 атом в NaOH и 2 атома в H₂. Всего 3 атома. Нечетное число атомов водорода в продуктах указывает на необходимость использования четных коэффициентов. Удвоим количество молекул воды, чтобы иметь четное число атомов водорода в реагентах, например, 4:
Na + 2H₂O → NaOH + H₂
Теперь в реагентах 4 атома водорода. Чтобы получить 4 атома водорода в продуктах, нам необходимо 2 атома из NaOH и 2 атома из H₂. Это означает, что нам потребуется 2 молекулы NaOH.
Na + 2H₂O → 2NaOH + H₂
3. Натрий (Na): Теперь в продуктах, в 2NaOH, содержится 2 атома натрия, тогда как в реагентах, в Na, только 1 атом. Для уравнивания, поставим коэффициент 2 перед Na:
2Na + 2H₂O → 2NaOH + H₂
4. Кислород (O): Проверим баланс атомов кислорода. В реагентах: (2 * 1) = 2 атома из 2H₂O. В продуктах: (2 * 1) = 2 атома из 2NaOH. Баланс кислорода подтверждает правильность расстановки коэффициентов.
Итоговое уравнение:
2Na + 2H₂O → 2NaOH + H₂↑ (Стрелка ↑ указывает на выделение газа)
Вопрос 3
Это задание требует балансировки каждой реакции, а затем подсчета суммы всех коэффициентов в сбалансированном уравнении.
A) Ca + HCl → CaCl₂ + H₂
Балансировка:
1. Кальций (Ca): Количество атомов кальция с обеих сторон уравнения уже одинаково (по одному).
2. Хлор (Cl): В продуктах, в CaCl₂, содержится 2 атома хлора, тогда как в реагентах, в HCl, только 1 атом. Поставим коэффициент 2 перед HCl:
Ca + 2HCl → CaCl₂ + H₂
3. Водород (H): В реагентах, в 2HCl, содержится 2 атома водорода, и в продуктах, в H₂, также 2 атома. Водород уже сбалансирован.
Коэффициенты: 1 (для Ca), 2 (для HCl), 1 (для CaCl₂), 1 (для H₂).
Сумма коэффициентов: 1 + 2 + 1 + 1 = 5.
Б) SO₃ + H₂O → H₂SO₄
Балансировка:
1. Сера (S): Количество атомов серы с обеих сторон уравнения уже одинаково (по одному).
2. Водород (H): В реагентах, в H₂O, содержится 2 атома водорода, и в продуктах, в H₂SO₄, также 2 атома. Водород уже сбалансирован.
3. Кислород (O): В реагентах: (3 в SO₃ + 1 в H₂O) = 4 атома кислорода. В продуктах, в H₂SO₄, также 4 атома кислорода. Кислород уже сбалансирован.
Коэффициенты: 1 (для SO₃), 1 (для H₂O), 1 (для H₂SO₄).
Сумма коэффициентов: 1 + 1 + 1 = 3.
В) Li + N₂ → Li₃N
Балансировка:
1. Азот (N): В реагентах, в N₂, содержится 2 атома азота, тогда как в продуктах, в Li₃N, только 1 атом. Поставим коэффициент 2 перед Li₃N:
Li + N₂ → 2Li₃N
2. Литий (Li): Теперь в продуктах, в 2Li₃N, содержится (2 * 3) = 6 атомов лития, тогда как в реагентах, в Li, только 1 атом. Поставим коэффициент 6 перед Li:
6Li + N₂ → 2Li₃N
Коэффициенты: 6 (для Li), 1 (для N₂), 2 (для Li₃N).
Сумма коэффициентов: 6 + 1 + 2 = 9.
Г) CO + O₂ → CO₂
Балансировка:
1. Углерод (C): Количество атомов углерода с обеих сторон уравнения уже одинаково (по одному).
2. Кислород (O): В реагентах: (1 в CO + 2 в O₂) = 3 атома кислорода. В продуктах, в CO₂, содержится 2 атома кислорода. Чтобы уравнять, удвоим количество CO₂ в продуктах, получив 4 атома кислорода:
CO + O₂ → 2CO₂
3. Углерод (C): Теперь в продуктах, в 2CO₂, содержится 2 атома углерода, тогда как в реагентах, в CO, только 1 атом. Поставим коэффициент 2 перед CO:
2CO + O₂ → 2CO₂
4. Кислород (O): Проверим снова. В реагентах: (2 * 1) = 2 атома в 2CO + 2 атома в O₂ = 4 атома кислорода. В продуктах: (2 * 2) = 4 атома в 2CO₂. Баланс кислорода подтверждает правильность расстановки коэффициентов.
Коэффициенты: 2 (для CO), 1 (для O₂), 2 (для CO₂).
Сумма коэффициентов: 2 + 1 + 2 = 5.
Итоговое соответствие:
| А | Б | В | Г |
|---|---|---|---|
| 1 | 2 | 3 | 1 |
Вопрос 4
Это задание требует предсказания продуктов реакции, написания формул и балансировки уравнений.
A) фосфорная кислота и гидроксид калия
Исходные вещества: H₃PO₄ (фосфорная кислота) и KOH (гидроксид калия).
Тип реакции: Реакция нейтрализации (кислота + основание → соль + вода).
Предсказание продуктов: В результате реакции между фосфорной кислотой и гидроксидом калия образуются фосфат калия (K₃PO₄) и вода (H₂O).
Соответствие продуктам: фосфат калия и вода.
Запись и балансировка уравнения:
1. Схема: H₃PO₄ + KOH → K₃PO₄ + H₂O
2. Калий (K): В продуктах, в K₃PO₄, содержится 3 атома калия, тогда как в реагентах, в KOH, только 1 атом. Поставим коэффициент 3 перед KOH:
H₃PO₄ + 3KOH → K₃PO₄ + H₂O
3. Фосфат-группа (PO₄): Количество фосфатных групп с обеих сторон уравнения уже одинаково (по одной).
4. Водород (H): В реагентах: (3 в H₃PO₄ + 3 в 3KOH) = 6 атомов водорода. В продуктах, в H₂O, содержится 2 атома водорода. Поставим коэффициент 3 перед H₂O:
H₃PO₄ + 3KOH → K₃PO₄ + 3H₂O
5. Кислород (O): Проверка. В реагентах: (4 в H₃PO₄ + 3 в 3KOH) = 7 атомов кислорода. В продуктах: (4 в K₃PO₄ + 3 в 3H₂O) = 7 атомов кислорода. Баланс кислорода подтверждает правильность расстановки коэффициентов.
Итоговое уравнение:
H₃PO₄ + 3KOH → K₃PO₄ + 3H₂O
Б) нитрат бария (Для реакции обмена необходим второй реагент, который образует осадок с барием или нитратом. Исходя из продуктов, это должен быть сульфат калия.)
Исходные вещества: Ba(NO₃)₂ (нитрат бария) и K₂SO₄ (сульфат калия).
Тип реакции: Реакция ионного обмена. Для протекания реакции обмена должен образоваться осадок, газ или вода. Сульфат бария BaSO₄ является нерастворимым осадком.
Предсказание продуктов: В результате реакции образуются сульфат бария (BaSO₄) и нитрат калия (KNO₃).
Соответствие продуктам: сульфат бария и нитрат калия.
Запись и балансировка уравнения:
1. Схема: Ba(NO₃)₂ + K₂SO₄ → BaSO₄ + KNO₃
2. Барий (Ba): Количество атомов бария с обеих сторон уравнения уже одинаково (по одному).
3. Калий (K): В реагентах, в K₂SO₄, содержится 2 атома калия, тогда как в продуктах, в KNO₃, только 1 атом. Поставим коэффициент 2 перед KNO₃:
Ba(NO₃)₂ + K₂SO₄ → BaSO₄ + 2KNO₃
4. Нитрат-группа (NO₃): В реагентах, в Ba(NO₃)₂, содержится 2 нитрат-группы, и в продуктах, в 2KNO₃, также 2 нитрат-группы. Нитрат-группа уже сбалансирована.
5. Сульфат-группа (SO₄): Количество сульфатных групп с обеих сторон уравнения уже одинаково (по одной).
Итоговое уравнение:
Ba(NO₃)₂ + K₂SO₄ → BaSO₄↓ + 2KNO₃ (Стрелка ↓ указывает на образование осадка)
В) оксид азота (V) и вода
Исходные вещества: N₂O₅ (оксид азота (V), кислотный оксид) и H₂O (вода).
Тип реакции: Реакция соединения (кислотный оксид + вода → кислота).
Предсказание продуктов: Кислотный оксид азота (V) при взаимодействии с водой образует азотную кислоту (HNO₃).
Соответствие продуктам: азотная кислота.
Запись и балансировка уравнения:
1. Схема: N₂O₅ + H₂O → HNO₃
2. Азот (N): В реагентах, в N₂O₅, содержится 2 атома азота, тогда как в продуктах, в HNO₃, только 1 атом. Поставим коэффициент 2 перед HNO₃:
N₂O₅ + H₂O → 2HNO₃
3. Водород (H): В реагентах, в H₂O, содержится 2 атома водорода, и в продуктах, в 2HNO₃, также 2 атома. Водород уже сбалансирован.
4. Кислород (O): В реагентах: (5 в N₂O₅ + 1 в H₂O) = 6 атомов кислорода. В продуктах: (2 * 3) = 6 атомов в 2HNO₃. Баланс кислорода подтверждает правильность расстановки коэффициентов.
Итоговое уравнение:
N₂O₅ + H₂O → 2HNO₃
Г) оксид кальция и углекислый газ
Исходные вещества: CaO (оксид кальция, основной оксид) и CO₂ (углекислый газ, кислотный оксид).
Тип реакции: Реакция соединения (основный оксид + кислотный оксид → соль).
Предсказание продуктов: Оксид кальция и углекислый газ образуют карбонат кальция (CaCO₃).
Соответствие продуктам: карбонат кальция.
Запись и балансировка уравнения:
1. Схема: CaO + CO₂ → CaCO₃
2. Кальций (Ca): Количество атомов кальция с обеих сторон уравнения уже одинаково (по одному).
3. Углерод (C): Количество атомов углерода с обеих сторон уравнения уже одинаково (по одному).
4. Кислород (O): В реагентах: (1 в CaO + 2 в CO₂) = 3 атома кислорода. В продуктах, в CaCO₃, также 3 атома кислорода. Кислород уже сбалансирован.
Итоговое уравнение:
CaO + CO₂ → CaCO₃
Ответ:
| А | Б | В | Г |
|---|---|---|---|
| 4 | 1 | 3 | 2 |
Уравнения:
A) H₃PO₄ + 3KOH → K₃PO₄ + 3H₂O
Б) Ba(NO₃)₂ + K₂SO₄ → BaSO₄↓ + 2KNO₃
В) N₂O₅ + H₂O → 2HNO₃
Г) CaO + CO₂ → CaCO₃
Вопрос 5
Это задание требует интерпретации химического уравнения, то есть объяснения информации, которую оно несет.
Уравнение: Cu(OH)₂ + 2HCl = CuCl₂ + 2H₂O
Химическое уравнение представляет собой краткую запись химической реакции и содержит следующую информацию:
1. Качественный состав реакции:
Реагенты (исходные вещества): В левой части уравнения указаны вещества, которые вступают в реакцию. В данном случае это гидроксид меди (II) (Cu(OH)₂) и соляная (хлороводородная) кислота (HCl).
Продукты реакции: В правой части уравнения указаны вещества, которые образуются в результате реакции. В данном случае это хлорид меди (II) (CuCl₂) и вода (H₂O).
Тип реакции: Эта реакция является реакцией нейтрализации, так как в ней взаимодействуют основание (гидроксид меди (II)) и кислота (соляная кислота) с образованием соли и воды.
2. Количественные отношения между реагентами и продуктами (стехиометрия):
Коэффициенты (числа, стоящие перед формулами веществ) показывают соотношение, в котором молекулы (или моли) веществ участвуют в реакции и образуются в ней.
Данное уравнение показывает, что одна молекула (или один моль) гидроксида меди (II) взаимодействует с двумя молекулами (или двумя молями) соляной кислоты.
В результате этой реакции образуется одна молекула (или один моль) хлорида меди (II) и две молекулы (или два моля) воды.
Эти соотношения позволяют проводить стехиометрические расчеты, например, определить массу или количество одного вещества, если известна масса или количество другого.
Таким образом, уравнение химической реакции демонстрирует как качественные изменения веществ, так и количественные соотношения, в которых эти изменения происходят, подчиняясь закону сохранения массы.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.


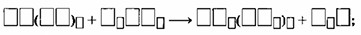
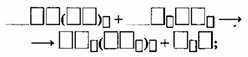
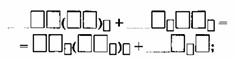



Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!