
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 135-136 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
2. Рассмотрим пример.
Рассчитайте массу серной кислоты, которая взаимодействует с 5,6 г гидроксида калия. В результате реакции образуется сульфат калия и вода.
ДАНО:
m(____) = 5,6 г
РЕШЕНИЕ:
1) H₂SO₄ + 2KOH = K₂SO₄ + 2H₂O.
2) n(KOH) = 5,6 г : 56 г/моль = 0,1 моль.
3) H₂SO₄ + 2KOH = K₂SO₄ + 2H₂O.
4) n(H₂SO₄) : n(KOH) = 1 : 2 (по уравнению) ⇒ n(H₂SO₄) = 0,5 × n(KOH) = 0,5 × 0,1 моль = 0,05 моль.
5) m(H₂SO₄) = 0,05 моль × ____ г/моль = ____ г.
ОТВЕТ:
m(____) = ____ г.
Часть II
1. Заполните пропуски, проанализировав уравнение реакции.
4P + 5O₂ = 2P₂O₅
| 4P | 5O₂ | 2P₂O₅ | |
|---|---|---|---|
| Число частиц, N | ______ атома | ______ молекул | ______ молекул |
| Количество вещества, n | ______ моль | ______ моль | ______ моль |
| Молярная масса, M | ______ г/моль | ______ г/моль | ______ г/моль |
| Масса, m | ______ г | ______ г | ______ г |
| Молярный объём, Vm | — | ______ л/моль | — |
| Объём, V | — | ______ л | — |
1) Если в реакцию вступит 3 моль фосфора, то потребуется
___, ___ моль кислорода, и образуется ___ моль оксида фосфора (V).
2) Для получения 213 г оксида фосфора (V) необходимо ___ л кислорода и ___ г фосфора.
3) Из ___ г фосфора при взаимодействии с 11,2 л кислорода образуется ___ г оксида фосфора (V).
2. Рассчитайте массу магния, который может сгореть в кислороде объёмом 33,6 л (н.у.).
Схема химической реакции:
Mg + O₂ → MgO.
ДАНО:
РЕШЕНИЕ:
1-й способ
Mg + O₂ = MgO.
1) n(O₂) = 33,6 л / 22,4 л/моль = 1,5 моль.
2) n(Mg) : n(O₂) = 2 : 1 (по уравнению)
⇒ n(Mg) = 2n(O₂) = 2 × 1,5 моль = 3 моль.
3) m(Mg) = 3 моль × ___ г/моль = ___ г.
ОТВЕТ: m(___) = ___ г.
2-й способ
1) По условию:
По уравнению:
2) Составьте и решите пропорцию:
\(m(\text{Mg}) = \frac{V(\text{O}_2)_{\text{по условию}} \cdot m(\text{Mg})_{\text{по уравнению}}}{V(\text{O}_2)_{\text{по уравнению}}};\)
m(Mg) = ___________ = ___ г.
ОТВЕТ: m(___) = ___ г.
§28
Часть I
Вопрос 2
ДАНО:
m(KOH) = 5,6 г
m(H₂SO₄) = ?
РЕШЕНИЕ:
1) H₂SO₄ + 2KOH = K₂SO₄ + 2H₂O
2) n(KOH) = 5,6 г : 56 г/моль = 0,1 моль.
3) H₂SO₄ + 2KOH = K₂SO₄ + 2H₂O.
4) n(H₂SO₄) : n(KOH) = 1 : 2 (по уравнению) ⇒
n(H₂SO₄) = 0,5 n(KOH) = 0,5 × 0,1 моль = 0,05 моль.
m(H₂SO₄) = 0,05 моль × 98 г/моль = 4,9 г.
ОТВЕТ: m(H₂SO₄) = 4,9 г.
Часть II
Вопрос 1
4P + 5O₂ = 2P₂O₅
| 4P | 5O₂ | 2P₂O₅ | |
|---|---|---|---|
| Число частиц, N | 4 атома | 5 молекул | 2 молекулы |
| Количество вещества, n | 4 моль | 5 моль | 2 моль |
| Молярная масса, M | 31 г/моль | 32 г/моль | 142 г/моль |
| Масса, m | 124 г | 160 г | 284 г |
| Молярный объём, Vm | — | 22,4 л/моль | — |
| Объём, V | — | 112 л | — |
1) Если в реакцию вступит 3 моль фосфора, то потребуется 3,75 (3·5/4=3,75) моль кислорода, и образуется 1,5 моль (3,75·2/5=1,5) оксида фосфора (V).
2) Для получения 213 г оксида фосфора (V) необходимо 84 л кислорода и 93 г фосфора.
3) Из 12,4 г (11,2·124/112=12,4) фосфора при взаимодействии с 11,2 л кислорода образуется 28,4 г (11,2·284/112=28,4) оксида фосфора (V).
Вопрос 2
ДАНО:
V(O₂) = 33,6 л
m(Mg) = ?
РЕШЕНИЕ:
1-й способ
2Mg + O₂ = 2MgO
1) n(O₂) = 33,6 л / 22,4 л/моль = 1,5 моль.
2) n(Mg) : n(O₂) = 2 : 1 (по уравнению)
→ n(Mg) = 2n(O₂) = 2 × 1,5 моль = 3 моль.
3) m(Mg) = 3 моль × 24 г/моль = 72 г.
ОТВЕТ: m(Mg) = 72 г.
2-й способ
1) По условию:
| x г | V = 33,6 л |
| 2 Mg | + O₂ = 2 MgO |
По уравнению:
\(n \text{ 2 моль}\) \(n \text{ 1 моль}\)
\(M \text{ 24 г/моль}\) \(V_m \text{ 22,4 л/моль}\)
\(m \text{ 48 г}\) \(V \text{ 22,4 л}\)
2)
\(
m(Mg) = \frac{33,6 \cdot 48}{22,4} = 72 \text{ г}.
\)
ОТВЕТ: m(Mg) = 72 г.
Часть I
Вопрос 2
Условие задачи:
Рассчитайте массу серной кислоты, которая взаимодействует с 5,6 г гидроксида калия. В результате реакции образуется сульфат калия и вода.
ДАНО:
Масса гидроксида калия (m(KOH)) = 5,6 г
НАЙТИ:
Масса серной кислоты (m(H₂SO₄)) = ?
РЕШЕНИЕ:
1. Запись и уравнивание химического уравнения:
Реакция между серной кислотой (H₂SO₄) и гидроксидом калия (KOH) является реакцией нейтрализации, в результате которой образуется соль (сульфат калия, K₂SO₄) и вода (H₂O).
H₂SO₄ + KOH → K₂SO₄ + H₂O
Уравняем реакцию:
2KOH + H₂SO₄ = K₂SO₄ + 2H₂O
Из уравнения видно, что 1 моль серной кислоты реагирует с 2 молями гидроксида калия.
2. Расчет молярной массы гидроксида калия (M(KOH)):
M(K) = 39 г/моль
M(O) = 16 г/моль
M(H) = 1 г/моль
M(KOH) = 39 + 16 + 1 = 56 г/моль
3. Расчет количества вещества гидроксида калия (n(KOH)):
Используем формулу n = m / M.
n(KOH) = 5,6 г / 56 г/моль = 0,1 моль
4. Определение количества вещества серной кислоты (n(H₂SO₄)) по стехиометрии:
Из уравненного химического уравнения (2KOH + H₂SO₄ = K₂SO₄ + 2H₂O) видно, что соотношение количества вещества H₂SO₄ к KOH составляет 1:2.
Следовательно:
n(H₂SO₄) = n(KOH) / 2
n(H₂SO₄) = 0,1 моль / 2 = 0,05 моль
5. Расчет молярной массы серной кислоты (M(H₂SO₄)):
M(H) = 1 г/моль
M(S) = 32 г/моль
M(O) = 16 г/моль
M(H₂SO₄) = (2 × 1) + 32 + (4 × 16) = 2 + 32 + 64 = 98 г/моль
6. Расчет массы серной кислоты (m(H₂SO₄)):
Используем формулу m = n × M.
m(H₂SO₄) = 0,05 моль × 98 г/моль = 4,9 г
ОТВЕТ:
Масса серной кислоты (m(H₂SO₄)) = 4,9 г.
Часть II
Вопрос 1
Уравнение реакции:
4P + 5O₂ = 2P₂O₅
1. Заполнение таблицы:
Для заполнения таблицы необходимо использовать стехиометрические коэффициенты из уравнения реакции и молярные массы веществ.
Фосфор (P):
Число частиц (атомов): Коэффициент перед P равен 4, поэтому 4 атома.
Количество вещества (n): 4 моль (согласно коэффициенту).
Молярная масса (M): M(P) = 31 г/моль.
Масса (m): m = n × M = 4 моль × 31 г/моль = 124 г.
Молярный объем (Vm): Не применимо для твердого вещества.
Объем (V): Не применимо для твердого вещества.
Кислород (O₂):
Число частиц (молекул): Коэффициент перед O₂ равен 5, поэтому 5 молекул.
Количество вещества (n): 5 моль (согласно коэффициенту).
Молярная масса (M): M(O₂) = 2 × 16 = 32 г/моль.
Масса (m): m = n × M = 5 моль × 32 г/моль = 160 г.
Молярный объем (Vm): Для газов при н.у. Vm = 22,4 л/моль.
Объем (V): V = n × Vm = 5 моль × 22,4 л/моль = 112 л.
Оксид фосфора (V) (P₂O₅):
Число частиц (молекул): Коэффициент перед P₂O₅ равен 2, поэтому 2 молекулы.
Количество вещества (n): 2 моль (согласно коэффициенту).
Молярная масса (M): M(P₂O₅) = (2 × 31) + (5 × 16) = 62 + 80 = 142 г/моль.
Масса (m): m = n × M = 2 моль × 142 г/моль = 284 г.
Молярный объем (Vm): Не применимо для твердого вещества.
Объем (V): Не применимо для твердого вещества.
Заполненная таблица:
| Категория | 4P | 5O₂ | 2P₂O₅ |
|---|---|---|---|
| Число частиц, N | 4 атома | 5 молекул | 2 молекулы |
| Количество вещества, n | 4 моль | 5 моль | 2 моль |
| Молярная масса, M | 31 г/моль | 32 г/моль | 142 г/моль |
| Масса, m | 124 г | 160 г | 284 г |
| Молярный объём, Vm | — | 22,4 л/моль | — |
| Объём, V | — | 112 л | — |
2. Решение дополнительных вопросов:
1) Если в реакцию вступит 3 моль фосфора, то потребуется ___ моль кислорода, и образуется ___ моль оксида фосфора (V).
Расчет количества кислорода:
Из уравнения 4P + 5O₂ = 2P₂O₅ видно, что 4 моль P реагируют с 5 моль O₂.
Составим пропорцию:
4 моль P / 5 моль O₂ = 3 моль P / x моль O₂
x = (3 моль P × 5 моль O₂) / 4 моль P = 15 / 4 = 3,75 моль O₂
Расчет количества оксида фосфора (V):
Из уравнения 4P + 5O₂ = 2P₂O₅ видно, что 4 моль P образуют 2 моль P₂O₅.
Составим пропорцию:
4 моль P / 2 моль P₂O₅ = 3 моль P / y моль P₂O₅
y = (3 моль P × 2 моль P₂O₅) / 4 моль P = 6 / 4 = 1,5 моль P₂O₅
Ответ: Если в реакцию вступит 3 моль фосфора, то потребуется 3,75 моль кислорода, и образуется 1,5 моль оксида фосфора (V).
2) Для получения 213 г оксида фосфора (V) необходимо ___ л кислорода и ___ г фосфора.
Расчет количества вещества P₂O₅:
m(P₂O₅) = 213 г
M(P₂O₅) = 142 г/моль (из таблицы)
n(P₂O₅) = m / M = 213 г / 142 г/моль = 1,5 моль P₂O₅
Расчет объема кислорода:
Из уравнения 4P + 5O₂ = 2P₂O₅ видно, что 2 моль P₂O₅ образуются из 5 моль O₂.
Составим пропорцию:
2 моль P₂O₅ / 5 моль O₂ = 1,5 моль P₂O₅ / x моль O₂
x = (1,5 моль P₂O₅ × 5 моль O₂) / 2 моль P₂O₅ = 7,5 / 2 = 3,75 моль O₂
V(O₂) = n(O₂) × Vm = 3,75 моль × 22,4 л/моль = 84 л O₂
Расчет массы фосфора:
Из уравнения 4P + 5O₂ = 2P₂O₅ видно, что 2 моль P₂O₅ образуются из 4 моль P.
Составим пропорцию:
2 моль P₂O₅ / 4 моль P = 1,5 моль P₂O₅ / y моль P
y = (1,5 моль P₂O₅ × 4 моль P) / 2 моль P₂O₅ = 6 / 2 = 3 моль P
m(P) = n(P) × M(P) = 3 моль × 31 г/моль = 93 г P
Ответ: Для получения 213 г оксида фосфора (V) необходимо 84 л кислорода и 93 г фосфора.
3) Из ___ г фосфора при взаимодействии с 11,2 л кислорода образуется ___ г оксида фосфора (V).
Расчет количества вещества кислорода:
V(O₂) = 11,2 л
Vm = 22,4 л/моль
n(O₂) = V(O₂) / Vm = 11,2 л / 22,4 л/моль = 0,5 моль O₂
Расчет теоретически необходимого количества фосфора для 0,5 моль O₂:
Из уравнения 4P + 5O₂ = 2P₂O₅ видно, что 5 моль O₂ реагируют с 4 моль P.
Составим пропорцию:
5 моль O₂ / 4 моль P = 0,5 моль O₂ / x моль P
x = (0,5 моль O₂ × 4 моль P) / 5 моль O₂ = 2 / 5 = 0,4 моль P
Определение массы фосфора, которая вступит в реакцию:
Так как в условии сказано «при взаимодействии с 11,2 л кислорода», это подразумевает, что кислород является лимитирующим реагентом или что его количество определяет ход реакции. Если бы было дано конкретное количество фосфора, мы бы сравнивали стехиометрические соотношения. В данном случае, мы рассчитываем по кислороду.
Требуется 0,4 моль P.
m(P) = n(P) × M(P) = 0,4 моль × 31 г/моль = 12,4 г P
Расчет массы оксида фосфора (V), который образуется:
Из уравнения 4P + 5O₂ = 2P₂O₅ видно, что 5 моль O₂ образуют 2 моль P₂O₅.
Составим пропорцию:
5 моль O₂ / 2 моль P₂O₅ = 0,5 моль O₂ / y моль P₂O₅
y = (0,5 моль O₂ × 2 моль P₂O₅) / 5 моль O₂ = 1 / 5 = 0,2 моль P₂O₅
m(P₂O₅) = n(P₂O₅) × M(P₂O₅) = 0,2 моль × 142 г/моль = 28,4 г P₂O₅
Ответ: Из 12,4 г фосфора при взаимодействии с 11,2 л кислорода образуется 28,4 г оксида фосфора (V).
Вопрос 2
Для решения данной задачи необходимо определить массу магния, которая вступит в реакцию с заданным объемом кислорода.
ДАНО:
Объем кислорода (V(O₂)) = 33,6 л (при нормальных условиях)
Химическая реакция: Mg + O₂ → MgO
НАЙТИ:
Масса магния (m(Mg)) = ?
РЕШЕНИЕ:
1-й способ (Через количество вещества):
Запись и уравнивание химического уравнения:
Первым шагом всегда является запись химического уравнения реакции и его уравнивание, чтобы соблюсти закон сохранения массы.
Исходное уравнение: Mg + O₂ → MgO
Для уравнивания, необходимо поставить коэффициент 2 перед Mg и MgO:
2Mg + O₂ = 2MgO
Это уравнение показывает, что 2 моля магния реагируют с 1 молем кислорода, образуя 2 моля оксида магния.
Расчет количества вещества кислорода (n(O₂)):
Поскольку кислород является газом и его объем дан при нормальных условиях (н.у.), мы можем использовать молярный объем газа (Vm = 22,4 л/моль) для расчета его количества вещества.
n(O₂) = V(O₂) / Vm
n(O₂) = 33,6 л / 22,4 л/моль = 1,5 моль
Определение количества вещества магния (n(Mg)) по стехиометрии:
Из уравненного химического уравнения (2Mg + O₂ = 2MgO) видно, что соотношение количеств вещества магния и кислорода составляет 2:1. То есть, на каждый 1 моль кислорода приходится 2 моля магния.
Следовательно:
n(Mg) = 2 × n(O₂)
n(Mg) = 2 × 1,5 моль = 3 моль
Расчет массы магния (m(Mg)):
Теперь, зная количество вещества магния и его молярную массу (M(Mg) = 24 г/моль), мы можем найти массу магния.
m(Mg) = n(Mg) × M(Mg)
m(Mg) = 3 моль × 24 г/моль = 72 г
2-й способ (Через пропорцию):
Шаг 1: Запишем и уравняем химическое уравнение реакции.
Неуравненное уравнение: Mg + O₂ → MgO
Уравняем его:
Слева у нас 2 атома кислорода (в O₂), а справа 1 атом кислорода (в MgO).
Чтобы уравнять кислород, поставим коэффициент 2 перед MgO:
Mg + O₂ → 2MgO
Теперь посчитаем атомы магния.
Справа их 2 (в 2MgO), а слева 1.
Чтобы уравнять магний, поставим коэффициент 2 перед Mg:
2Mg + O₂ = 2MgO
Шаг 2: Определим, что дано и что нужно найти.
Дано: Объем кислорода (O₂) = 33,6 л.
Найти: Массу магния (Mg).
Применение 2-го способа для расчета массы магния (Mg):
1) По условию:
Мы записываем известные и искомые величины над соответствующими веществами в уравнении.
Над Mg (магнием) мы ставим \( x \) г, так как это искомая масса.
Над O₂ (кислородом) мы ставим 33,6 л, так как это объем, данный в условии задачи.
\(
\begin{array}{ccccccc}
x \text{ г} & & 33,6 \text{ л} \\
2\text{Mg} & + & \text{O}_2 & = & 2\text{MgO}
\end{array}
\)
По уравнению:
Теперь мы рассчитываем теоретические (стехиометрические) количества веществ, исходя из коэффициентов в уравненной реакции \(2\text{Mg} + \text{O}_2 = 2\text{MgO}\).
Для магния (Mg):
n (количество вещества): Из уравнения видно, что 2 моль Mg вступают в реакцию.
M (молярная масса): Молярная масса магния (Mg) равна 24 г/моль (из Периодической таблицы).
m (масса): Чтобы найти массу 2 моль Mg, умножим количество вещества на молярную массу:
\( m(\text{Mg}) = n \cdot M = 2\,\text{моль} \cdot 24\,\text{г/моль} = 48\,\text{г} \)
Для кислорода (O₂):
n (количество вещества): Из уравнения видно, что 1 моль O₂ вступает в реакцию (коэффициент 1 обычно не пишется).
V_m (молярный объем): Для любого газа при нормальных условиях (н.у.) молярный объем равен 22,4 л/моль.
V (объем): Чтобы найти объем 1 моль O₂, умножим количество вещества на молярный объем:
\( V(\text{O}_2) = n \cdot V_m = 1\,\text{моль} \cdot 22{,}4\,\text{л/моль} = 22{,}4\,\text{л} \)
Заполняем эти значения под уравнением:
\(
\begin{array}{ccccccc}
x \text{ г} & & 33,6 \text{ л} \\
2\text{Mg} & + & \text{O}_2 & = & 2\text{MgO} \\
n\,2\,\text{моль} & & n\,1\,\text{моль} \\
M\,24\,\text{г/моль} & & V_m\,22{,}4\,\text{л/моль} \\
m\,48\,\text{г} & & V\,22{,}4\,\text{л}
\end{array}
\)
2) Составьте и решите пропорцию:
Теперь мы можем составить пропорцию, связывающую данные по условию с данными по уравнению.
\(
\frac{\text{Масса Mg по условию}}{\text{Масса Mg по уравнению}} = \frac{\text{Объем O}_2 \text{ по условию}}{\text{Объем O}_2 \text{ по уравнению}}
\)
Подставляем значения:
\(
\frac{m(\text{Mg})}{48\,\text{г}} = \frac{33{,}6\,\text{л}}{22{,}4\,\text{л}}
\)
Чтобы найти \( m(\text{Mg}) \), выразим его из пропорции:
\(
m(\text{Mg}) = \frac{33{,}6\,\text{л} \cdot 48\,\text{г}}{22{,}4\,\text{л}}
\)
Выполняем расчет:
\(
m(\text{Mg}) = \frac{1612{,}8}{22{,}4}
\)
\(
m(\text{Mg}) = 72\,\text{г}
\)
ОТВЕТ: \( m(\text{Mg}) = 72\,\text{г} \).

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.


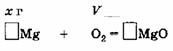
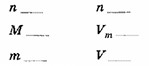



Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!