
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 141-143 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
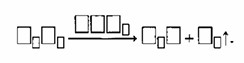
2. Интенсивность протекания реакций характеризует её □□□□□□□
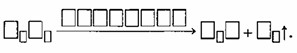
3. Вещества, изменяющие скорость реакции, называются □□□□□□□□□□□, а реакции с их участием — □□□□□□□□□□□.
Например, разложение пероксида водорода в присутствии катализатора:
4. Биологические катализаторы белковой природы называются
□□□□□□□□□□□, а реакции с их участием — □□□□□□□□□□□.
Например, разложение пероксида водорода в присутствии фермента:
Часть II
1. Напишите уравнения химических реакций по описанию. Допишите, где необходимо, условия проведения реакций.
1) Нитрат меди (II) при нагревании разлагается на оксид меди (II), оксид азота (IV) и кислород.
2) При нагревании гидроксид меди (II) разлагается на оксид меди (II) и воду.
3) Нитрат серебра на свету разлагается на серебро, оксид азота (IV) и кислород.
4) При нагревании нитрат натрия разлагается на нитрит натрия и кислород.
2. Расставьте коэффициенты в схемах химических реакций.
1) Al₂S₃ + __ H₂O → __ Al(OH)₃ + __ H₂S
2) __ KMnO₄ → K₂MnO₄ + MnO₂ + O₂
3) __ KClO₃ → __ KCl + __ O₂
4) Al₄C₃ + __ H₂O → __ Al(OH)₃ + 3CH₄
5) NH₃ → N₂ + __ H₂
6) __ Ca₃(PO₄)₂ + __ H₂SO₄ → __ H₃PO₄ + __ CaSO₄
Какие реакции относятся к реакциям разложения?
Ответ. ___________
3. Верны ли следующие суждения?
А. Почти все реакции разложения эндотермические.
Б. Катализаторы ускоряют химические реакции, но сами при этом не расходуются.
1) оба суждения верны
2) верно только А
3) верно только Б
4) оба суждения неверны
Ответ. ___________
4. Проведите домашний эксперимент.
1) Возьмите сырую и варёную картофелины.
2) Аккуратно порежьте их на мелкие кусочки.
3) Добавьте по отдельности перекись водорода к сырому и варёному картофелю.
Что наблюдаете?
Объясните результаты опыта.
Какой газ выделяется? Как это можно доказать?
5. С помощью Интернета и других источников информации (укажите) найдите интересный факт применения катализатора или фермента в быту или на производстве. Опишите его.
Вопрос 2
Интенсивность протекания реакций характеризует ее СКОРОСТЬ.
Вопрос 3
Вещества, изменяющие скорость реакции, называются КАТАЛИЗАТОРАМИ, а реакции с их участием — КАТАЛИТИЧЕСКИМИ.
Например, разложение пероксида водорода в присутствии катализатора:
Вопрос 4
Биологические катализаторы белковой природы называются ФЕРМЕНТАМИ, а реакции с их участием — ФЕРМЕНТАТИВНЫМИ.
Например, разложение пероксида водорода в присутствии фермента:
Часть II
Вопрос 1
1. 2Cu(NO₃)₂ (t°) → 2CuO + 4NO₂ + O₂
2. Cu(OH)₂ (t°) → CuO + H₂O
3. 2AgNO₃ (свет) → 2Ag + 2NO₂ + O₂
4. 2NaNO₃ (t°) → 2NaNO₂ + O₂
Вопрос 2
1) Al₂S₃ + 6 H₂O → 2 Al(OH)₃ + 3 H₂S
2) 2 KMnO₄ → K₂MnO₄ + MnO₂ + O₂
3) 2 KClO₃ → 2 KCl + 3 O₂
4) Al₄C₃ + 12 H₂O → 4 Al(OH)₃ + 3 CH₄
5) 2 NH₃ → N₂ + 3 H₂
6) 2 H₃PO₄ + 3 CaSO₄ → 3 H₂SO₄ + Ca₃(PO₄)₂
Ответ: 235.
Вопрос 3
А. Почти все реакции разложения эндотермические. Верно.
Б. Катализаторы ускоряют химические реакции, но сами при этом не расходуются. Верно.
Оба суждения верны.
Ответ: 1.
Вопрос 4
1. При взаимодействии перекиси водорода с сырой картофелиной началось интенсивное выделение газовых пузырьков. Однако при контакте с варёной картофелиной подобного эффекта не наблюдалось.
2. Разложение перекиси водорода происходит благодаря ферменту каталазе, который содержится в сыром картофеле, что и вызывает активную реакцию. В процессе варки картофеля каталаза, как и другие ферменты, разрушается, вследствие чего реакция разложения перекиси не ускоряется.
3. В результате разложения перекиси водорода образуется кислород:
Подтверждение выделения кислорода: если поднести тлеющую лучинку к области реакции, она вспыхивает, так как кислород способствует процессу горения.
Вопрос 5
Применение ферментов в промышленности
Пищевая промышленность:
- Амилазы участвуют в расщеплении крахмала, что применяется в процессе выпечки хлеба, а также при производстве пива, соков и сиропов.
- Протеазы способствуют разложению белков, что используется при изготовлении сыров, мясной продукции и соевого соуса.
Текстильная промышленность:
- Целлюлазы обеспечивают расщепление целлюлозы, что необходимо для обработки и отбеливания тканей из хлопка и льна.
Производство моющих средств:
- Протеазы, липазы и амилазы эффективно устраняют пятна, возникающие из-за белков, жиров и углеводов.
Фармацевтическая промышленность:
- Разнообразные ферменты применяются для синтеза лекарственных средств, таких как инсулин, антибиотики и препараты против вирусов.
Для выполнения данных заданий необходимо глубокое понимание основных химических понятий, таких как скорость реакции, катализ, ферменты, а также умение составлять и балансировать уравнения химических реакций и анализировать их типы.
Вопрос 2
Интенсивность протекания реакций характеризует её…
Интенсивность протекания химической реакции — это мера того, насколько быстро реагенты превращаются в продукты. В химии эта характеристика называется скоростью реакции. Скорость реакции может быть высокой (например, взрыв) или очень низкой (например, ржавление железа).
Она определяется изменением концентрации одного из реагентов или продуктов за единицу времени. Понимание скорости реакции критически важно как в теоретической химии, так и в промышленных процессах, где необходимо контролировать выход продукта и эффективность процесса.
Ответ: Скорость.
Вопрос 3
Вещества, изменяющие скорость реакции, называются…, а реакции с их участием — … . Например, разложение пероксида водорода в присутствии катализатора:
Катализаторы: Это вещества, которые способны изменять (чаще всего увеличивать) скорость химической реакции, но при этом сами не расходуются в процессе реакции и не входят в состав конечных продуктов. Их действие основано на изменении механизма реакции, что приводит к снижению энергии активации — того энергетического барьера, который необходимо преодолеть молекулам для вступления в реакцию. Катализаторы могут быть гомогенными (в той же фазе, что и реагенты) или гетерогенными (в другой фазе).
Каталитические реакции: Это химические реакции, протекающие с участием катализаторов.
Благодаря катализаторам многие промышленные процессы становятся экономически выгодными, так как позволяют проводить реакции при более низких температурах и давлениях, экономя энергию и время.
Пример: Разложение пероксида водорода (H₂O₂) в присутствии оксида марганца(IV) (MnO₂): Пероксид водорода самопроизвольно разлагается на воду и кислород, но очень медленно.
Добавление небольшого количества оксида марганца(IV) (MnO₂) резко ускоряет этот процесс. MnO₂ выступает здесь как гетерогенный катализатор.
Уравнение реакции: 2H₂O₂ (в присутствии MnO₂) → 2H₂O + O₂↑
Балансировка: Два атома водорода на обеих сторонах, четыре атома кислорода на обеих сторонах.
Коэффициенты 2 перед H₂O₂ и H₂O обеспечивают баланс. Стрелка вверх (↑) указывает на выделение газа (кислорода).
Ответ: Катализаторами, каталитическими. Уравнение: 2H₂O₂ (MnO₂) = 2H₂O + O₂↑
Вопрос 4
Биологические катализаторы белковой природы называются…, а реакции с их участием — … . Например, разложение пероксида водорода в присутствии фермента:
Ферменты: Это особый класс катализаторов, встречающихся в живых организмах. Они являются сложными белковыми молекулами, которые обладают высокой специфичностью: каждый фермент обычно катализирует только одну или очень ограниченное число реакций. Ферменты работают в мягких условиях (температура тела, нейтральный pH), что делает их незаменимыми для поддержания жизни.
Ферментативные реакции: Это химические реакции, катализируемые ферментами. Они лежат в основе всех биохимических процессов в живых организмах, таких как пищеварение, дыхание, синтез белков и нуклеиновых кислот.
Пример: Разложение пероксида водорода в присутствии фермента каталазы: Внутри клеток живых организмов постоянно образуется токсичный пероксид водорода. Для его быстрого обезвреживания существует фермент каталаза, который чрезвычайно эффективно катализирует его разложение.
Каталаза содержится во многих тканях, например, в печени и картофеле.
Уравнение реакции: 2H₂O₂ (в присутствии каталазы) → 2H₂O + O₂↑
Балансировка: Аналогична предыдущему примеру.
Ответ: Ферментами, ферментативными. Уравнение: 2H₂O₂ (каталаза) = 2H₂O + O₂↑
Часть II
Вопрос 1
1. Нитрат меди (II) при нагревании разлагается на оксид меди (II), оксид азота (IV) и кислород.
Составление формул: Нитрат меди(II) — Cu(NO₃)₂ (медь в степени окисления +2, нитрат-ион NO₃⁻). Оксид меди(II) — CuO. Оксид азота(IV) — NO₂. Кислород — O₂.
Несбалансированное уравнение: Cu(NO₃)₂ → CuO + NO₂ + O₂
Балансировка:
- Начнем с азота (N). Слева 2 атома N (в Cu(NO₃)₂), справа 1 атом N (в NO₂). Ставим коэффициент 2 перед NO₂:
Cu(NO₃)₂ → CuO + 2NO₂ + O₂ - Теперь посчитаем кислород (O). Слева: 2 * 3 = 6 атомов O. Справа: 1 (в CuO) + 2 * 2 (в 2NO₂) + 2 (в O₂) = 1 + 4 + 2 = 7 атомов O. Кислород не сбалансирован.
- Чтобы сбалансировать кислород, учитывая, что O₂ всегда имеет четное число атомов, попробуем удвоить исходное вещество, чтобы получить четное число атомов азота и кислорода:
2Cu(NO₃)₂ → 2CuO + 4NO₂ + O₂ - Проверяем баланс:
Cu: слева 2, справа 2. (Сбалансировано)
N: слева 2 * 2 = 4, справа 4. (Сбалансировано)
O: слева 2 * 3 * 2 = 12, справа 2 (в 2CuO) + 4 * 2 (в 4NO₂) + 2 (в O₂) = 2 + 8 + 2 = 12. (Сбалансировано)
Условие: Нагревание (обозначается t° или Δ).
Ответ: 2Cu(NO₃)₂ (t°) → 2CuO + 4NO₂ + O₂
2. При нагревании гидроксид меди (II) разлагается на оксид меди (II) и воду.
Составление формул: Гидроксид меди(II) — Cu(OH)₂. Оксид меди(II) — CuO. Вода — H₂O.
Несбалансированное уравнение: Cu(OH)₂ → CuO + H₂O
Балансировка: Медь (Cu), кислород (O) и водород (H) уже сбалансированы: по 1 атому Cu, по 2 атома O, по 2 атома H с каждой стороны.
Условие: Нагревание (t°).
Ответ: Cu(OH)₂ (t°) → CuO + H₂O
3. Нитрат серебра на свету разлагается на серебро, оксид азота (IV) и кислород.
Составление формул: Нитрат серебра — AgNO₃. Серебро — Ag. Оксид азота(IV) — NO₂. Кислород — O₂.
Несбалансированное уравнение: AgNO₃ → Ag + NO₂ + O₂
Балансировка: Аналогично разложению нитрата меди(II), для балансировки кислорода потребуется удвоить исходное вещество:
2AgNO₃ → 2Ag + 2NO₂ + O₂
Условие: Свет (обозначается hv или «свет»).
Ответ: 2AgNO₃ (свет) → 2Ag + 2NO₂ + O₂
4. При нагревании нитрат натрия разлагается на нитрит натрия и кислород.
Составление формул: Нитрат натрия — NaNO₃. Нитрит натрия — NaNO₂. Кислород — O₂.
Несбалансированное уравнение: NaNO₃ → NaNO₂ + O₂
Балансировка:
- Натрий (Na) и азот (N) уже сбалансированы.
- Кислород (O): Слева 3 атома O, справа 2 (в NaNO₂) + 2 (в O₂) = 4 атома O. Чтобы сбалансировать, нужно найти наименьшее общее кратное для 3 и 4, но это неверный подход, так как кислород справа находится в двух разных продуктах.
Попробуем удвоить исходное вещество:
2NaNO₃ → 2NaNO₂ + O₂ - Проверяем баланс:
Na: слева 2, справа 2. (Сбалансировано)
N: слева 2, справа 2. (Сбалансировано)
O: слева 2 * 3 = 6, справа 2 * 2 (в 2NaNO₂) + 2 (в O₂) = 4 + 2 = 6. (Сбалансировано) - Условие: Нагревание (t°).
Ответ: 2NaNO₃ (t°) → 2NaNO₂ + O₂
Вопрос 2
Реакция разложения — это химическая реакция, в которой из одного сложного вещества образуется два или более новых, более простых веществ (простых или сложных). Общий вид: AB → A + B.
1. Al₂S₃ + H₂O → Al(OH)₃ + H₂S
Балансировка:
- Al: Слева 2, справа 1. Ставим 2 перед Al(OH)₃: Al₂S₃ + H₂O → 2Al(OH)₃ + H₂S
- S: Слева 3, справа 1. Ставим 3 перед H₂S: Al₂S₃ + H₂O → 2Al(OH)₃ + 3H₂S
- H: Справа 2 * 3 (в Al(OH)₃) + 3 * 2 (в H₂S) = 6 + 6 = 12. Слева в H₂O только 2. Ставим 6 перед H₂O: Al₂S₃ + 6H₂O → 2Al(OH)₃ + 3H₂S
- O: Слева 6, справа 2 * 3 = 6. (Сбалансировано)
Тип реакции: Это реакция гидролиза, а не разложения, так как два исходных вещества (Al₂S₃ и H₂O) образуют два новых.
Сбалансированное уравнение: Al₂S₃ + 6H₂O → 2Al(OH)₃ + 3H₂S
2. KMnO₄ → K₂MnO₄ + MnO₂ + O₂
Балансировка:
- K: Слева 1, справа 2. Ставим 2 перед KMnO₄: 2KMnO₄ → K₂MnO₄ + MnO₂ + O₂
- Mn: Слева 2, справа 1 (в K₂MnO₄) + 1 (в MnO₂) = 2. (Сбалансировано)
- O: Слева 2 * 4 = 8. Справа 4 (в K₂MnO₄) + 2 (в MnO₂) + 2 (в O₂) = 8. (Сбалансировано)
Тип реакции: Это реакция разложения, так как одно сложное вещество (KMnO₄) распадается на три более простых вещества.
Сбалансированное уравнение: 2KMnO₄ → K₂MnO₄ + MnO₂ + O₂
3. KClO₃ → KCl + O₂
Балансировка:
- K и Cl уже сбалансированы.
- O: Слева 3, справа 2. Наименьшее общее кратное для 3 и 2 — это 6. Ставим 2 перед KClO₃ и 3 перед O₂: 2KClO₃ → KCl + 3O₂
- K и Cl: Слева 2, справа 1. Ставим 2 перед KCl: 2KClO₃ → 2KCl + 3O₂
Тип реакции: Это реакция разложения, так как одно сложное вещество (KClO₃) распадается на два более простых.
Сбалансированное уравнение: 2KClO₃ → 2KCl + 3O₂
4. Al₄C₃ + H₂O → Al(OH)₃ + CH₄
Балансировка:
- Al: Слева 4, справа 1. Ставим 4 перед Al(OH)₃: Al₄C₃ + H₂O → 4Al(OH)₃ + CH₄
- C: Слева 3, справа 1. Ставим 3 перед CH₄: Al₄C₃ + H₂O → 4Al(OH)₃ + 3CH₄
- H: Справа 4 * 3 (в Al(OH)₃) + 3 * 4 (в CH₄) = 12 + 12 = 24. Слева в H₂O только 2. Ставим 12 перед
- H₂O: Al₄C₃ + 12H₂O → 4Al(OH)₃ + 3CH₄
- O: Слева 12, справа 4 * 3 = 12. (Сбалансировано)
Тип реакции: Это реакция гидролиза, а не разложения, так как два исходных вещества образуют два новых.
Сбалансированное уравнение: Al₄C₃ + 12H₂O → 4Al(OH)₃ + 3CH₄
5. NH₃ → N₂ + H₂
Балансировка:
- N: Слева 1, справа 2. Ставим 2 перед NH₃: 2NH₃ → N₂ + H₂
- H: Слева 2 * 3 = 6, справа 2. Ставим 3 перед H₂: 2NH₃ → N₂ + 3H₂
Тип реакции: Это реакция разложения, так как одно сложное вещество (NH₃) распадается на два простых.
Сбалансированное уравнение: 2NH₃ → N₂ + 3H₂
6. H₃PO₄ + CaSO₄ → H₂SO₄ + Ca₃(PO₄)₂
Балансировка:
- Ca: Слева 1, справа 3. Ставим 3 перед CaSO₄: H₃PO₄ + 3CaSO₄ → H₂SO₄ + Ca₃(PO₄)₂
- PO₄: Слева 1, справа 2. Ставим 2 перед H₃PO₄: 2H₃PO₄ + 3CaSO₄ → H₂SO₄ + Ca₃(PO₄)₂
- H: Слева 2 * 3 = 6. Справа в H₂SO₄ только 2. Ставим 3 перед H₂SO₄: 2H₃PO₄ + 3CaSO₄ → 3H₂SO₄ + Ca₃(PO₄)₂
- SO₄: Слева 3, справа 3. (Сбалансировано)
Тип реакции: Это реакция обмена (или двойного замещения), так как два сложных вещества обмениваются своими составными частями.
Сбалансированное уравнение: 2H₃PO₄ + 3CaSO₄ → 3H₂SO₄ + Ca₃(PO₄)₂
Ответ на вопрос о реакциях разложения: Реакции разложения — это те, в которых из одного сложного вещества образуется несколько более простых. К ним относятся реакции под номерами 2, 3, 5.
Вопрос 3
А. Почти все реакции разложения эндотермические.
Эндотермические реакции — это реакции, которые поглощают энергию (обычно в виде тепла) из окружающей среды. Для того чтобы сложное вещество распалось на более простые компоненты, необходимо разорвать химические связи внутри его молекул. Разрыв химических связей всегда требует затрат энергии. Поэтому подавляющее большинство реакций разложения (термическое разложение, электролиз, фотолиз) являются эндотермическими. Например, разложение карбоната кальция (известняка) на оксид кальция и углекислый газ требует сильного нагревания.
Вывод: Суждение верно.
Б. Катализаторы ускоряют химические реакции, но сами при этом не расходуются.
Это фундаментальное свойство катализаторов. Они участвуют в промежуточных стадиях реакции, образуя временные соединения с реагентами, но в конце цикла катализатор регенерируется в своем первоначальном виде. Их роль заключается в предоставлении альтернативного пути реакции с более низкой энергией активации, что позволяет реакции протекать быстрее. Если бы катализаторы расходовались, их пришлось бы постоянно добавлять в больших количествах, что было бы экономически невыгодно.
Вывод: Суждение верно.
Оба суждения верны.
Ответ: 1
Вопрос 4
Проведите домашний эксперимент с картофелем и перекисью водорода.
1. Что наблюдаете?
Наблюдение: При добавлении перекиси водорода (H₂O₂) к кусочку сырой картофелины вы увидите активное выделение многочисленных пузырьков газа, что свидетельствует о протекании бурной химической реакции. Если же вы добавите перекись водорода к кусочку варёной картофелины, выделение пузырьков будет отсутствовать или будет крайне незначительным и медленным.
Ответ: При контакте перекиси с сырой картофелиной началось активное выделение пузырьков газа. С вареной картофелиной пузырьков не наблюдалось.
2. Объясните результаты опыта.
Сырой картофель, как и многие другие живые ткани (например, печень), содержит фермент под названием каталаза. Каталаза — это белковый фермент, который выполняет жизненно важную функцию в живых организмах: он чрезвычайно быстро катализирует разложение токсичного пероксида водорода (H₂O₂), образующегося в процессе метаболизма, на безвредные воду (H₂O) и кислород (O₂). Именно выделяющийся кислород мы наблюдаем в виде пузырьков.
Когда картофель варят, высокая температура вызывает денатурацию белковых молекул каталазы.
Денатурация — это процесс нарушения пространственной (третичной и вторичной) структуры белка, что приводит к потере его биологической активности. Активный центр фермента, отвечающий за связывание с субстратом (H₂O₂) и катализ реакции, разрушается. Поэтому в варёной картофелине каталаза неактивна, и разложение перекиси водорода не происходит или происходит крайне медленно, без видимого выделения газа.
Ответ: Реакция разложения перекиси водорода катализируется ферментом каталазой, входящей в состав сырого картофеля, поэтому наблюдалась реакция разложения. При варке картофеля каталаза и другие ферменты разрушаются, поэтому реакция разложения перекиси не катализируется.
3. Какой газ выделяется? Как это можно доказать?
Газ: В результате каталитического разложения пероксида водорода выделяется кислород (O₂). Уравнение реакции: 2H₂O₂ (каталаза) = 2H₂O + O₂↑.
Доказательство: Кислород — это газ, который поддерживает горение. Чтобы доказать его присутствие, можно использовать тлеющую лучинку. Для этого нужно зажечь деревянную лучинку (или спичку), дать ей погореть несколько секунд, а затем задуть пламя так, чтобы остался тлеющий уголёк. Если поднести эту тлеющую лучинку к месту, где выделяются пузырьки газа (например, прямо над картофелем с перекисью), то лучинка ярко вспыхнет или даже загорится пламенем. Это является классическим качественным тестом на наличие кислорода.
Ответ: При разложении перекиси выделяется кислород: 2H₂O₂ (каталаза) = 2H₂O + O₂↑. Доказательство выделения кислорода: при поднесении к зоне реакции тлеющей лучинки она загорается, потому что кислород поддерживает горение.
Вопрос 5
Применение ферментов в промышленности
1. Пищевая промышленность:
- Амилазы катализируют процесс расщепления крахмала до простых сахаров, что широко используется в технологиях выпечки хлеба для улучшения его структуры и вкуса. Кроме того, амилазы применяются при производстве пива для преобразования крахмала в сахар, необходимый для ферментации, а также в изготовлении фруктовых соков и сиропов для повышения их сладости и улучшения консистенции.
- Протеазы участвуют в гидролизе белков, что играет ключевую роль в производстве сыров, где они способствуют образованию текстуры и вкуса продукта. Также эти ферменты используются для обработки мясной продукции, улучшая её мягкость, и при создании соевого соуса, где они помогают расщеплять белки сои в процессе ферментации.
2. Текстильная промышленность:
Целлюлазы применяются для расщепления целлюлозы, что важно при обработке тканей из льна и хлопка. Эти ферменты используются для отбеливания тканей, удаления ворсинок и придания изделиям гладкости и мягкости, а также для повышения их качества и долговечности.
3. Производство моющих средств:
Протеазы, липазы и амилазы входят в состав современных моющих средств, обеспечивая эффективное удаление загрязнений различного происхождения. Протеазы расщепляют белковые пятна (например, от крови или молока), липазы помогают справляться с жировыми загрязнениями (масла или жиры), амилазы устраняют углеводные пятна (например, от крахмала или пищи).
4. Фармацевтическая промышленность:
Ферменты играют важную роль в производстве лекарственных препаратов. Например, они используются для синтеза инсулина, необходимого людям с сахарным диабетом, а также для получения антибиотиков, которые борются с бактериальными инфекциями. Кроме того, ферменты задействованы в создании противовирусных средств, обеспечивая их эффективность в борьбе с вирусными заболеваниями.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.


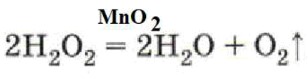
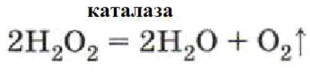



Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!