
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 146-148 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
5.
Часть II
1. Запишите уравнения химических реакций:
1) между алюминием и хлором с образованием хлорида алюминия
___________________________________________________________
2) между углеродом и алюминием с образованием карбида алюминия
___________________________________________________________
3) между оксидом азота (II) и кислородом с образованием оксида азота (IV)
___________________________________________________________
4) между оксидом азота (V) и водой с образованием азотной кислоты
___________________________________________________________
Все указанные реакции являются реакциями _______________
2. Напишите уравнения химических реакций между хлором:
1) и натрием
2) и кальцием
3) и железом с образованием хлорида железа (III)
3. Дайте характеристику реакции
SO₂ + O₂ (V₂O₅) ⇄ SO₃ + Q:
1) по числу и составу исходных веществ и продуктов реакции
2) по тепловому эффекту
3) по направлению протекания
4) по участию катализатора
4. Дайте характеристику реакции
HBr ⇄ H₂ + Br₂ – Q:
1) по числу и составу исходных веществ и продуктов реакции
2) по тепловому эффекту
3) по направлению протекания
4) по участию катализатора
5. Запишите уравнения реакций соединения, протекающих согласно схемам:
1) C → CO → CO₂
2) Ba → BaO → Ba(OH)₂
3) S → SO₂ → SO₃ → H₂SO₄
6. Расставьте коэффициенты в уравнениях реакций, схемы которых:
1) ___ NO₂ + ___ H₂O + ___ O₂ → ___ HNO₃
2) ___ Fe + ___ H₂O + ___ O₂ → ___ Fe(OH)₃
3) ___ HNO₂ → ___ HNO₃ + ___ NO + ___ H₂O
7. Верны ли следующие суждения?
А. Большинство реакций соединения являются экзотермическими.
Б. При повышении температуры скорость химической реакции увеличивается.
1) оба суждения верны
2) верно только А
3) верно только Б
4) оба суждения неверны
8. Рассчитайте объём водорода и массу серы, которые необходимы для образования 85 г сероводорода.
Вопрос 5
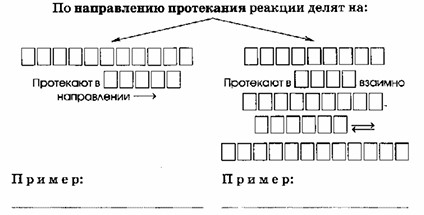
| По направлению протекания реакции делят на: | |
|---|---|
| НЕОБРАТИМЫЕ – протекают в ОДНОМ направлении. Пример: NO₂ + H₂O + O₂ → HNO₃ | ОБРАТИМЫЕ – протекают в ДВУХ взаимно ПРОТИВОПОЛОЖНЫХ НАПРАВЛЕНИЯХ Пример: 2SO₂ + O₂ (t, V₂O₅)⇄ 2SO₃ |
Часть II
Вопрос 1
1. 2Al + 3Cl₂ → 2AlCl₃
2. 4Al + 3C → Al₄C₃
3. 2NO + O₂ → 2NO₂
4. N₂O₅ + H₂O → 2HNO₃
Все указанные реакции являются реакциями СОЕДИНЕНИЯ.
Вопрос 2
1. 2Na + Cl₂ → 2NaCl
2. Ca + Cl₂ → CaCl₂
3. 2Fe + 3Cl₂ → 2FeCl₃
Вопрос 3
2SO₂ + O₂ (V₂O₅) ⇄ 2SO₃ + Q
1) по числу и составу исходных веществ и продуктов реакции: реакция соединения
2) по тепловому эффекту: экзотермическая
3) по направлению протекания: обратимая
4) по участию катализатора: каталитическая
Вопрос 4
2 HBr ⇄ H₂ + Br₂ – Q
1) по числу и составу исходных веществ и продуктов реакции: реакция разложения
2) по тепловому эффекту: эндотермическая
3) по направлению протекания: обратимая
4) по участию катализатора: некаталитическая
Вопрос 5
1) C → CO → CO₂
2C + O₂ → 2CO
2CO + O₂ → 2CO₂
2) Ba → BaO → Ba(OH)₂
2Ba + O₂ → 2BaO
BaO + H₂O → Ba(OH)₂
3) S → SO₂ → SO₃ → H₂SO₄
S + O₂ → SO₂
2SO₂ + O₂ → 2SO₃
SO₃ + H₂O → H₂SO₄
Вопрос 6
1) 4 NO₂ + 2 H₂O + O₂ → 4 HNO₃
2) 4 Fe + 6 H₂O + 3 O₂ → 4 Fe(OH)₃
3) 3 HNO₂ → HNO₃ + 2 NO + H₂O
Вопрос 7
А. Большинство реакций соединения являются экзотермическими.
Верно.
Б. При повышении температуры скорость химической реакции увеличивается.
Верно.
Оба суждения верны.
Ответ: 1.
Вопрос 8
Дано:
m(H₂S) = 85 г
M(H₂S) = 34 г/моль
Vₘ = 22,4 л/моль
M(S) = 32 г/моль
V(H₂) = ?
m(S) = ?
Решение:
H₂ + S → H₂S
n(H₂S) = m / M = 85 / 34 = 2,5 (моль)
По уравнению реакции:
| H₂ | S | H₂S |
|---|---|---|
| x моль | y моль | 2,5 моль |
| 1 молекула | 1 молекула | 1 молекула |
x = y = n(H₂) = n(S) = 2,5 × 1 / 1 = 2,5 (моль)
V(H₂) = n × Vₘ = 2,5 × 22,4 = 56 (л)
m(S) = n × M = 2,5 × 32 = 80 (г)
Ответ: 56 л, 80 г.
Вопрос 5
Классификация химических реакций по направлению протекания.
Химические реакции — это процессы, в ходе которых одни вещества превращаются в другие. Важным аспектом их классификации является возможность обратного превращения продуктов в исходные вещества.
НЕОБРАТИМЫЕ РЕАКЦИИ:
Определение: Это реакции, которые протекают только в одном направлении (от реагентов к продуктам) и практически полностью завершаются. Это означает, что в данных условиях продукты реакции не могут эффективно превратиться обратно в исходные вещества.
Причины необратимости (почему реакция «идет до конца»):
1. Образование нерастворимого осадка: Если один из продуктов реакции является нерастворимым веществом и выпадает в осадок, он выводится из реакционной среды. Это нарушает равновесие и не позволяет обратной реакции протекать.
Пример: \(\mathrm{AgNO_3(aq) + NaCl(aq) \rightarrow AgCl(s)\downarrow + NaNO_3(aq)}\)
2. Выделение газа: Если один из продуктов реакции является газообразным веществом, он улетучивается из реакционной смеси (если реакция протекает в открытой системе). Это также убирает продукт из зоны реакции и препятствует обратному процессу.
Пример: \(\mathrm{Zn(s) + 2HCl(aq) \rightarrow ZnCl_2(aq) + H_2(g)\uparrow}\)
3. Образование малодиссоциирующего вещества (например, воды): В реакциях ионного обмена (например, между кислотой и основанием), если образуется очень слабо диссоциирующее вещество (такое как вода), оно практически не распадается на ионы, что делает реакцию необратимой.
Пример: \(\mathrm{NaOH(aq) + HCl(aq) \rightarrow NaCl(aq) + H_2O(l)}\)
4. Очень высокая энергия активации обратной реакции: В некоторых случаях энергия, необходимая для обратной реакции, настолько велика, что она практически не протекает.
Обозначение: Одинарная стрелка \(\rightarrow\).
Пример: \(\mathrm{NO_2 + H_2O + O_2 \rightarrow HNO_3}\). Эта реакция образования азотной кислоты является необратимой в обычных условиях.
ОБРАТИМЫЕ РЕАКЦИИ:
Определение: Это реакции, которые протекают одновременно в двух взаимно противоположных направлениях – как от исходных веществ к продуктам (прямая реакция), так и от продуктов к исходным веществам (обратная реакция).
Химическое равновесие: В обратимых реакциях система стремится к состоянию химического равновесия. Это динамическое состояние, при котором скорости прямой и обратной реакций становятся равными. В этот момент концентрации всех реагентов и продуктов остаются постоянными, хотя реакции продолжают протекать.
Факторы, влияющие на равновесие (Принцип Ле Шателье): Положение равновесия в обратимых реакциях может быть смещено путем изменения условий:
- Температура: Повышение температуры смещает равновесие в сторону эндотермической реакции, понижение – в сторону экзотермической.
- Давление: Изменение давления влияет на равновесие только в реакциях с участием газов. Повышение давления смещает равновесие в сторону меньшего количества молей газа, понижение – в сторону большего.
- Концентрация: Увеличение концентрации реагентов или уменьшение концентрации продуктов смещает равновесие в сторону прямой реакции. Наоборот – в сторону обратной.
- Катализатор: Катализатор ускоряет как прямую, так и обратную реакции в равной степени, поэтому он не смещает химическое равновесие, а лишь ускоряет его достижение.
Обозначение: Двойная стрелка \(\rightleftharpoons\) или ⇄ .
Пример: 2SO₂ + O₂ (t, V₂O₅)⇄ 2SO₃. Эта реакция является обратимой и лежит в основе промышленного производства серной кислоты. Для получения максимального выхода SO₃ необходимо создавать определенные условия (температура, давление, катализатор), чтобы сместить равновесие вправо.
Часть II
Вопрос 1
Реакции соединения, также известные как реакции синтеза, — это химические процессы, в ходе которых из двух или более исходных веществ (которые могут быть как простыми, так и сложными) образуется одно новое, более сложное вещество. Это похоже на процесс «сборки», где несколько компонентов объединяются в единое целое.
Общая схема: Наиболее общие схемы для реакций соединения выглядят как \(A + B \rightarrow AB\) (где A и B — исходные вещества, а AB — образовавшееся сложное вещество) или \(A + B + C \rightarrow ABC\), если исходных веществ три или более.
Энергетика: Большинство реакций соединения являются экзотермическими. Это означает, что в процессе их протекания выделяется тепловая энергия. Выделение энергии происходит потому, что образование новых химических связей в более сложном продукте обычно приводит к более стабильному, низкоэнергетическому состоянию системы. Когда атомы образуют связи, энергия, запасенная в исходных веществах, высвобождается в виде тепла.
1) Между алюминием и хлором с образованием хлорида алюминия:
Исходные вещества: Алюминий (Al) — это металл, который в химических реакциях обычно отдает электроны. Хлор (Cl₂) — это неметалл, существующий в виде двухатомных молекул в газообразном состоянии, и он является сильным окислителем, то есть склонен принимать электроны.
Продукт: Хлорид алюминия (AlCl₃). Алюминий в своих соединениях чаще всего проявляет степень окисления +3. Хлор, будучи галогеном, в хлоридах имеет степень окисления -1. Для обеспечения электронейтральности соединения, один атом Al (+3) требует три атома Cl (-1).
Уравнение: \(2\mathrm{Al}\ (тв) + 3\mathrm{Cl}_2\ (г) \rightarrow 2\mathrm{AlCl}_3\ (тв)\). Для уравнивания реакции мы начинаем с хлора: справа у нас 3 атома Cl в \(AlCl_3\), а слева 2 атома Cl в \(Cl_2\). Наименьшее общее кратное для 2 и 3 — это 6. Поэтому мы ставим коэффициент 3 перед \(Cl_2\) (чтобы получить 6 атомов Cl) и 2 перед \(AlCl_3\) (чтобы получить 6 атомов Cl). Теперь у нас 2 атома Al справа, поэтому мы ставим коэффициент 2 перед Al слева. Состояние веществ: алюминий — твердое (тв), хлор — газ (г), хлорид алюминия — твердое (тв).
2) Между углеродом и алюминием с образованием карбида алюминия:
Исходные вещества: Углерод (C) и Алюминий (Al). Это реакция непосредственного синтеза карбида.
Продукт: Карбид алюминия (Al₄C₃). Это ионное соединение, где алюминий имеет степень окисления +3, а углерод в карбидах металлов обычно имеет степень окисления -4.
Уравнение: \(4\mathrm{Al}\ (тв) + 3\mathrm{C}\ (тв) \rightarrow \mathrm{Al}_4\mathrm{C}_3\ (тв)\). Для уравнивания, мы видим 4 атома Al и 3 атома C в продукте. Соответственно, ставим коэффициенты 4 перед Al и 3 перед C в левой части уравнения. Оба исходных вещества и продукт находятся в твердом состоянии.
3) Между оксидом азота (II) и кислородом с образованием оксида азота (IV):
Исходные вещества: Оксид азота (II) (NO) — бесцветный газ, и Кислород (O₂) — также газ. Эта реакция является важным этапом в производстве азотной кислоты.
Продукт: Оксид азота (IV) (NO₂) — бурый газ.
Уравнение: \(2\mathrm{NO}\ (г) + \mathrm{O}_2\ (г) \rightarrow 2\mathrm{NO}_2\ (г)\). Для уравнивания, мы видим, что справа у нас 2 атома N и 4 атома O. Слева, если мы поставим 2 перед NO, у нас будет 2 атома N и 2 атома O. Добавив \(O_2\), мы получаем 2 атома N и \(2+2=4\) атома O, что соответствует правой части. Все вещества являются газами.
4) Между оксидом азота (V) и водой с образованием азотной кислоты:
Исходные вещества: Оксид азота (V) (N₂O₅) — кислотный оксид, и Вода (H₂O).
Продукт: Азотная кислота (HNO₃). Это типичная реакция кислотного оксида с водой, в результате которой образуется соответствующая кислота.
Уравнение: \(\mathrm{N}_2\mathrm{O}_5\ (тв) + \mathrm{H}_2\mathrm{O}\ (ж) \rightarrow 2\mathrm{HNO}_3\ (ж)\). Слева у нас 2 атома N, 1 атом H и \(5+1=6\) атомов O. Чтобы уравнять азот, ставим коэффициент 2 перед \(HNO_3\). Теперь справа у нас 2 атома N, 2 атома H и \(2 \times 3 = 6\) атомов O. Это соответствует левой части уравнения. Оксид азота (V) — твердое вещество, вода и азотная кислота — жидкости.
Все указанные реакции являются реакциями СОЕДИНЕНИЯ.
Вопрос 2
Хлор (Cl₂) — это очень активный неметалл, принадлежащий к группе галогенов. Благодаря своей высокой электроотрицательности и стремлению достичь стабильной электронной конфигурации, он является сильным окислителем. Это означает, что в химических реакциях хлор охотно принимает электроны от других атомов, тем самым окисляя их, а сам при этом восстанавливается (его степень окисления понижается, обычно до -1).
Реагирует со многими металлами, образуя соответствующие хлориды. В этих реакциях хлор всегда принимает электроны, переходя в степень окисления -1.
1) И натрием:
Исходные вещества: Натрий (Na) — активный щелочной металл, который легко отдает один электрон, и Хлор (Cl₂).
Продукт: Хлорид натрия (NaCl) — обычная поваренная соль. Натрий в соединениях имеет степень окисления +1, хлор — -1.
Уравнение: \(2\mathrm{Na}\ (тв) + \mathrm{Cl}_2\ (г) \rightarrow 2\mathrm{NaCl}\ (тв)\). Для уравнивания, ставим коэффициент 2 перед Na и NaCl, чтобы уравнять атомы хлора и натрия. Натрий и хлорид натрия — твердые вещества, хлор — газ.
2) И кальцием:
Исходные вещества: Кальций (Ca) — щелочноземельный металл, который обычно отдает два электрона, и Хлор (Cl₂).
Продукт: Хлорид кальция (CaCl₂). Кальций в соединениях имеет степень окисления +2, поэтому для нейтрализации требуется два атома хлора со степенью окисления -1.
Уравнение: \(\mathrm{Ca}\ (тв) + \mathrm{Cl}_2\ (г) \rightarrow \mathrm{CaCl}_2\ (тв)\). Эта реакция уже уравнена. Кальций и хлорид кальция — твердые вещества, хлор — газ.
3) И железом с образованием хлорида железа (III):
Исходные вещества: Железо (Fe) — переходный металл, способный проявлять различные степени окисления (чаще +2 или +3), и Хлор (Cl₂).
Продукт: Хлорид железа (III) (FeCl₃). Важно отметить, что хлор, как сильный окислитель, окисляет железо до его высшей стабильной степени окисления +3, в отличие от, например, соляной кислоты, которая обычно окисляет железо только до +2.
Уравнение: \(2\mathrm{Fe}\ (тв) + 3\mathrm{Cl}_2\ (г) \rightarrow 2\mathrm{FeCl}_3\ (тв)\). Чтобы уравнять хлор, ставим 3 перед \(Cl_2\) и 2 перед \(FeCl_3\) (получаем по 6 атомов хлора с каждой стороны). Затем ставим 2 перед Fe, чтобы уравнять железо. Железо и хлорид железа (III) — твердые вещества, хлор — газ.
Вопрос 3
Уравнение (с учетом стехиометрии): 2SO₂ + O₂ (V₂O₅) ⇄ 2SO₃ + Q. Это реакция окисления диоксида серы до триоксида серы, которая является ключевым этапом в промышленном производстве серной кислоты.
1) По числу и составу исходных веществ и продуктов реакции:
Исходные вещества: Диоксид серы (SO₂) и Кислород (O₂). Оба являются простыми или сложными веществами.
Продукт: Триоксид серы (SO₃). Образуется одно новое, более сложное вещество из двух исходных.
Характеристика: Это реакция соединения (синтеза). Она полностью соответствует определению, так как два вещества объединяются в одно.
2) По тепловому эффекту:
Тепловой эффект: В правой части уравнения указано \(+ Q\). Символ \(+ Q\) означает, что тепловая энергия выделяется в процессе реакции.
Характеристика: Экзотермическая реакция. Это означает, что реакция сопровождается выделением тепла в окружающую среду. Для промышленных процессов это важно, так как выделяющееся тепло может быть использовано, но также требует контроля для предотвращения перегрева.
3) По направлению протекания:
Символ: Использование двойной стрелки \(\rightleftharpoons\) в уравнении. Эта стрелка указывает на то, что реакция может протекать как в прямом направлении (от SO₂ и O₂ к SO₃), так и в обратном направлении (от SO₃ к SO₂ и O₂).
Характеристика: Обратимая реакция. Это означает, что продукты реакции могут взаимодействовать между собой, образуя исходные вещества. Такие реакции стремятся к состоянию химического равновесия, при котором скорости прямой и обратной реакций становятся равными.
4) По участию катализатора:
В данном уравнении над стрелкой указан катализатор — оксид ванадия (V) V₂O₅. Катализатор — это вещество, которое изменяет скорость химической реакции, но само при этом не расходуется и не входит в состав продуктов реакции.
Характеристика: Каталитическая реакция. Катализатор ускоряет как прямую, так и обратную реакции в равной степени. Он не смещает химическое равновесие, но значительно ускоряет его достижение, что критически важно для эффективности промышленного процесса получения серной кислоты.
Вопрос 4
Уравнение (с учетом стехиометрии): \(2\mathrm{HBr}\ (г) \rightleftharpoons \mathrm{H}_2\ (г) + \mathrm{Br}_2\ (г) — Q\). Это реакция разложения бромоводорода на водород и бром.
1) По числу и составу исходных веществ и продуктов реакции:
Исходное вещество: Бромоводород (HBr). Это одно сложное вещество.
Продукты: Водород (H₂) и Бром (Br₂). Из одного сложного вещества образуются два или более простых.
Характеристика: Реакция разложения. Она соответствует определению, так как одно сложное вещество распадается на более простые.
2) По тепловому эффекту:
Тепловой эффект: В правой части уравнения указано \(- Q\). Символ \(- Q\) означает, что тепловая энергия поглощается из окружающей среды в процессе реакции.
Характеристика: Эндотермическая реакция. Это означает, что для протекания реакции требуется постоянный подвод тепла. Продукты реакции имеют более высокую энергетическую энтальпию по сравнению с исходными веществами.
3) По направлению протекания:
Символ: Использование двойной стрелки \(\rightleftharpoons\). Эта стрелка указывает на то, что реакция может протекать как в прямом направлении (разложение HBr), так и в обратном направлении (синтез HBr из H₂ и Br₂).
Характеристика: Обратимая реакция. Система стремится к химическому равновесию, при котором скорости прямого и обратного процессов равны.
4) По участию катализатора:
В данном уравнении катализатор не указан над стрелкой.
Характеристика: Некаталитическая реакция. Это означает, что для ее протекания не требуется специальный катализатор, или, по крайней мере, в данном контексте он не является обязательным компонентом, влияющим на скорость реакции.
Вопрос 5
Реакции соединения (или синтеза) – это химические реакции, в результате которых из двух или более исходных веществ образуется одно новое, более сложное вещество. Для каждой схемы необходимо определить, какие вещества должны прореагировать, чтобы получить указанный продукт, и затем уравнять химическое уравнение, соблюдая закон сохранения массы.
1) С → СО → СО₂
Первое превращение: С → СО
Чтобы из углерода (С) получить оксид углерода(II) (СО), необходимо добавить кислород (О₂). Важно отметить, что для образования СО (неполное сгорание) требуется ограниченное количество кислорода.
Неуравненное уравнение: \( \mathrm{C + O_2 \rightarrow CO} \)
Уравниваем атомы углерода и кислорода:
- Слева 1 атом C, справа 1 атом C.
- Слева 2 атома O, справа 1 атом O. Чтобы уравнять кислород, ставим коэффициент 2 перед СО, тогда справа станет 2 атома C.
- Следовательно, нужно поставить 2 перед С слева.
Уравненное уравнение: \( \mathrm{2C + O_2 \rightarrow 2CO} \)
Второе превращение: СО → СО₂
Чтобы из оксида углерода(II) (СО) получить оксид углерода(IV) (СО₂), необходимо добавить кислород (О₂). Это реакция полного сгорания СО.
Неуравненное уравнение: \( \mathrm{CO + O_2 \rightarrow CO_2} \)
Уравниваем атомы углерода и кислорода:
- Слева 1 атом C, справа 1 атом C.
- Слева 1+2=3 атома O, справа 2 атома O. Чтобы уравнять кислород, ставим коэффициент 2 перед СО₂. Тогда справа станет 2 атома C.
- Следовательно, нужно поставить 2 перед СО слева. Теперь слева 2*1+2=4 атома O, справа 2*2=4 атома O.
Уравненное уравнение: \( \mathrm{2CO + O_2 \rightarrow 2CO_2} \)
2) Ba → BaO → Ba(OH)₂
Первое превращение: Ba → BaO
Чтобы из бария (Ba) получить оксид бария (BaO), необходимо добавить кислород (О₂). Это реакция горения щелочноземельного металла.
Неуравненное уравнение: \( \mathrm{Ba + O_2 \rightarrow BaO} \)
Уравниваем атомы бария и кислорода:
- Слева 2 атома O, справа 1 атом O. Ставим 2 перед BaO.
- Теперь справа 2 атома Ba, слева 1 атом Ba. Ставим 2 перед Ba.
Уравненное уравнение: \( \mathrm{2Ba + O_2 \rightarrow 2BaO} \)
Второе превращение: BaO → Ba(OH)₂
Чтобы из оксида бария (BaO) получить гидроксид бария (Ba(OH)₂), необходимо добавить воду (Н₂О). Оксиды щелочноземельных металлов активно реагируют с водой, образуя соответствующие гидроксиды (основания).
Неуравненное уравнение: \( \mathrm{BaO + H_2O \rightarrow Ba(OH)_2} \)
Уравниваем атомы:
- Ba: 1 слева, 1 справа.
- O: 1+1=2 слева, 2 справа.
- H: 2 слева, 2 справа.
Уравненное уравнение: \( \mathrm{BaO + H_2O \rightarrow Ba(OH)_2} \) (уравнение уже сбалансировано)
3) S → SO₂ → SO₃ → H₂SO₄
Первое превращение: S → SO₂
Чтобы из серы (S) получить оксид серы(IV) (SO₂), необходимо добавить кислород (О₂). Это реакция горения серы.
Неуравненное уравнение: \( \mathrm{S + O_2 \rightarrow SO_2} \)
Уравниваем атомы:
- S: 1 слева, 1 справа.
- O: 2 слева, 2 справа.
Уравненное уравнение: \( \mathrm{S + O_2 \rightarrow SO_2} \) (уравнение уже сбалансировано)
Второе превращение: SO₂ → SO₃
Чтобы из оксида серы(IV) (SO₂) получить оксид серы(VI) (SO₃), необходимо добавить кислород (О₂). Эта реакция является ключевой стадией промышленного производства серной кислоты и протекает в присутствии катализатора (например, V₂O₅) и при нагревании.
Неуравненное уравнение: \( \mathrm{SO_2 + O_2 \rightarrow SO_3} \)
Уравниваем атомы:
- S: 1 слева, 1 справа.
- O: 2+2=4 слева, 3 справа. Чтобы уравнять кислород, ставим 2 перед SO₃, тогда справа 6 атомов O. Ставим 2 перед SO₂, тогда слева 2 атома S.
- Теперь слева 2 атома S, справа 2 атома S. Слева 2*2+2=6 атомов O, справа 2*3=6 атомов O.
Уравненное уравнение: \( \mathrm{2SO_2 + O_2 \rightarrow 2SO_3} \)
Третье превращение: SO₃ → H₂SO₄
Чтобы из оксида серы(VI) (SO₃) получить серную кислоту (H₂SO₄), необходимо добавить воду (Н₂О). Оксид серы(VI) является кислотным оксидом и активно реагирует с водой, образуя соответствующую кислоту.
Неуравненное уравнение: \( \mathrm{SO_3 + H_2O \rightarrow H_2SO_4} \)
Уравниваем атомы:
- S: 1 слева, 1 справа.
- O: 3+1=4 слева, 4 справа.
- H: 2 слева, 2 справа.
Уравненное уравнение: \( \mathrm{SO_3 + H_2O \rightarrow H_2SO_4} \) (уравнение уже сбалансировано)
Вопрос 6
Балансировка химических уравнений основана на законе сохранения массы, который гласит, что атомы не создаются и не исчезают в ходе химической реакции, а лишь перегруппировываются. Цель — добиться, чтобы число атомов каждого элемента было одинаковым в левой (реагенты) и правой (продукты) частях уравнения. Для этого используются стехиометрические коэффициенты — целые числа, ставящиеся перед формулами веществ.
1) __ NO₂ + __ H₂O + __ O₂ → __ HNO₃
Это реакция окисления диоксида азота до азотной кислоты в присутствии воды и кислорода. Это окислительно-восстановительная реакция (ОВР), так как степени окисления изменяются.
Определим степени окисления азота:
- В NO₂: N(+4)
- В HNO₃: N(+5) (азот окисляется)
Определим степени окисления кислорода:
- В O₂: O(0)
- В HNO₃: O(-2) (кислород восстанавливается)
Метод электронного баланса:
- Окисление: \( \mathrm{N^{+4} — 1e^{-} \rightarrow N^{+5}} \)
- Восстановление: \( \mathrm{O_2^0 + 4e^{-} \rightarrow 2O^{-2}} \) (одна молекула O₂ принимает 4 электрона)
Наименьшее общее кратное для 1 и 4 — это 4.
Умножаем первое полуреакцию на 4: \( \mathrm{4N^{+4} — 4e^{-} \rightarrow 4N^{+5}} \)
Вторая полуреакция остается как есть: \( \mathrm{O_2^0 + 4e^{-} \rightarrow 2O^{-2}} \)
Это означает, что 4 молекулы NO₂ будут окисляться, и 1 молекула O₂ будет восстанавливаться.
Подставляем коэффициенты:
\( \mathrm{4NO_2 + H_2O + O_2 \rightarrow 4HNO_3} \)
Проверяем баланс атомов:
- N: Слева 4, справа 4. (Уравнено)
- H: Справа 4. Слева пока 2 (из H₂O). Нужно 4 атома H слева, значит, ставим 2 перед H₂O.
\( \mathrm{4NO_2 + 2H_2O + O_2 \rightarrow 4HNO_3} \) - Проверяем кислород:
Слева: \( 4 \times 2 (\text{из NO}_2) + 2 \times 1 (\text{из H}_2\text{O}) + 2 (\text{из O}_2) = 8 + 2 + 2 = 12 \) атомов O.
Справа: \( 4 \times 3 (\text{из HNO}_3) = 12 \) атомов O. (Уравнено)
Уравненное уравнение: \( \mathrm{4NO_2 + 2H_2O + O_2 \rightarrow 4HNO_3} \)
2) __ Fe + __ H₂O + __ O₂ → __ Fe(OH)₃
Это реакция образования гидроксида железа(III) (ржавление) из железа, воды и кислорода. Это также ОВР.
Определим степени окисления:
- В Fe: Fe(0)
- В Fe(OH)₃: Fe(+3) (железо окисляется)
- В O₂: O(0)
- В Fe(OH)₃: O(-2) (кислород восстанавливается)
Метод электронного баланса:
- Окисление: \( \mathrm{Fe^0 — 3e^{-} \rightarrow Fe^{+3}} \)
- Восстановление: \( \mathrm{O_2^0 + 4e^{-} \rightarrow 2O^{-2}} \)
Наименьшее общее кратное для 3 и 4 — это 12.
- Умножаем первое полуреакцию на 4: \( \mathrm{4Fe^0 — 12e^{-} \rightarrow 4Fe^{+3}} \)
- Умножаем вторую полуреакцию на 3: \( \mathrm{3O_2^0 + 12e^{-} \rightarrow 6O^{-2}} \)
Это означает, что 4 атома Fe будут окисляться, и 3 молекулы O₂ будут восстанавливаться.
Подставляем коэффициенты:
\( \mathrm{4Fe + H_2O + 3O_2 \rightarrow 4Fe(OH)_3} \)
Проверяем баланс атомов:
- Fe: Слева 4, справа 4. (Уравнено)
- H: Справа \( 4 \times 3 = 12 \) атомов H. Слева пока 2 (из H₂O). Нужно 12 атомов H слева, значит, ставим 6 перед H₂O.
\( \mathrm{4Fe + 6H_2O + 3O_2 \rightarrow 4Fe(OH)_3} \) - Проверяем кислород:
Слева: \( 6 \times 1 (\text{из H}_2\text{O}) + 3 \times 2 (\text{из O}_2) = 6 + 6 = 12 \) атомов O.
Справа: \( 4 \times 3 (\text{из Fe(OH)}_3) = 12 \) атомов O. (Уравнено)
Уравненное уравнение: \( \mathrm{4Fe + 6H_2O + 3O_2 \rightarrow 4Fe(OH)_3} \)
3) __ HNO₂ → __ HNO₃ + __ NO + __ H₂O
Это реакция диспропорционирования (самоокисления-самовосстановления) азотистой кислоты.
Азот в HNO₂ имеет степень окисления +3. Он одновременно окисляется до +5 (в HNO₃) и восстанавливается до +2 (в NO).
Определим степени окисления азота:
- В HNO₂: N(+3)
- В HNO₃: N(+5) (окисление)
- В NO: N(+2) (восстановление)
Метод электронного баланса:
- Окисление: \( \mathrm{N^{+3} — 2e^{-} \rightarrow N^{+5}} \)
- Восстановление: \( \mathrm{N^{+3} + 1e^{-} \rightarrow N^{+2}} \)
Чтобы количество отданных электронов равнялось количеству принятых, нужно, чтобы на 1 атом N, который окисляется (теряет 2e⁻), приходилось 2 атома N, которые восстанавливаются (принимают по 1e⁻).
Таким образом, для образования 1 молекулы HNO₃ и 2 молекул NO потребуется 1+2=3 молекулы HNO₂.
Подставляем коэффициенты:
\( \mathrm{3HNO_2 \rightarrow HNO_3 + 2NO + H_2O} \)
Проверяем баланс атомов:
- N: Слева 3, справа 1+2=3. (Уравнено)
- H: Слева 3. Справа 1 (из HNO₃) + 2 (из H₂O) = 3. (Уравнено)
- O: Слева \( 3 \times 2 = 6 \). Справа \( 3 (\text{из HNO}_3) + 2 (\text{из NO}) + 1 (\text{из H}_2\text{O}) = 6 \). (Уравнено)
Уравненное уравнение: \( \mathrm{3HNO_2 \rightarrow HNO_3 + 2NO + H_2O} \)
Вопрос 7
А. Большинство реакций соединения являются экзотермическими.
Экзотермическая реакция – это реакция, которая сопровождается выделением теплоты в окружающую среду (Q > 0).
Реакции соединения – это реакции, в которых из двух или более простых или сложных веществ образуется одно новое, более сложное вещество.
Образование химических связей обычно сопровождается выделением энергии. Когда атомы или молекулы соединяются, они переходят в более стабильное, энергетически выгодное состояние, и избыточная энергия выделяется в виде тепла.
Примеры: горение (соединение с кислородом), образование оксидов, образование солей из оксидов и кислот/оснований. Подавляющее большинство этих реакций являются экзотермическими.
Вывод: Суждение А верно.
Б. При повышении температуры скорость химической реакции увеличивается.
Скорость химической реакции – это изменение концентрации реагентов или продуктов в единицу времени.
Теория столкновений объясняет, что для протекания реакции молекулы реагентов должны столкнуться с достаточной энергией (энергией активации) и правильной ориентацией.
Повышение температуры приводит к увеличению средней кинетической энергии молекул. Это имеет два основных эффекта:
- Увеличение частоты столкновений: Молекулы движутся быстрее, что приводит к большему количеству столкновений в единицу времени.
- Увеличение доли эффективных столкновений: Большая доля молекул будет обладать энергией, достаточной для преодоления энергетического барьера (энергии активации), что приводит к более эффективным столкновениям, которые приводят к образованию продуктов.
Вывод: Суждение Б верно.
Оба суждения верны.
Ответ: 1.
Вопрос 8
Для решения данной задачи нам потребуется использовать основные законы химии: закон сохранения массы и закон Авогадро (для газов), а также понятия молярной массы и количества вещества.
Дано:
- Масса сероводорода: \( \mathrm{m(H_2S) = 85 \text{ г}} \)
- Молярная масса сероводорода: \( \mathrm{M(H_2S) = 34 \text{ г/моль}} \) (рассчитывается как \( \mathrm{2 \times M(H) + M(S) = 2 \times 1 + 32 = 34 \text{ г/моль}} \))
- Молярный объем газа при нормальных условиях: \( \mathrm{V_m = 22.4 \text{ л/моль}} \)
- Молярная масса серы: \( \mathrm{M(S) = 32 \text{ г/моль}} \)
Найти:
- Объем водорода: \( \mathrm{V(H_2) = ?} \)
- Масса серы: \( \mathrm{m(S) = ?} \)
Решение:
1. Запишите химическое уравнение реакции.
Сероводород (H₂S) образуется в результате взаимодействия водорода (H₂) и серы (S).
\( \mathrm{H_2 + S \rightarrow H_2S} \)
Это уравнение уже сбалансировано, так как количество атомов каждого элемента одинаково в левой и правой частях.
2. Рассчитайте количество вещества (моль) сероводорода.
Используем формулу для расчета количества вещества: \( \mathrm{n = m / M} \).
\( \mathrm{n(H_2S) = 85 \text{ г} / 34 \text{ г/моль} = 2.5 \text{ моль}} \)
3. Определите количество водорода и серы, используя стехиометрические соотношения.
Из сбалансированного уравнения реакции \( \mathrm{H_2 + S \rightarrow H_2S} \) видно, что 1 моль водорода реагирует с 1 молем серы, образуя 1 моль сероводорода. Это соотношение 1:1:1.
Мы можем представить это в виде таблицы для наглядности:
| Вещество | H₂ | S | H₂S |
|---|---|---|---|
| Количество (моль) | x моль | y моль | 2.5 моль |
| Коэффициенты (молекулы) | 1 молекула | 1 молекула | 1 молекула |
Из таблицы следует, что количество молей каждого реагента равно количеству молей продукта, поскольку их стехиометрические коэффициенты в уравнении равны единице.
Следовательно:
\( \mathrm{x = n(H_2) = 2.5 \text{ моль}} \)
\( \mathrm{y = n(S) = 2.5 \text{ моль}} \)
4. Рассчитайте объем водорода.
Водород (H₂) — это газ. При нормальных условиях (н.у.) один моль любого газа занимает объем 22.4 литра.
Используем формулу для расчета объема газа: \( \mathrm{V = n \times V_m} \).
\( \mathrm{V(H_2) = 2.5 \text{ моль} \times 22.4 \text{ л/моль} = 56 \text{ л}} \)
5. Рассчитайте массу серы.
Используем формулу для расчета массы вещества: \( \mathrm{m = n \times M} \).
\( \mathrm{m(S) = 2.5 \text{ моль} \times 32 \text{ г/моль} = 80 \text{ г}} \)
Ответ: 56 л, 80 г.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!