
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 165-166 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
7. Растворимость хлорида калия в воде при 60 °C равна 50 г. Определите массовую долю соли в растворе, насыщенном при указанной температуре.
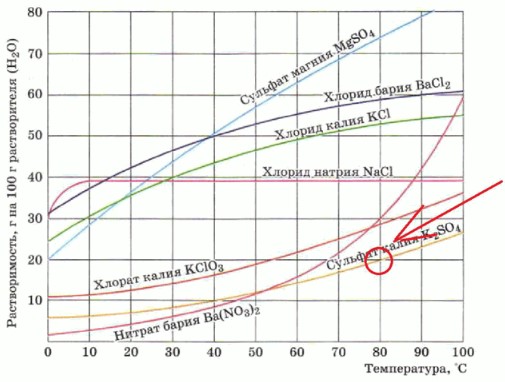
8. По графику (см. рис. 126 в учебнике) определите растворимость сульфата калия при 80 °C. Рассчитайте массовую долю соли в растворе, насыщенном при указанной температуре.
9. Навеску 161 г глауберовой соли Na₂SO₄·10H₂O растворили в 180 г воды. Вычислите массовую долю сульфата натрия в полученном растворе. Сколько ионов каждого вида в нём находится?
10. Заполните таблицу «Научные достижения Д. И. Менделеева и С. Аррениуса».
Вопрос 7
Дано:
m(KCl) = 50 г
m(H₂O) = 100 г
ω(KCl)=?
m(раствора) = m(KCl) + m(H₂O) = 50 + 100 = 150 г
ω(KCl) = m(KCl) / m(раствора) = 50 / 150 = 0,3333 = 33,33%
Ответ. 33,33%.
Вопрос 8
Растворимость сульфата калия 20 г / 100 г воды
Дано:
m(K₂SO₄) = 20 г
m(H₂O) = 100 г
ω(K₂SO₄)=?
m(раствора) = m(K₂SO₄) + m(H₂O) = 20 + 100 = 120 г
ω(K₂SO₄) = m(K₂SO₄) / m(раствора) * 100% = 20 / 120 * 100% = 0,167 * 100% = 16,7%
Ответ. 16,7%.
Вопрос 9
Дано:
\( m(\text{Na}_2\text{SO}_4 \cdot 10\text{H}_2\text{O}) = 161\,\text{г} \)
\( V(\text{H}_2\text{O}) = 180\,\text{л} \)
\( M(\text{Na}_2\text{SO}_4 \cdot 10\text{H}_2\text{O}) = 322\,\text{г/моль} \)
\( M(\text{Na}_2\text{SO}_4) = 142\,\text{г/моль} \)
\( N_A = 6 \cdot 10^{23} \,\text{частиц/моль} \)
\( \omega(\text{Na}_2\text{SO}_4) = ? \)
\( N(\text{SO}_4^{2-}) = ? \)
\( N(\text{Na}^+) = ? \)
\( 180\,\text{л}\, \text{H}_2\text{O} = 180\,000\,\text{г}\, \text{H}_2\text{O} \)
\( m(\text{раствора}) = m(\text{Na}_2\text{SO}_4 \cdot 10\text{H}_2\text{O}) + m(\text{H}_2\text{O}) = 161 + 180\,000 =\)
\(= 180\,161\,\text{г} \)
\( n(\text{Na}_2\text{SO}_4) = n(\text{Na}_2\text{SO}_4 \cdot 10\text{H}_2\text{O}) = \frac{m}{M} = \frac{161}{322} = 0{,}5\,(\text{моль}) \)
\( m(\text{Na}_2\text{SO}_4) = n \cdot M = 0{,}5 \cdot 142 = 71\,(\text{г}) \)
\( \omega(\text{Na}_2\text{SO}_4) = \frac{m(\text{Na}_2\text{SO}_4)}{m(\text{раствора})} = \frac{71}{180\,161} = 0{,}00039 = 0{,}039\% \)
\( n(\text{SO}_4^{2-}) = n(\text{Na}_2\text{SO}_4) = 0{,}5\,\text{моль} \)
\( N(\text{SO}_4^{2-}) = n \cdot N_A = 0{,}5 \cdot 6 \cdot 10^{23} = 3 \cdot 10^{23}\,(\text{ионов}) \)
\( n(\text{Na}^+) = 2n(\text{Na}_2\text{SO}_4) = 1\,\text{моль} \)
\( N(\text{Na}^+) = n \cdot N_A = 1 \cdot 6 \cdot 10^{23} = 6 \cdot 10^{23}\,(\text{ионов}) \)
Ответ. 0,039%, \( 3 \cdot 10^{23} \) ионов, \( 6 \cdot 10^{23} \) ионов.
Вопрос 10
| Портрет ученого | Имя ученого | Точка зрения на растворы и растворение | Другие научные достижения |
|---|---|---|---|
 | Д.И. Менделеев | Растворение представляет собой процесс химического взаимодействия между молекулами воды и веществом, которое растворяется. | Открытие Периодического закона |
 | С.А. Аррениус | Растворение является следствием диффузии, то есть процесса, при котором растворяемое вещество проникает в пространства между молекулами воды. | Создание теории электролитической диссоциации |
Вопрос 7
Условие:
Растворимость хлорида калия (KCl) в воде при 60 °C равна 50 г. Определите массовую долю соли в растворе, насыщенном при указанной температуре.
Дано:
Растворимость KCl при 60 °C = 50 г (это означает, что в 100 г воды растворяется 50 г KCl).
Найти:
Массовая доля \(\omega(\text{KCl}) = ?\)
Решение:
Массовая доля вещества в растворе (\(\omega\)) определяется как отношение массы растворенного вещества к общей массе раствора, умноженное на 100%.
Формула:
\(\omega = \frac{\text{масса растворенного вещества}}{\text{масса раствора}} \times 100\%\)
1. Определяем массы компонентов насыщенного раствора:
Масса растворенного вещества (KCl) = 50 г (по определению растворимости).
Масса растворителя (воды) = 100 г (по определению растворимости).
2. Рассчитываем массу насыщенного раствора:
\(\text{Масса раствора} = \text{масса растворенного вещества} + \text{масса растворителя}\)
\(\text{Масса раствора} = 50\,\text{г (KCl)} + 100\,\text{г (H}_2\text{O)} = 150\,\text{г}\)
3. Вычисляем массовую долю хлорида калия в растворе:
\(\omega(\text{KCl}) = \frac{50\,\text{г}}{150\,\text{г}} \times 100\% \approx 0{,}3333 \times 100\% \approx 33{,}33\%\)
Ответ:
Массовая доля хлорида калия в насыщенном растворе при 60 °C составляет приблизительно 33,33%.
Вопрос 8
Условие:
По графику (см. рис. 126 в учебнике) определите растворимость сульфата калия (K₂SO₄) при 80 °C. Рассчитайте массовую долю соли в растворе, насыщенном при указанной температуре.
Дано:
График зависимости растворимости от температуры (рис. 126).
Температура = 80 °C.
Найти:
Растворимость K₂SO₄ при 80 °C.
Массовая доля \(\omega(\text{K}_2\text{SO}_4) = ?\)
Решение:
1. Определяем растворимость K₂SO₄ по графику:
- Найдите на оси абсцисс (горизонтальной оси) значение температуры 80 °C.
- Поднимитесь вертикально вверх от этой точки до пересечения с кривой, соответствующей сульфату калия (K₂SO₄). На графике эта кривая обычно помечена как «Сульфат калия K₂SO₄».
- От точки пересечения проведите горизонтальную линию влево до оси ординат (вертикальной оси), которая показывает растворимость (г на 100 г растворителя).
- По графику видно, что при 80 °C растворимость K₂SO₄ составляет примерно 20 г (это означает, что в 100 г воды растворяется 20 г K₂SO₄).
2. Определяем массы компонентов насыщенного раствора:
Масса растворенного вещества (K₂SO₄) = 20 г.
Масса растворителя (воды) = 100 г.
3. Рассчитываем массу насыщенного раствора:
\(\text{Масса раствора} = \text{масса растворенного вещества} + \text{масса растворителя}\)
\(\text{Масса раствора} = 20\,\text{г (K}_2\text{SO}_4) + 100\,\text{г (H}_2\text{O)} = 120\,\text{г}\)
4. Вычисляем массовую долю сульфата калия в растворе:
\(\omega(\text{K}_2\text{SO}_4) = \frac{20\,\text{г}}{120\,\text{г}} \times 100\% \approx 0{,}1667 \times 100\% \approx 16{,}67\%\)
Ответ:
Растворимость сульфата калия при 80 °C составляет 20 г на 100 г воды. Массовая доля сульфата калия в насыщенном растворе при 80 °C составляет приблизительно 16,7%.
Вопрос 9
Условие:
Навеску 161 г глауберовой соли Na₂SO₄·10H₂O растворили в 180 л воды. Вычислите массовую долю сульфата натрия в полученном растворе. Сколько ионов каждого вида в нём находится?
Дано:
Масса глауберовой соли \(m(\text{Na}_2\text{SO}_4 \cdot 10\text{H}_2\text{O}) = 161\,\text{г}\)
Объем воды \(V(\text{H}_2\text{O}) = 180\,\text{л}\)
Молярная масса глауберовой соли \(M(\text{Na}_2\text{SO}_4 \cdot 10\text{H}_2\text{O}) = 322\,\text{г/моль}\)
Молярная масса безводного сульфата натрия \(M(\text{Na}_2\text{SO}_4) = 142\,\text{г/моль}\)
Число Авогадро \(N_A = 6 \cdot 10^{23}\) частиц/моль
Найти:
Массовая доля \(\omega(\text{Na}_2\text{SO}_4) = ?\)
Число ионов \(\text{SO}_4^{2-}\) (\(N(\text{SO}_4^{2-})\)) = ?
Число ионов \(\text{Na}^+\) (\(N(\text{Na}^+)\)) = ?
Решение:
1. Переводим объем воды в массу:
Плотность воды ≈ 1 г/мл или 1 кг/л.
\(m(\text{H}_2\text{O}) = 180\,\text{л} \times 1000\,\text{г/л} = 180\,000\,\text{г}\)
2. Рассчитываем общую массу раствора:
\(\text{Масса раствора} = \text{масса глауберовой соли} + \text{масса воды}\)
\(\text{Масса раствора} = 161\,\text{г} + 180\,000\,\text{г} = 180\,161\,\text{г}\)
3. Определяем количество вещества (моль) глауберовой соли:
\(n(\text{Na}_2\text{SO}_4 \cdot 10\text{H}_2\text{O}) = \frac{m(\text{Na}_2\text{SO}_4 \cdot 10\text{H}_2\text{O})}{M(\text{Na}_2\text{SO}_4 \cdot 10\text{H}_2\text{O})}\)
\(n(\text{Na}_2\text{SO}_4 \cdot 10\text{H}_2\text{O}) = \frac{161}{322} = 0{,}5\,\text{моль}\)
4. Определяем количество вещества (моль) и массу безводного сульфата натрия (\(\text{Na}_2\text{SO}_4\)):
Поскольку 1 моль \(\text{Na}_2\text{SO}_4 \cdot 10\text{H}_2\text{O}\) содержит 1 моль \(\text{Na}_2\text{SO}_4\), то:
\(n(\text{Na}_2\text{SO}_4) = n(\text{Na}_2\text{SO}_4 \cdot 10\text{H}_2\text{O}) = 0{,}5\,\text{моль}\)
\(m(\text{Na}_2\text{SO}_4) = n(\text{Na}_2\text{SO}_4) \times M(\text{Na}_2\text{SO}_4) = 0{,}5 \times 142 = 71\,\text{г}\)
5. Вычисляем массовую долю сульфата натрия в растворе:
\(\omega(\text{Na}_2\text{SO}_4) = \frac{71}{180\,161} \times 100\% \approx 0{,}000394 \times 100\% \approx 0{,}039\%\)
6. Вычисляем количество ионов каждого вида:
При растворении сульфат натрия диссоциирует в воде по уравнению:
\(\text{Na}_2\text{SO}_4 \rightarrow 2\text{Na}^+ + \text{SO}_4^{2-}\)
Из уравнения видно, что 1 моль \(\text{Na}_2\text{SO}_4\) образует 2 моль ионов \(\text{Na}^+\) и 1 моль ионов \(\text{SO}_4^{2-}\).
Для ионов \(\text{SO}_4^{2-}\):
\(n(\text{SO}_4^{2-}) = n(\text{Na}_2\text{SO}_4) = 0{,}5\,\text{моль}\)
\(N(\text{SO}_4^{2-}) = n(\text{SO}_4^{2-}) \times N_A = 0{,}5 \times 6 \cdot 10^{23} = 3 \cdot 10^{23}\,\text{ионов}\)
Для ионов \(\text{Na}^+\):
\(n(\text{Na}^+) = 2 \times n(\text{Na}_2\text{SO}_4) = 1\,\text{моль}\)
\(N(\text{Na}^+) = n(\text{Na}^+) \times N_A = 1 \times 6 \cdot 10^{23} = 6 \cdot 10^{23}\,\text{ионов}\)
Ответ:
Массовая доля сульфата натрия в полученном растворе составляет приблизительно 0,039%.
В растворе содержится \(3 \cdot 10^{23}\) ионов \(\text{SO}_4^{2-}\) и \(6 \cdot 10^{23}\) ионов \(\text{Na}^+\).
Вопрос 10
Вопрос 10 требует заполнить таблицу, сравнивая двух выдающихся ученых – Дмитрия Ивановича Менделеева и Сванте Аррениуса – по их взглядам на растворы и растворение, а также по другим значимым научным достижениям. Понимание их разных подходов к растворам является ключевым для химии.
1. Д.И. Менделеев
Точка зрения на растворы и растворение:
Химическая теория растворов: Менделеев был сторонником химической теории растворов. Он утверждал, что растворение – это не просто физический процесс равномерного распределения частиц одного вещества в другом (как, например, растворение сахара в воде, которое можно было бы объяснить только диффузией). Вместо этого, Менделеев полагал, что при растворении происходит химическое взаимодействие между растворяемым веществом и молекулами растворителя (в случае воды – это образование гидратов).
Суть теории: По его мнению, молекулы растворенного вещества образуют непрочные, но химически связанные соединения с молекулами воды. Эти соединения (гидраты) находятся в растворе в динамическом равновесии, постоянно образуясь и распадаясь.
Доказательства: Менделеев приводил в качестве доказательств своей теории такие явления, как изменение объёма раствора при растворении (объём раствора не всегда равен сумме объёмов компонентов), выделение или поглощение тепла при растворении (тепловые эффекты), а также изменение других физических свойств раствора (например, плотности, вязкости), которые нельзя объяснить простым физическим смешиванием. Например, сильное выделение тепла при растворении серной кислоты в воде является ярким подтверждением химического взаимодействия.
Другие научные достижения:
Открытие Периодического закона химических элементов: Это самое известное и фундаментальное достижение Менделеева. В 1869 году он сформулировал закон, который устанавливает периодическую зависимость свойств химических элементов от их атомных масс (позднее было уточнено – от порядкового номера).
Создание Периодической системы элементов: На основе своего закона Менделеев разработал таблицу, которая систематизировала все известные на тот момент химические элементы. Главная особенность его таблицы заключалась в том, что он оставил пустые места для ещё не открытых элементов и смог с удивительной точностью предсказать их свойства (например, галлия, скандия, германия). Это предсказание и последующее открытие этих элементов стало триумфальным подтверждением его закона.
Вклад в метрологию, нефтяную промышленность, сельское хозяйство и другие области.
2. С.А. Аррениус
Точка зрения на растворы и растворение:
Физическая теория растворов (Теория электролитической диссоциации): В отличие от Менделеева, шведский ученый Сванте Аррениус изначально сосредоточился на объяснении электропроводности растворов. Он предложил, что растворение электролитов (кислот, оснований, солей) в воде приводит к их распаду на электрически заряженные частицы – ионы. Этот процесс он назвал электролитической диссоциацией.
Суть теории: По Аррениусу, молекулы электролита, попадая в полярный растворитель (например, воду), распадаются на положительно и отрицательно заряженные ионы, которые свободно перемещаются в растворе. Именно эти свободные ионы обеспечивают электропроводность раствора. В его ранних работах акцент был на том, что растворение – это физический процесс, при котором частицы растворенного вещества просто «проникают» в промежутки между молекулами воды, а затем уже происходит диссоциация. Однако, основное его достижение в этой области – это именно теория диссоциации.
Исторический контекст: Теория Аррениуса была революционной и поначалу встретила сопротивление, так как идея о свободных ионах в растворе казалась непривычной. Однако, она блестяще объяснила многие экспериментальные факты, такие как аномальное понижение температуры замерзания и повышение температуры кипения растворов электролитов, а также их электропроводность.
Другие научные достижения:
Создание теории электролитической диссоциации: Это его главное достижение, за которое он получил Нобелевскую премию по химии в 1903 году. Эта теория стала основой для понимания поведения кислот, оснований и солей в растворах.
Определение кислот и оснований (по Аррениусу): На основе своей теории диссоциации Аррениус дал одно из первых определений кислот и оснований: кислоты – это вещества, которые при диссоциации в воде образуют ионы водорода (H⁺), а основания – вещества, которые образуют гидроксид-ионы (OH⁻).
Изучение скорости химических реакций (кинетика): Аррениус также внес значительный вклад в химическую кинетику, сформулировав уравнение Аррениуса, которое описывает зависимость константы скорости химической реакции от температуры и энергии активации.
Работы по влиянию углекислого газа на температуру Земли: Он был одним из первых, кто исследовал, как изменение концентрации CO₂ в атмосфере может влиять на глобальную температуру, предвосхитив теорию парникового эффекта.
Синтез взглядов:
Важно понимать, что современная химия растворов является синтезом идей Менделеева и Аррениуса. Растворение – это сложный процесс, который включает в себя как физические явления (диффузия, равномерное распределение частиц), так и химические взаимодействия (образование гидратов/сольватов) и, для электролитов, диссоциацию на ионы. Обе теории были прорывом для своего времени и заложили основы для дальнейшего развития химии.
Таким образом, таблица, заполненная в ответе, кратко и точно отражает эти ключевые моменты.
| Портрет ученого | Имя ученого | Точка зрения на растворы и растворение | Другие научные достижения |
|---|---|---|---|
 | Д.И. Менделеев | Растворение представляет собой процесс химического взаимодействия между молекулами воды и веществом, которое растворяется. | Открытие Периодического закона |
 | С.А. Аррениус | Растворение является следствием диффузии, то есть процесса, при котором растворяемое вещество проникает в пространства между молекулами воды. | Создание теории электролитической диссоциации |

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.






Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!