
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 174-176 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
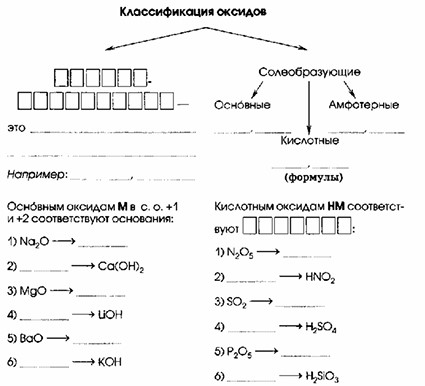
2. Классификация оксидов
3. Химические свойства основных и кислотных оксидов.
Часть II
1. Основание образуется при взаимодействии с водой оксида, формула которого:
1) Fe₂O₃
2) CuO
3) CaO
4) FeO
Ответ.
Запишите уравнение реакции.
2. С гидроксидом натрия реагирует:
1) CaO
2) N₂O
3) SiO₂
4) P₂O₅
Ответ.
Составьте уравнения возможных реакций.
1) молекулярное уравнение
__________________________________________________
полное ионное уравнение
__________________________________________________
сокращённое ионное уравнение
__________________________________________________
2) молекулярное уравнение
__________________________________________________
полное ионное уравнение
__________________________________________________
сокращённое ионное уравнение
__________________________________________________
3. С соляной кислотой реагирует:
1) оксид железа (III)
2) оксид серы (VI)
3) оксид кремния (IV)
4) оксид меди (II)
Ответ.
__________________________________________________
Составьте уравнения возможных реакций.
1) молекулярное уравнение
__________________________________________________
полное ионное уравнение
__________________________________________________
сокращённое ионное уравнение
__________________________________________________
2) молекулярное уравнение
__________________________________________________
полное ионное уравнение
__________________________________________________
сокращённое ионное уравнение
__________________________________________________
Вопрос 2
Основным оксидам М в с.о. +1 и +2 соответствуют основания:
1) Na₂O → NaOH
2) CaO → Ca(OH)₂
3) MgO → Mg(OH)₂
4) Li₂O → LiOH
5) BaO → Ba(OH)₂
6) K₂O → KOH
Кислотным оксидам НМ соответствуют КИСЛОТЫ:
1) N₂O₅ → HNO₃
2) N₂O₃ → HNO₂
3) SO₂ → H₂SO₃
4) SO₃ → H₂SO₄
5) P₂O₅ → H₃PO₄
6) SiO₂ → H₂SiO₃
Вопрос 3
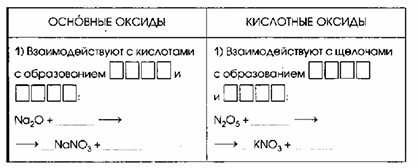
| Основные оксиды | Кислотные оксиды |
|---|---|
| Взаимодействуют с кислотами с образованием СОЛИ и ВОДЫ Na₂O + 2HNO₃ → 2NaNO₃ + H₂O Na₂O + 2H⁺ + 2NO₃⁻ → 2Na⁺ + 2NO₃⁻ + H₂O Na₂O + 2H⁺ → 2Na⁺ + H₂O | Взаимодействуют с щелочами с образованием СОЛИ и ВОДЫ N₂O₅ + 2KOH → 2KNO₃ + H₂O N₂O₅ + 2K⁺ + 2OH⁻ → 2K⁺ + 2NO₃⁻ + H₂O N₂O₅ + 2OH⁻ → 2NO₃⁻ + H₂O |
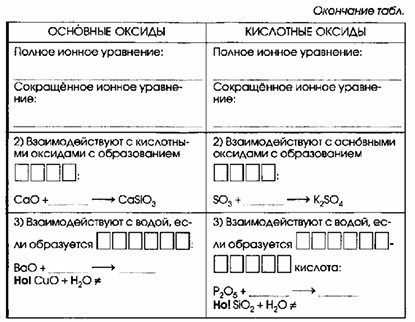
| Взаимодействуют с кислотными оксидами с образованием СОЛИ: CaO + SiO₂ → CaSiO₃ | Взаимодействуют с основными оксидами с образованием СОЛИ: SO₃ + K₂O → K₂SO₄ |
| Взаимодействуют с водой, если образуется щелочь: BaO + H₂O → Ba(OH)₂ | Взаимодействуют с водой, если образуется растворимая кислота: P₂O₅ + 3H₂O → 2H₃PO₄ |
Часть II
Вопрос 1
CaO + H₂O → Ca(OH)₂
Ответ: 3
Вопрос 2
Ответ: 3, 4.
6NaOH + P₂O₅ → 2Na₃PO₄ + 3H₂O
6Na⁺ + 6OH⁻ + P₂O₅ → 6Na⁺ + 2PO₄³⁻ + 3H₂O
6OH⁻ + P₂O₅ → 2PO₄³⁻ + 3H₂O
2NaOH + SiO₂ → Na₂SiO₃ + H₂O
2Na⁺ + 2OH⁻ + SiO₂ → 2Na⁺ + SiO₃²⁻ + H₂O
2OH⁻ + SiO₂ → SiO₃²⁻ + H₂O
Вопрос 3
Ответ: 1, 4.
6HCl + Fe₂O₃ → 2FeCl₃ + 3H₂O
6H⁺ + 6Cl⁻ + Fe₂O₃ → 2Fe³⁺ + 6Cl⁻ + 3H₂O
6H⁺ + Fe₂O₃ → 2Fe³⁺ + 3H₂O
CuO + 2HCl → CuCl₂ + H₂O
2H⁺ + 2Cl⁻ + CuO → Cu²⁺ + 2Cl⁻ + H₂O
2H⁺ + CuO → Cu²⁺ + H₂O
Вопрос 2
Оксиды можно классифицировать по их химическим свойствам и способности образовывать соли.
Выделяют две основные группы:
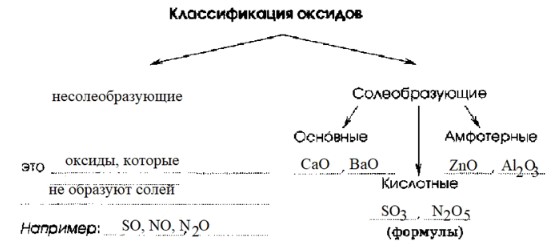
1. Несолеобразующие оксиды:
Определение: Это оксиды, которые не образуют солей при взаимодействии с кислотами, щелочами или водой. Они не проявляют ни кислотных, ни основных свойств в реакциях солеобразования. Их химическая природа часто считается «нейтральной» в контексте кислотно-основных реакций.
Примеры:
- SO (оксид серы(II))
- NO (оксид азота(II), оксид азота)
- N₂O (оксид азота(I), веселящий газ)
2. Солеобразующие оксиды:
Определение: Это оксиды, которые способны образовывать соли при взаимодействии с соответствующими реагентами (кислотами, основаниями или другими оксидами). Эта группа, в свою очередь, делится на три подгруппы:
Основные оксиды:
Определение: Это оксиды металлов, которым соответствуют основания (гидроксиды металлов). Как правило, это оксиды металлов в низших степенях окисления (+1, +2), например, оксиды щелочных и щелочноземельных металлов. Они проявляют основные свойства.
Примеры:
- CaO (оксид кальция)
- BaO (оксид бария)
- Na₂O (оксид натрия)
- K₂O (оксид калия)
- MgO (оксид магния)
Амфотерные оксиды:
Определение: Это оксиды, которые проявляют как кислотные, так и основные свойства, в зависимости от условий реакции и природы реагента. Они могут реагировать как с сильными кислотами (проявляя основные свойства), так и с сильными щелочами (проявляя кислотные свойства), образуя соли.
Примеры:
- ZnO (оксид цинка)
- Al₂O₃ (оксид алюминия)
- Cr₂O₃ (оксид хрома(III))
- PbO (оксид свинца(II))
- SnO₂ (оксид олова(IV))
Кислотные оксиды:
Определение: Это оксиды неметаллов или оксиды металлов в высоких степенях окисления (обычно +5, +6, +7), которым соответствуют кислоты. Они проявляют кислотные свойства.
Примеры:
- SO₃ (оксид серы(VI))
- N₂O₅ (оксид азота(V))
- CO₂ (оксид углерода(IV))
- P₂O₅ (оксид фосфора(V))
- SiO₂ (оксид кремния(IV))
- CrO₃ (оксид хрома(VI) – пример кислотного оксида металла в высокой степени окисления)
Соответствие оксидов гидроксидам (основаниям) и кислотам:
Каждому солеобразующему оксиду (за исключением некоторых амфотерных и кремниевой кислоты) соответствует определенный гидроксид (основание или кислота), который можно получить при взаимодействии оксида с водой (если реакция идет).
Основным оксидам металлов в степени окисления +1 и +2 соответствуют основания:
1. Na₂O (оксид натрия) → NaOH (гидроксид натрия)
2. CaO (оксид кальция) → Ca(OH)₂ (гидроксид кальция)
3. MgO (оксид магния) → Mg(OH)₂ (гидроксид магния)
4. Li₂O (оксид лития) → LiOH (гидроксид лития)
5. BaO (оксид бария) → Ba(OH)₂ (гидроксид бария)
6. K₂O (оксид калия) → KOH (гидроксид калия)
Кислотным оксидам неметаллов (или металлов в высокой степени окисления) соответствуют КИСЛОТЫ:
1. N₂O₅ (оксид азота(V)) → HNO₃ (азотная кислота)
2. N₂O₃ (оксид азота(III)) → HNO₂ (азотистая кислота)
3. SO₂ (оксид серы(IV)) → H₂SO₃ (сернистая кислота)
4. SO₃ (оксид серы(VI)) → H₂SO₄ (серная кислота)
5. P₂O₅ (оксид фосфора(V)) → H₃PO₄ (фосфорная кислота)
6. SiO₂ (оксид кремния(IV)) → H₂SiO₃ (кремниевая кислота)
Примечание: SiO₂ не реагирует с водой напрямую, но H₂SiO₃ является соответствующей кислотой.
Вопрос 3
Химические свойства оксидов определяются их принадлежностью к определенному классу. Понимание этих свойств критически важно для прогнозирования химических реакций.
Основные оксиды
Основные оксиды – это, как правило, оксиды металлов с низкой степенью окисления (+1, +2), которым соответствуют основания. Они проявляют основные свойства, то есть способны реагировать с кислотами или кислотными оксидами.
1. Взаимодействие с кислотами:
Принцип: Основные оксиды реагируют с кислотами, образуя соль и воду. Это классическая реакция нейтрализации, где основный оксид действует как основание.
Пример: Оксид натрия (Na₂O) – это типичный основной оксид, а азотная кислота (HNO₃) – сильная кислота.
Молекулярное уравнение:
Na₂O(тв) + 2HNO₃(р-р) → 2NaNO₃(р-р) + H₂O(ж)
Объяснение: Твердый оксид натрия реагирует с раствором азотной кислоты, образуя растворимую соль нитрат натрия и воду.
Полное ионное уравнение:
Na₂O(тв) + 2H⁺(р-р) + 2NO₃⁻(р-р) → 2Na⁺(р-р) + 2NO₃⁻(р-р) + H₂O(ж)
Объяснение: В полном ионном уравнении мы записываем все сильные электролиты (растворимые соли, сильные кислоты, сильные основания) в виде ионов. Na₂O – это твердый оксид, который не диссоциирует в растворе, поэтому он записывается в молекулярной форме. Азотная кислота (HNO₃) – сильная кислота, полностью диссоциирует на ионы H⁺ и NO₃⁻. Нитрат натрия (NaNO₃) – растворимая соль, полностью диссоциирует на ионы Na⁺ и NO₃⁻. Вода (H₂O) – слабый электролит, записывается в молекулярной форме.
Сокращенное ионное уравнение:
Na₂O(тв) + 2H⁺(р-р) → 2Na⁺(р-р) + H₂O(ж)
Объяснение: Сокращенное ионное уравнение получается путем удаления «ионов-зрителей» (тех ионов, которые не участвуют в химической реакции и остаются неизменными по обе стороны уравнения). В данном случае, ион NO₃⁻ является ионом-зрителем. Это уравнение показывает, что суть реакции заключается во взаимодействии оксида натрия с ионами водорода (протонами) из кислоты.
2. Взаимодействие с кислотными оксидами:
Принцип: Основные оксиды реагируют с кислотными оксидами, образуя соль. Эта реакция часто происходит при нагревании и является примером образования соли из двух оксидов.
Пример: Оксид кальция (CaO) – основной оксид, оксид кремния(IV) (SiO₂) – кислотный оксид.
Молекулярное уравнение:
CaO(тв) + SiO₂(тв) → CaSiO₃(тв)
Объяснение: При нагревании оксид кальция реагирует с твердым оксидом кремния, образуя силикат кальция. Это реакция, характерная для производства стекла и цемента. Ионные уравнения для таких реакций обычно не записывают, так как все реагенты и продукты являются твердыми веществами и не диссоциируют в растворе.
3. Взаимодействие с водой:
Принцип: Некоторые основные оксиды (особенно оксиды щелочных и щелочноземельных металлов) реагируют с водой, образуя щелочи (растворимые основания).
Пример: Оксид бария (BaO) – основной оксид.
Молекулярное уравнение:
BaO(тв) + H₂O(ж) → Ba(OH)₂(р-р)
Объяснение: Оксид бария активно реагирует с водой, образуя гидроксид бария, который является растворимым основанием (щелочью).
Важное примечание: Не все основные оксиды реагируют с водой. Например, оксиды железа (Fe₂O₃, FeO) или оксид меди (CuO) не реагируют с водой, потому что соответствующие им гидроксиды (Fe(OH)₃, Fe(OH)₂, Cu(OH)₂) являются нерастворимыми и не могут быть получены таким способом.
Кислотные оксиды
Кислотные оксиды – это, как правило, оксиды неметаллов или оксиды металлов в высоких степенях окисления (+5, +6, +7), которым соответствуют кислоты. Они проявляют кислотные свойства, то есть способны реагировать с основаниями или основными оксидами.
1. Взаимодействие с щелочами:
Принцип: Кислотные оксиды реагируют с щелочами (растворимыми основаниями), образуя соль и воду. Это также реакция нейтрализации, где кислотный оксид действует как кислота.
Пример: Оксид азота(V) (N₂O₅) – кислотный оксид, гидроксид калия (KOH) – щелочь.
Молекулярное уравнение:
N₂O₅(г) + 2KOH(р-р) → 2KNO₃(р-р) + H₂O(ж)
Объяснение: Газообразный оксид азота(V) реагирует с раствором гидроксида калия, образуя растворимую соль нитрат калия и воду.
Полное ионное уравнение:
N₂O₅(г) + 2K⁺(р-р) + 2OH⁻(р-р) → 2K⁺(р-р) + 2NO₃⁻(р-р) + H₂O(ж)
Объяснение: N₂O₅ – это газообразный оксид, который не диссоциирует. KOH – сильное основание, диссоциирует на K⁺ и OH⁻. KNO₃ – растворимая соль, диссоциирует на K⁺ и NO₃⁻. Вода – слабый электролит.
Сокращенное ионное уравнение:
N₂O₅(г) + 2OH⁻(р-р) → 2NO₃⁻(р-р) + H₂O(ж)
Объяснение: Ион K⁺ является ионом-зрителем. Это уравнение показывает, что оксид азота(V) реагирует с гидроксид-ионами.
2. Взаимодействие с основными оксидами:
Принцип: Кислотные оксиды реагируют с основными оксидами, образуя соль.
Пример: Оксид серы(VI) (SO₃) – кислотный оксид, оксид калия (K₂O) – основной оксид.
Молекулярное уравнение:
SO₃(г) + K₂O(тв) → K₂SO₄(тв)
Объяснение: Газообразный оксид серы(VI) реагирует с твердым оксидом калия, образуя сульфат калия. Ионные уравнения для таких реакций обычно не записывают, так как реагенты и продукты могут быть твердыми веществами.
3. Взаимодействие с водой:
Принцип: Многие кислотные оксиды реагируют с водой, образуя кислоты.
Пример: Оксид фосфора(V) (P₂O₅) – кислотный оксид.
Молекулярное уравнение:
P₂O₅(тв) + 3H₂O(ж) → 2H₃PO₄(р-р)
Объяснение: Твердый оксид фосфора(V) активно реагирует с водой, образуя фосфорную кислоту.
Важное примечание: Не все кислотные оксиды реагируют с водой. Например, оксид кремния(IV) (SiO₂) не реагирует с водой напрямую, хотя ему соответствует кремниевая кислота (H₂SiO₃).
Часть II
Вопрос 1
Основание образуется при взаимодействии с водой оксида, формула которого:
1) Fe₂O₃
2) CuO
3) CaO
4) FeO
Ответ: 3) CaO
Чтобы при взаимодействии оксида с водой образовалось основание, оксид должен быть основным и, что очень важно, соответствующее ему основание должно быть растворимым или малорастворимым в воде (т.е. способным образовываться в водной среде).
Рассмотрим каждый вариант:
1) Fe₂O₃ (оксид железа(III)): Это основной оксид, но соответствующий ему гидроксид Fe(OH)₃ является нерастворимым в воде. Поэтому Fe₂O₃ не реагирует с водой с образованием Fe(OH)₃.
2) CuO (оксид меди(II)): Это основной оксид. Соответствующий ему гидроксид Cu(OH)₂ также нерастворим в воде. Поэтому CuO не реагирует с водой.
3) CaO (оксид кальция): Это основной оксид. Соответствующий ему гидроксид Ca(OH)₂ (гидроксид кальция, или гашеная известь) является малорастворимым основанием (щелочью). CaO активно реагирует с водой, выделяя тепло.
Уравнение реакции:
CaO(тв) + H₂O(ж) → Ca(OH)₂(р-р)
Объяснение: Эта реакция называется «гашением извести». Образуется раствор, который является основанием.
4) FeO (оксид железа(II)): Это основной оксид. Соответствующий ему гидроксид Fe(OH)₂ является нерастворимым в воде. Поэтому FeO не реагирует с водой.
Таким образом, только CaO образует основание при взаимодействии с водой.
Вопрос 2
С гидроксидом натрия реагирует:
1) CaO
2) N₂O
3) SiO₂
4) P₂O₅
Ответ: 3) SiO₂ и 4) P₂O₅
Гидроксид натрия (NaOH) – это сильное основание, часто называемое щелочью, поскольку он хорошо растворим в воде и полностью диссоциирует на ионы Na⁺ и OH⁻. В химии действует общее правило: основания реагируют с кислотами или кислотными оксидами. Это реакции нейтрализации, в результате которых обычно образуется соль и вода.
Рассмотрим каждый из предложенных оксидов:
1) CaO (оксид кальция):
Классификация: Это основной оксид. Он образован металлом (кальцием) в низкой степени окисления (+2) и соответствует основанию Ca(OH)₂.
Реакция с NaOH: Основные оксиды проявляют основные свойства. Гидроксид натрия также является основанием. В химии вещества с одинаковыми кислотно-основными свойствами (основание с основанием) не реагируют друг с другом в классическом смысле нейтрализации.
Поэтому CaO не будет реагировать с NaOH.
2) N₂O (оксид азота(I)):
Классификация: Это несолеобразующий оксид. Такие оксиды, как N₂O (оксид азота(I)), NO (оксид азота(II)), CO (оксид углерода(II)), не проявляют ни кислотных, ни основных свойств.
Реакция с NaOH: По определению, несолеобразующие оксиды не реагируют ни с кислотами, ни с основаниями, ни с водой с образованием солей. Поэтому N₂O не будет реагировать с NaOH.
3) SiO₂ (оксид кремния(IV)):
Классификация: Это кислотный оксид. Он образован неметаллом (кремнием) и соответствует слабой кремниевой кислоте (H₂SiO₃).
Реакция с NaOH: Поскольку SiO₂ является кислотным оксидом, он реагирует с основанием (NaOH). Эта реакция является примером взаимодействия кислотного оксида с щелочью, в результате которого образуется соль (силикат натрия) и вода.
Уравнение реакции:
2NaOH(р-р) + SiO₂(тв) → Na₂SiO₃(р-р) + H₂O(ж)
Полное ионное уравнение:
2Na⁺(р-р) + 2OH⁻(р-р) + SiO₂(тв) → 2Na⁺(р-р) + SiO₃²⁻(р-р) + H₂O(ж)
Сокращенное ионное уравнение:
2OH⁻(р-р) + SiO₂(тв) → SiO₃²⁻(р-р) + H₂O(ж)
Дополнительное объяснение: Эта реакция обычно требует нагревания или сплавления, особенно если SiO₂ находится в форме песка, так как SiO₂ является очень прочным и химически инертным веществом при обычных условиях. Образующийся силикат натрия (Na₂SiO₃) является растворимой солью.
4) P₂O₅ (оксид фосфора(V)):
Классификация: Это кислотный оксид. Он образован неметаллом (фосфором) в высокой степени окисления (+5) и соответствует сильной фосфорной кислоте (H₃PO₄).
Реакция с NaOH: Как и SiO₂, P₂O₅ является кислотным оксидом, и поэтому он активно реагирует с основанием (NaOH). Это также реакция нейтрализации, приводящая к образованию соли (фосфата натрия) и воды.
Уравнение реакции:
6NaOH(р-р) + P₂O₅(тв) → 2Na₃PO₄(р-р) + 3H₂O(ж)
Полное ионное уравнение:
6Na⁺(р-р) + 6OH⁻(р-р) + P₂O₅(тв) → 6Na⁺(р-р) + 2PO₄³⁻(р-р) + 3H₂O(ж)
Сокращенное ионное уравнение:
6OH⁻(р-р) + P₂O₅(тв) → 2PO₄³⁻(р-р) + 3H₂O(ж)
Дополнительное объяснение: P₂O₅ очень гигроскопичен и активно реагирует с водой (образуя H₃PO₄), а затем эта кислота реагирует с NaOH. В данном случае, P₂O₅ напрямую реагирует с NaOH, образуя фосфат натрия, который является хорошо растворимой солью.
Таким образом, только кислотные оксиды SiO₂ и P₂O₅ реагируют с гидроксидом натрия.
Вопрос 3
С соляной кислотой реагирует:
1) оксид железа (III)
2) оксид серы (VI)
3) оксид кремния (IV)
4) оксид меди (II)
Ответ: 1) оксид железа (III) и 4) оксид меди (II)
Соляная кислота (HCl) – это сильная кислота, которая полностью диссоциирует в водном растворе на ионы H⁺ и Cl⁻. В химии действует правило: кислоты реагируют с основаниями, основными оксидами или амфотерными оксидами.
Рассмотрим каждый из предложенных оксидов:
1) Оксид железа (III) (Fe₂O₃):
Классификация: Это амфотерный оксид. Амфотерные оксиды – это оксиды, которые способны проявлять как основные, так и кислотные свойства в зависимости от того, с чем они реагируют. Они реагируют как с сильными кислотами, так и с сильными основаниями.
Реакция с HCl: Поскольку Fe₂O₃ проявляет основные свойства в реакции с кислотами, он будет реагировать с соляной кислотой. Это типичная реакция кислотно-основного взаимодействия, приводящая к образованию соли (хлорида железа(III)) и воды.
Уравнение реакции:
Fe₂O₃(тв) + 6HCl(р-р) → 2FeCl₃(р-р) + 3H₂O(ж)
Полное ионное уравнение:
Fe₂O₃(тв) + 6H⁺(р-р) + 6Cl⁻(р-р) → 2Fe³⁺(р-р) + 6Cl⁻(р-р) + 3H₂O(ж)
Сокращенное ионное уравнение:
Fe₂O₃(тв) + 6H⁺(р-р) → 2Fe³⁺(р-р) + 3H₂O(ж)
Дополнительное объяснение: Хлорид железа(III) (FeCl₃) – это растворимая соль, что подтверждает протекание реакции.
2) Оксид серы (VI) (SO₃):
Классификация: Это кислотный оксид. Он соответствует сильной серной кислоте (H₂SO₄).
Реакция с HCl: SO₃ проявляет кислотные свойства. Соляная кислота (HCl) также является кислотой.
Вещества с одинаковыми кислотно-основными свойствами (кислота с кислотой) не реагируют друг с другом. Поэтому SO₃ не будет реагировать с HCl.
3) Оксид кремния (IV) (SiO₂):
Классификация: Это кислотный оксид. Он соответствует слабой кремниевой кислоте (H₂SiO₃).
Реакция с HCl: По той же причине, что и SO₃, SiO₂ является кислотным оксидом и не будет реагировать с другой кислотой (HCl). SiO₂ химически очень инертен и нерастворим в большинстве кислот, за исключением плавиковой кислоты (HF), с которой он реагирует по особому механизму.
4) Оксид меди (II) (CuO):
Классификация: Это основной оксид. Он образован металлом (медью) в низкой степени окисления (+2) и соответствует нерастворимому основанию Cu(OH)₂.
Реакция с HCl: Поскольку CuO является основным оксидом, он реагирует с кислотой (HCl). Это также реакция нейтрализации, в результате которой образуется соль (хлорид меди(II)) и вода.
Уравнение реакции:
CuO(тв) + 2HCl(р-р) → CuCl₂(р-р) + H₂O(ж)
Полное ионное уравнение:
CuO(тв) + 2H⁺(р-р) + 2Cl⁻(р-р) → Cu²⁺(р-р) + 2Cl⁻(р-р) + H₂O(ж)
Сокращенное ионное уравнение:
CuO(тв) + 2H⁺(р-р) → Cu²⁺(р-р) + H₂O(ж)
Дополнительное объяснение: Хлорид меди(II) (CuCl₂) является растворимой солью, что позволяет реакции протекать до конца. Раствор CuCl₂ имеет характерный сине-зеленый цвет.
Таким образом, с соляной кислотой реагируют амфотерный оксид Fe₂O₃ и основной оксид CuO.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!