
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 178-181 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
1. Кислоты — это
2. Вспомните классификацию кислот и распределите кремниевую, соляную, азотную, угольную, фосфорную кислоты в соответствующие группы, вписав их формулы.
3. Общие химические свойства кислот.
1) Кислота + ______________ → соль + H₂↑
если:
— ________________________________
— ________________________________
— ________________________________
— ________________________________
2) Кислота + оксид металла → ___________________ + ___________________
3) Кислота + ___________________ → ___________________ + ___________________
Если щёлочь, то это реакция ___________________________.
4) Кислота + ___________________ → новая ___________________ + новая ___________________, если: ___________________
4. Приведите примеры уравнений реакций, характеризующих общие свойства кислот, в молекулярном, полном ионном и сокращённом ионном видах:
1) ___HCl + __________ → ZnCl₂ + __________
2) H₂SO₄ + __________ → CuSO₄ + __________
3) HNO₃ + __________ → NaNO₃ + __________
4) H₂SO₄ + __________ → BaSO₄ + __________
__________ + __________ → BaSO₄ + HCl
5) HCl + Fe(OH)₃ → __________ + __________
6) HNO₃ + __________ → H₂SiO₃↓ + __________
Часть II
1. Соляная кислота взаимодействует со следующими из перечисленных веществ:
медь, магний, оксид меди (II), оксид кремния (IV), сульфат калия, нитрат серебра, карбонат кальция.
Ответ.
Запишите возможные уравнения реакций в молекулярном и ионном видах.
§37
Часть I
Вопрос 1
Кислоты — это электролиты, способные распадаться на ионы водорода и отрицательно заряженные частицы кислотного остатка.
Вопрос 2
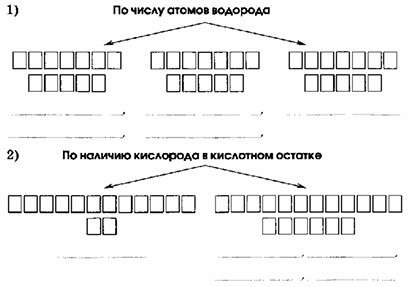
По числу атомов водорода:
— Одноосновные (HCl, HNO₃)
— Двухосновные (H₂SiO₃, H₂CO₃)
— Трёхосновные (H₃PO₄)
По наличию кислорода в кислотном остатке:
— Бескислородные (HCl)
— Кислородсодержащие (HNO₃, H₂SiO₃, H₂CO₃, H₃PO₄)
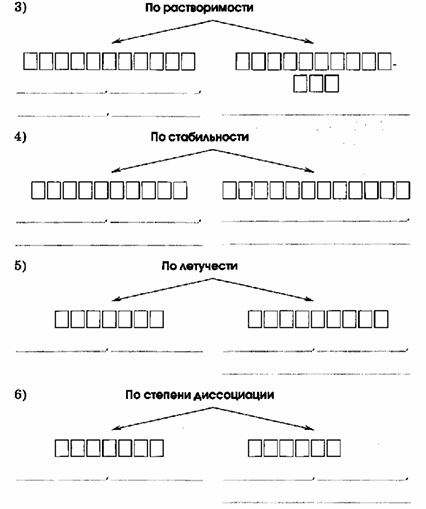
По растворимости:
— Растворимые (HCl, HNO₃, H₂CO₃, H₃PO₄)
— Нерастворимые (H₂SiO₃)
По стабильности:
— Стабильные (HCl, HNO₃, H₃PO₄)
— Нестабильные (H₂CO₃, H₂SiO₃)
По летучести:
— Летучие (HCl, HNO₃)
— Нелетучие (H₂SiO₃, H₂CO₃, H₃PO₄)
По степени диссоциации:
— Сильные (HCl, HNO₃)
— Слабые (H₂SiO₃, H₂CO₃, H₃PO₄)
Вопрос 3
Общие химические свойства кислот.
1) Кислота + МЕТАЛЛ → соль + H₂
Если:
— Металл не щелочной или щелочноземельный
— Образующаяся соль растворима
— Металл стоит до водорода в ряду напряжений
— Кислота не является азотной или серной концентрированной
2) Кислота + оксид металла → соль + вода
3) Кислота + основание → соль + вода
Если щелочь, то это реакции НЕЙТРАЛИЗАЦИИ.
4) Кислота + соль → новая кислота + новая соль
Если:
— Образуется более слабая кислота
— Образуется осадок или газ
Вопрос 4
2HCl + Zn(OH)₂ → ZnCl₂ + 2H₂O
2H⁺ + 2Cl⁻ + Zn(OH)₂ → Zn²⁺ + 2Cl⁻ + 2H₂O
2H⁺ + Zn(OH)₂ → Zn²⁺ + 2H₂O
H₂SO₄ + Cu(OH)₂ → CuSO₄ + 2H₂O
2H⁺ + SO₄²⁻ + Cu(OH)₂ → Cu²⁺ + SO₄²⁻ + 2H₂O
2H⁺ + Cu(OH)₂ → Cu²⁺ + 2H₂O
HNO₃ + NaOH → NaNO₃ + H₂O
H⁺ + NO₃⁻ + Na⁺ + OH⁻ → Na⁺ + NO₃⁻ + H₂O
H⁺ + OH⁻ → H₂O
H₂SO₄ + BaCl₂ → BaSO₄↓ + 2HCl
2H⁺ + SO₄²⁻ + Ba²⁺ + 2Cl⁻ → BaSO₄↓ + 2H⁺ + 2Cl⁻
SO₄²⁻ + Ba²⁺ → BaSO₄↓
3HCl + Fe(OH)₃ → FeCl₃ + 3H₂O
3H⁺ + 3Cl⁻ + Fe(OH)₃ → Fe³⁺ + 3Cl⁻ + 3H₂O
3H⁺ + Fe(OH)₃ → Fe³⁺ + 3H₂O
2HNO₃ + Na₂SiO₃ → 2NaNO₃ + H₂SiO₃↓
2H⁺ + 2NO₃⁻ + 2Na⁺ + SiO₃²⁻ → 2Na⁺ + 2NO₃⁻ + H₂SiO₃↓
2H⁺ + SiO₃²⁻ → H₂SiO₃↓
Часть II
Вопрос 1
Магний, оксид меди (II), нитрат серебра и карбонат кальция.
2HCl + Mg → MgCl₂ + H₂↑
2H⁺ + 2Cl⁻ + Mg → Mg²⁺ + 2Cl⁻ + H₂↑
2H⁺ + Mg → Mg²⁺ + H₂↑
2HCl + CuO → CuCl₂ + H₂O
2H⁺ + 2Cl⁻ + CuO → Cu²⁺ + 2Cl⁻ + H₂O
2H⁺ + CuO → Cu²⁺ + H₂O
HCl + AgNO₃ → AgCl↓ + HNO₃
H⁺ + Cl⁻ + Ag⁺ + NO₃⁻ → AgCl↓ + H⁺ + NO₃⁻
Cl⁻ + Ag⁺ → AgCl↓
2HCl + CaCO₃ → CaCl₂ + H₂O + CO₂↑
2H⁺ + 2Cl⁻ + CaCO₃ → Ca²⁺ + 2Cl⁻ + H₂O + CO₂↑
2H⁺ + CaCO₃ → Ca²⁺ + H₂O + CO₂↑
§37
Часть I
Вопрос 1
Кислоты — это сложные вещества, которые при диссоциации в водных растворах образуют ионы водорода (H⁺) и анионы кислотного остатка. Они являются электролитами, то есть проводят электрический ток.
Понятие «сложные вещества» означает, что молекулы кислот состоят из атомов различных химических элементов, соединенных между собой ковалентными связями. Ключевым свойством кислот является их способность к диссоциации, то есть распаду на ионы, когда они растворяются в воде. Вода, будучи полярным растворителем, играет активную роль в этом процессе, «вытягивая» ионы из молекулы кислоты.
Ионы водорода (H⁺), которые образуются в результате диссоциации, на самом деле не существуют в свободном виде в водном растворе. Они немедленно присоединяются к молекулам воды, образуя ионы гидроксония (H₃O⁺). Именно эти ионы гидроксония, а не просто H⁺, придают растворам кислот их характерные свойства: кислый вкус, способность изменять цвет индикаторов (например, лакмус становится красным), и высокую реакционную способность.
Кислоты являются электролитами, потому что их диссоциация приводит к образованию подвижных заряженных частиц — ионов. Эти ионы способны перемещаться под действием электрического поля, обеспечивая проводимость электрического тока через раствор. Чем больше ионов образуется при диссоциации (то есть чем сильнее кислота), тем лучше раствор проводит электрический ток.
Вопрос 2
Рассмотрим классификацию следующих кислот: кремниевая (H₂SiO₃), соляная (HCl), азотная (HNO₃), угольная (H₂CO₃), фосфорная (H₃PO₄).
Классификация кислот помогает систематизировать их свойства и предсказывать их поведение в химических реакциях.
1) По числу атомов водорода (основности):
Основность кислоты определяется количеством ионов водорода (H⁺), которые одна молекула кислоты способна отдать в раствор при диссоциации.
Одноосновные (1 атом H):
- Соляная кислота (HCl)
- Азотная кислота (HNO₃)
Эти кислоты диссоциируют, отдавая один ион H⁺ на молекулу.
Двухосновные (2 атома H):
- Кремниевая кислота (H₂SiO₃)
- Угольная кислота (H₂CO₃)
Эти кислоты способны отдать два иона H⁺. Диссоциация таких кислот происходит ступенчато, то есть сначала отщепляется один H⁺, а затем второй. Например, для угольной кислоты: H₂CO₃ ⇌ H⁺ + HCO₃⁻, а затем HCO₃⁻ ⇌ H⁺ + CO₃²⁻. Каждая последующая ступень диссоциации происходит труднее.
Трехосновные (3 атома H):
- Фосфорная кислота (H₃PO₄)
Эта кислота способна отдать три иона H⁺, также ступенчато.
2) По наличию кислорода в кислотном остатке:
Наличие или отсутствие кислорода в составе кислотного остатка влияет на химические свойства кислоты и ее номенклатуру.
Бескислородные (без кислорода):
- Соляная кислота (HCl)
В таких кислотах водород непосредственно связан с неметаллическим элементом.
Кислородсодержащие (с кислородом):
- Азотная кислота (HNO₃)
- Кремниевая кислота (H₂SiO₃)
- Угольная кислота (H₂CO₃)
- Фосфорная кислота (H₃PO₄)
В этих кислотах водород связан с атомом кислорода, который в свою очередь связан с центральным атомом неметалла.
3) По растворимости:
Растворимость кислоты в воде является важным физическим свойством, которое определяет возможность ее использования в водных растворах.
Растворимые:
- Соляная кислота (HCl)
- Азотная кислота (HNO₃)
- Угольная кислота (H₂CO₃)
- Фосфорная кислота (H₃PO₄)
Большинство кислот хорошо растворимы в воде.
Нерастворимые:
- Кремниевая кислота (H₂SiO₃)
Кремниевая кислота является исключением; она представляет собой студенистое вещество, практически нерастворимое в воде.
4) По стабильности:
Стабильность кислоты характеризует ее способность сохранять свою молекулярную структуру в обычных условиях. Нестабильные кислоты легко разлагаются.
Стабильные:
- Соляная кислота (HCl)
- Азотная кислота (HNO₃)
- Фосфорная кислота (H₃PO₄)
Эти кислоты достаточно устойчивы и не разлагаются при комнатной температуре.
Нестабильные (легко разлагаются):
- Угольная кислота (H₂CO₃) — разлагается на H₂O и CO₂
Угольная кислота существует только в растворе и при нагревании или уменьшении давления легко распадается на воду и углекислый газ. Это объясняет выделение пузырьков газа при открытии бутылки с газированной водой.
- Кремниевая кислота (H₂SiO₃) — разлагается на H₂O и SiO₂
Кремниевая кислота также нестабильна и при нагревании теряет воду, превращаясь в оксид кремния (IV), или кремнезем.
5) По летучести:
Летучесть кислоты связана с ее способностью переходить в газообразное состояние.
Летучие:
- Соляная кислота (HCl)
- Азотная кислота (HNO₃)
Эти кислоты имеют достаточно высокое давление паров и легко испаряются при комнатной температуре, что часто приводит к образованию «дыма» над их концентрированными растворами (например, HCl образует туман с парами воды).
Нелетучие:
- Кремниевая кислота (H₂SiO₃)
- Угольная кислота (H₂CO₃)
- Фосфорная кислота (H₃PO₄)
Эти кислоты либо не испаряются (фосфорная, кремниевая), либо разлагаются до газообразных продуктов (угольная).
6) По степени диссоциации (силе):
Сила кислоты определяется степенью ее диссоциации в водном растворе, то есть долей молекул, распавшихся на ионы.
Сильные (диссоциируют практически полностью):
- Соляная кислота (HCl)
- Азотная кислота (HNO₃)
В растворах сильных кислот почти все молекулы распадаются на ионы, что обеспечивает высокую концентрацию ионов H⁺ и, соответственно, высокую кислотность и электропроводность.
Слабые (диссоциируют незначительно):
- Кремниевая кислота (H₂SiO₃)
- Угольная кислота (H₂CO₃)
- Фосфорная кислота (H₃PO₄)
В растворах слабых кислот большая часть молекул остается недиссоциированной. Диссоциация происходит лишь в небольшой степени, устанавливается равновесие между молекулами и ионами. Сила кислоты количественно выражается константой диссоциации (Ka) – чем больше Ka, тем сильнее кислота.
Вопрос 3
Химические свойства кислот обусловлены наличием в их составе подвижных ионов водорода (H⁺) и способностью кислотного остатка к образованию стабильных соединений.
1) Кислота + Металл → Соль + Водород (H₂)
Эта реакция является окислительно-восстановительной, где металл выступает в роли восстановителя, а ионы водорода из кислоты — в роли окислителя.
Условия:
- Металл должен находиться в ряду активности металлов до водорода. Ряд активности (или электрохимический ряд напряжений) показывает способность металлов отдавать электроны. Металлы, расположенные до водорода, обладают более сильными восстановительными свойствами, чем водород, и могут вытеснять его из кислот.
- Образующаяся соль должна быть растворима. Если соль нерастворима, она покрывает поверхность металла, препятствуя дальнейшей реакции.
- Кислота не должна быть азотной или концентрированной серной, так как они являются сильными окислителями и реагируют с металлами иначе (без выделения водорода). В этих случаях окислителем выступает не ион H⁺, а сам анион кислоты (NO₃⁻ или SO₄²⁻), и продуктами реакции могут быть оксиды азота, сернистый газ или сероводород, а не водород.
- Металл не должен быть щелочным или щелочноземельным (реакция с водой в растворе кислоты). Щелочные и щелочноземельные металлы настолько активны, что в первую очередь реагируют с водой, содержащейся в растворе кислоты, выделяя водород и образуя гидроксиды, а уже затем эти гидроксиды могут реагировать с кислотой.
2) Кислота + Оксид металла (основный или амфотерный) → Соль + Вода
Эта реакция является типичной для кислот, так как они нейтрализуют основные свойства оксидов. Основные оксиды (например, CuO, Fe₂O₃) — это оксиды металлов, которые проявляют основные свойства и реагируют с кислотами. Амфотерные оксиды (например, Al₂O₃, ZnO) способны проявлять как основные, так и кислотные свойства, поэтому они также реагируют с кислотами, выступая в данном случае как основания. В результате реакции происходит обмен ионами, где ионы H⁺ кислоты соединяются с ионами кислорода оксида, образуя воду.
3) Кислота + Основание → Соль + Вода
Эта реакция называется реакцией НЕЙТРАЛИЗАЦИИ. Она происходит между кислотой и основанием (щелочью или нерастворимым основанием) с образованием соли и воды. Суть этой реакции заключается во взаимодействии ионов водорода (H⁺) из кислоты и гидроксид-ионов (OH⁻) из основания с образованием молекул воды (H⁺ + OH⁻ → H₂O). Это экзотермическая реакция, то есть сопровождается выделением тепла. Реакция нейтрализации является одним из наиболее фундаментальных типов химических реакций.
4) Кислота + Соль → Новая кислота + Новая соль
Эта реакция является реакцией ионного обмена. Она протекает только при наличии так называемого «движущего фактора», который смещает равновесие в сторону образования продуктов.
Реакция протекает, если:
- Образуется более слабая кислота, чем исходная. Например, сильная кислота вытесняет слабую из ее соли. Это объясняется тем, что слабая кислота менее диссоциирована и, следовательно, выводится из сферы реакции.
- Образуется нерастворимый осадок. Образование нерастворимого соединения (осадка) удаляет ионы из раствора, тем самым смещая равновесие реакции в сторону продуктов. Это можно предсказать по таблице растворимости.
- Образуется газообразное вещество. Если один из продуктов реакции является газом, он покидает реакционную смесь, также смещая равновесие в сторону продуктов. Например, реакция кислоты с карбонатами всегда приводит к выделению углекислого газа.
Вопрос 4
Приведем примеры реакций, характеризующих общие свойства кислот, в молекулярном, полном и сокращённом ионном видах.
Ионные уравнения показывают, какие именно ионы участвуют в химической реакции, а какие являются «зрителями» (не изменяются в ходе реакции).
1) HCl + Zn(OH)₂ (Реакция с нерастворимым основанием)
Молекулярное: 2HCl + Zn(OH)₂ → ZnCl₂ + 2H₂O
Полное ионное: 2H⁺ + 2Cl⁻ + Zn(OH)₂(тв) → Zn²⁺ + 2Cl⁻ + 2H₂O
Сокращённое ионное: 2H⁺ + Zn(OH)₂(тв) → Zn²⁺ + 2H₂O
В этой реакции соляная кислота (сильный электролит) диссоциирует на ионы, а гидроксид цинка (нерастворимое основание) остается в молекулярной форме. Хлорид-ионы (Cl⁻) являются «зрителями». Реакция идет, потому что образуется вода (слабый электролит) и растворимая соль.
2) H₂SO₄ + Cu(OH)₂ (Реакция с нерастворимым основанием)
Молекулярное: H₂SO₄ + Cu(OH)₂ → CuSO₄ + 2H₂O
Полное ионное: 2H⁺ + SO₄²⁻ + Cu(OH)₂(тв) → Cu²⁺ + SO₄²⁻ + 2H₂O
Сокращённое ионное: 2H⁺ + Cu(OH)₂(тв) → Cu²⁺ + 2H₂O
Аналогично предыдущей реакции, серная кислота (сильный электролит) диссоциирует, а гидроксид меди(II) (нерастворимое основание) — нет. Сульфат-ионы (SO₄²⁻) являются «зрителями».
3) HNO₃ + NaOH (Реакция с щелочью — нейтрализация)
Молекулярное: HNO₃ + NaOH → NaNO₃ + H₂O
Полное ионное: H⁺ + NO₃⁻ + Na⁺ + OH⁻ → Na⁺ + NO₃⁻ + H₂O
Сокращённое ионное: H⁺ + OH⁻ → H₂O
Это классический пример реакции нейтрализации между сильной кислотой и сильным основанием. Все исходные вещества и образующаяся соль являются сильными электролитами и полностью диссоциируют в растворе. Ионы натрия (Na⁺) и нитрат-ионы (NO₃⁻) — «зрители». Суть реакции сводится к образованию воды.
4) H₂SO₄ + BaCl₂ (Реакция с солью — образование осадка)
Молекулярное: H₂SO₄ + BaCl₂ → BaSO₄↓ + 2HCl
Полное ионное: 2H⁺ + SO₄²⁻ + Ba²⁺ + 2Cl⁻ → BaSO₄(тв) + 2H⁺ + 2Cl⁻
Сокращённое ионное: SO₄²⁻ + Ba²⁺ → BaSO₄(тв)
Реакция происходит, потому что образуется нерастворимый осадок сульфата бария (BaSO₄), который выпадает из раствора. Ионы водорода (H⁺) и хлорид-ионы (Cl⁻) являются «зрителями».
5) HCl + Fe(OH)₃ (Реакция с нерастворимым основанием)
Молекулярное: 3HCl + Fe(OH)₃ → FeCl₃ + 3H₂O
Полное ионное: 3H⁺ + 3Cl⁻ + Fe(OH)₃(тв) → Fe³⁺ + 3Cl⁻ + 3H₂O
Сокращённое ионное: 3H⁺ + Fe(OH)₃(тв) → Fe³⁺ + 3H₂O
Аналогично реакциям с другими нерастворимыми основаниями, ионы водорода из кислоты реагируют с недиссоциированным гидроксидом железа(III), образуя воду и растворимую соль. Хлорид-ионы — «зрители».
6) HNO₃ + Na₂SiO₃ (Реакция с солью — образование слабой кислоты)
Молекулярное: 2HNO₃ + Na₂SiO₃ → 2NaNO₃ + H₂SiO₃↓
Полное ионное: 2H⁺ + 2NO₃⁻ + 2Na⁺ + SiO₃²⁻ → 2Na⁺ + 2NO₃⁻ + H₂SiO₃(тв)
Сокращённое ионное: 2H⁺ + SiO₃²⁻ → H₂SiO₃(тв)
Эта реакция является примером вытеснения более слабой и нерастворимой кислоты (кремниевой) из ее соли более сильной кислотой (азотной). Кремниевая кислота выпадает в осадок, что является движущей силой реакции. Ионы натрия (Na⁺) и нитрат-ионы (NO₃⁻) — «зрители».
Часть II
Вопрос 1
Соляная кислота (HCl) будет взаимодействовать с веществами, если в результате реакции образуется вода, газ, осадок или менее диссоциирующее вещество (слабая кислота, слабое основание).
Принцип взаимодействия соляной кислоты с различными веществами основан на тех же условиях, что и для общих свойств кислот. Мы ищем «движущие силы» реакции: образование нерастворимого вещества (осадка), газообразного вещества или слабого электролита (воды, слабой кислоты).
Вещества: медь, магний, оксид меди (II), оксид кремния (IV), сульфат калия, нитрат серебра, карбонат кальция.
Реагируют с HCl:
Магний (Mg): Магний находится в ряду активности металлов до водорода.
Молекулярное: 2HCl + Mg → MgCl₂ + H₂↑
Полное ионное: 2H⁺ + 2Cl⁻ + Mg → Mg²⁺ + 2Cl⁻ + H₂↑
Сокращённое ионное: 2H⁺ + Mg → Mg²⁺ + H₂↑
Магний является активным металлом, который легко отдает электроны и вытесняет водород из кислоты, образуя газообразный водород. Хлорид магния — растворимая соль.
Оксид меди (II) (CuO): Это основный оксид, который реагирует с кислотами.
Молекулярное: 2HCl + CuO → CuCl₂ + H₂O
Полное ионное: 2H⁺ + 2Cl⁻ + CuO(тв) → Cu²⁺ + 2Cl⁻ + H₂O
Сокращённое ионное: 2H⁺ + CuO(тв) → Cu²⁺ + H₂O
Оксид меди(II) является основным оксидом и вступает в реакцию нейтрализации с кислотой, образуя растворимую соль хлорид меди(II) и воду. Реакция идет, потому что образуется вода.
Нитрат серебра (AgNO₃): Образуется нерастворимый осадок хлорида серебра (AgCl).
Молекулярное: HCl + AgNO₃ → AgCl↓ + HNO₃
Полное ионное: H⁺ + Cl⁻ + Ag⁺ + NO₃⁻ → AgCl(тв) + H⁺ + NO₃⁻
Сокращённое ионное: Cl⁻ + Ag⁺ → AgCl(тв)
Эта реакция является качественной реакцией на хлорид-ионы. Она протекает, потому что образуется белый творожистый осадок хлорида серебра, который не растворяется в азотной кислоте.
Карбонат кальция (CaCO₃): Образуется слабая и нестабильная угольная кислота, которая разлагается на воду и углекислый газ.
Молекулярное: 2HCl + CaCO₃ → CaCl₂ + H₂O + CO₂↑
Полное ионное: 2H⁺ + 2Cl⁻ + CaCO₃(тв) → Ca²⁺ + 2Cl⁻ + H₂O + CO₂↑
Сокращённое ионное: 2H⁺ + CaCO₃(тв) → Ca²⁺ + H₂O + CO₂↑
Реакция происходит, поскольку сильная соляная кислота вытесняет слабую и нестабильную угольную кислоту из ее соли. Угольная кислота немедленно разлагается на воду и газообразный углекислый газ, который выделяется в виде пузырьков, что является «движущей силой» реакции.
Не реагируют с HCl:
Медь (Cu): Медь находится в ряду активности металлов после водорода, поэтому не вытесняет водород из кислот.
Медь является менее активным металлом, чем водород. Это означает, что она не способна отдавать электроны ионам водорода из соляной кислоты, чтобы восстановить их до газообразного водорода.
Для реакции меди с кислотой требуется кислота-окислитель (например, концентрированная серная или азотная кислота), где окислителем является анион, а не ион водорода.
Оксид кремния (IV) (SiO₂): Это кислотный оксид, который не реагирует с кислотами (за исключением плавиковой кислоты HF).
Оксид кремния (IV), или кремнезем, является кислотным оксидом. Кислотные оксиды обычно реагируют с основаниями или основными оксидами, но не с кислотами. Исключением является его реакция с плавиковой кислотой (HF), которая используется для травления стекла, так как HF способна растворять SiO₂.
Сульфат калия (K₂SO₄): Реакция не происходит, так как не образуется ни осадок, ни газ, ни слабая кислота. Все потенциальные продукты (KCl и H₂SO₄) являются сильными электролитами и растворимы.
В данном случае, если бы реакция произошла, продуктами были бы хлорид калия (KCl) и серная кислота (H₂SO₄). Оба эти вещества являются сильными электролитами и хорошо растворимы в воде. Это означает, что все ионы остаются в растворе, и нет «движущей силы» для протекания реакции. Ионы калия, сульфат-ионы, ионы водорода и хлорид-ионы просто сосуществуют в растворе, не образуя новых стабильных соединений.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!