
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 184-187 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
1. Основания — это _____________________________________________
2. Вспомните классификацию оснований и распределите гидроксид натрия, гидроксид магния, гидроксид кальция, гидрат аммиака по соответствующим группам, вписав их формулы.
3. Общие химические свойства оснований.
4. Приведите примеры уравнений реакций, характеризующих общие свойства оснований, в молекулярном, полном ионном и сокращённом ионном видах.
1) H₂SO₄ + ___ NaOH → ___ + ___
2) H₂SO₄ + ___ Cu(OH)₂ → ___ + ___
3) SO₃ + ______ → Na₂SO₄ + ______
4) ______ Fe(OH)₃ → ______ + ______
5) ______ KOH + ______ → Cu(OH)₂↓ + ______
6) Ba(OH)₂ + ______ → BaSO₄↓ + NaOH
7) NH₄Cl + ______ → NaCl + NH₃ + H₂O
Часть II
1. Гидроксид натрия взаимодействует со следующими из перечисленных веществ:
сульфат меди (II), хлорид магния, оксид меди (II), оксид серы (IV), сульфат калия, азотная кислота, хлорид аммония.
Ответ запишите формулами.
Ответ. _________________________________________
Составьте возможные молекулярные и ионные уравнения реакций.
1) _____________________________________________
2) _____________________________________________
3) _____________________________________________
4) _____________________________________________
§38
Часть I
Вопрос 1
Основания — это вещества-электролиты, которые при диссоциации образуют положительно заряженные ионы металла и анионы гидроксильных групп OH⁻.
Вопрос 2
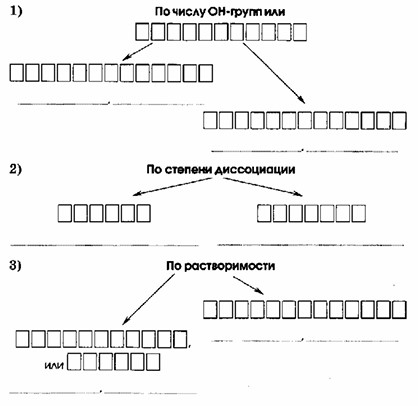
Классификация оснований
| 1) По числу OH-групп | |
|---|---|
| ОДНОКИСЛОТНЫЕ NaOH, NH₄OH | ДВУХКИСЛОТНЫЕ Mg(OH)₂, Ca(OH)₂ |
| 2) По степени диссоциации | |
| СЛАБЫЕ NH₄OH, Mg(OH)₂ | СИЛЬНЫЕ NaOH, Ca(OH)₂ |
| 3) По растворимости | |
| РАСТВОРИМЫЕ, или ЩЕЛОЧИ NaOH, NH₄OH, Ca(OH)₂ | НЕРАСТВОРИМЫЕ Mg(OH)₂ |
Вопрос 3
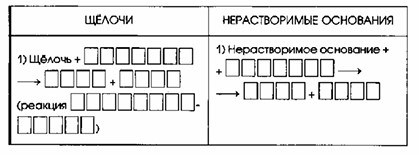
Общие химические свойства оснований
| ЩЕЛОЧИ | НЕРАСТВОРИМЫЕ ОСНОВАНИЯ |
|---|---|
| 1) Щелочь + КИСЛОТА = СОЛЬ + ВОДА (реакция НЕЙТРАЛИЗАЦИИ) | 1) Нерастворимое основание + КИСЛОТА = СОЛЬ + ВОДА |
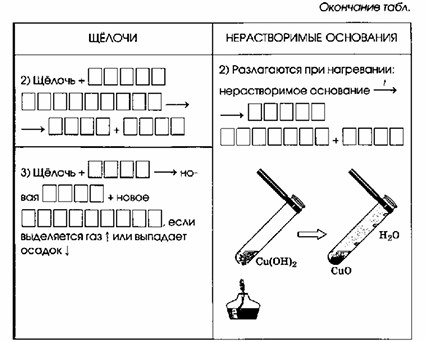
| 2) Щелочь + ОКСИД НЕМЕТАЛЛА = СОЛЬ + ВОДА | 2) Разлагаются при нагревании: Нерастворимое основание = ОКСИД МЕТАЛЛА + ВОДА |
| 3) Щелочь + СОЛЬ = новая СОЛЬ + новое ОСНОВАНИЕ, если выделяется газ или выпадает осадок |
Вопрос 4
1) H₂SO₄ + 2NaOH → Na₂SO₄ + 2H₂O
2H⁺ + SO₄²⁻ + 2Na⁺ + 2OH⁻ → 2Na⁺ + SO₄²⁻ + 2H₂O
H⁺ + 2OH⁻ → H₂O
2) H₂SO₄ + Cu(OH)₂ → CuSO₄ + 2H₂O
2H⁺ + SO₄²⁻ + Cu(OH)₂ → Cu²⁺ + SO₄²⁻ + 2H₂O
2H⁺ + Cu(OH)₂ → Cu²⁺ + 2H₂O
3) SO₃ + 2NaOH → Na₂SO₄ + H₂O
SO₃ + 2Na⁺ + 2OH⁻ → 2Na⁺ + SO₄²⁻ + H₂O
SO₃ + 2OH⁻ → SO₄²⁻ + H₂O
4) 3HNO₃ + Fe(OH)₃ → Fe(NO₃)₃ + 3H₂O
3H⁺ + 3NO₃⁻ + Fe(OH)₃ → Fe³⁺ + 3NO₃⁻ + 3H₂O
3H⁺ + Fe(OH)₃ → Fe³⁺ + 3H₂O
5) 2KOH + CuCl₂ → Cu(OH)₂↓ + 2KCl
2K⁺ + 2OH⁻ + Cu²⁺ + 2Cl⁻ → Cu(OH)₂↓ + 2K⁺ + 2Cl⁻
Cu²⁺ + 2OH⁻ → Cu(OH)₂↓
6) Ba(OH)₂ + Na₂SO₄ → BaSO₄↓ + 2NaOH
Ba²⁺ + 2OH⁻ + 2Na⁺ + SO₄²⁻ → BaSO₄↓ + 2Na⁺ + 2OH⁻
Ba²⁺ + SO₄²⁻ → BaSO₄↓
7) NH₄Cl + NaOH → NaCl + NH₃ + H₂O
NH₄⁺ + Cl⁻ + Na⁺ + OH⁻ → Na⁺ + Cl⁻ + NH₃ + H₂O
NH₄⁺ + OH⁻ → NH₃ + H₂O
Часть II
Вопрос 1
Ответ. CuSO₄, MgCl₂, SO₂, NH₄Cl, HNO₃.
1) 2NaOH + CuSO₄ → Na₂SO₄ + Cu(OH)₂↓
2Na⁺ + 2OH⁻ + Cu²⁺ + SO₄²⁻ → 2Na⁺ + SO₄²⁻ + Cu(OH)₂↓
Cu²⁺ + 2OH⁻ → Cu(OH)₂↓
2) 2NaOH + MgCl₂ → Mg(OH)₂↓ + 2NaCl
2Na⁺ + 2OH⁻ + Mg²⁺ + 2Cl⁻ → Mg(OH)₂↓ + 2Na⁺ + 2Cl⁻
Mg²⁺ + 2OH⁻ → Mg(OH)₂↓
3) 2NaOH + SO₂ → Na₂SO₃ + H₂O
2Na⁺ + 2OH⁻ + SO₂ → 2Na⁺ + SO₃²⁻ + H₂O
2OH⁻ + SO₂ → SO₃²⁻ + H₂O
4) NH₄Cl + NaOH → NaCl + NH₃↑ + H₂O
NH₄⁺ + Cl⁻ + Na⁺ + OH⁻ → Na⁺ + Cl⁻ + NH₃↑ + H₂O
NH₄⁺ + OH⁻ → NH₃↑ + H₂O
5) HNO₃ + NaOH → NaNO₃ + H₂O
H⁺ + NO₃⁻ + Na⁺ + OH⁻ → Na⁺ + NO₃⁻ + H₂O
H⁺ + OH⁻ → H₂O
Вопрос 1
Основания — это один из основных классов неорганических соединений.
Согласно теории Аррениуса, основания — это вещества, которые при диссоциации (растворении) в воде образуют гидроксид-ионы (OH⁻) как единственные анионы.
Термин «электролиты» означает, что эти вещества способны проводить электрический ток в растворе или расплаве.
Это происходит потому, что при растворении в воде основания распадаются на ионы: положительно заряженные катионы металла (или аммония NH₄⁺) и отрицательно заряженные гидроксид-ионы (OH⁻).
Свободные ионы в растворе обеспечивают движение электрического заряда.
Таким образом, полное определение: Основания — это электролиты, которые диссоциируют на катионы металла (или аммония NH₄⁺) и анионы гидроксильных групп OH⁻.
Например:
- NaOH (гидроксид натрия) в воде диссоциирует на Na⁺ и OH⁻.
- Ca(OH)₂ (гидроксид кальция) в воде диссоциирует на Ca²⁺ и 2OH⁻.
- NH₄OH (гидрат аммиака) в воде диссоциирует на NH₄⁺ и OH⁻.
Вопрос 2
Классификация помогает систематизировать вещества по общим признакам, что позволяет лучше предсказывать их свойства и поведение в химических реакциях.
Основания классифицируются по нескольким критериям:
1) По числу OH-групп (или кислотности):
Этот критерий определяет, сколько гидроксильных групп содержится в молекуле основания и, соответственно, сколько протонов (H⁺) оно может нейтрализовать.
Однокислотные основания: Содержат одну OH-группу.
Они могут нейтрализовать один эквивалент кислоты.
Примеры: Гидроксид натрия (NaOH), гидрат аммиака (NH₄OH).
Двухкислотные основания: Содержат две OH-группы.
Они могут нейтрализовать два эквивалента кислоты.
Примеры: Гидроксид магния (Mg(OH)₂), гидроксид кальция (Ca(OH)₂).
Существуют также трехкислотные (например, Fe(OH)₃) и более многокислотные основания.
2) По степени диссоциации (или силе):
Этот критерий указывает на то, насколько полно основание распадается на ионы в водном растворе.
Сильные основания (щелочи): Диссоциируют практически полностью в водном растворе.
Это, как правило, гидроксиды щелочных (Li, Na, K, Rb, Cs) и некоторых щелочноземельных (Ca, Sr, Ba) металлов.
Их высокая степень диссоциации обусловлена прочной ионной связью между катионом металла и гидроксид-ионом, которая легко разрывается в полярной среде воды.
Примеры: Гидроксид натрия (NaOH), гидроксид кальция (Ca(OH)₂).
Слабые основания: Диссоциируют лишь частично в водном растворе, устанавливая равновесие между недиссоциированными молекулами и ионами.
К ним относятся большинство гидроксидов переходных металлов и гидрат аммиака.
Примеры: Гидрат аммиака (NH₄OH), гидроксид магния (Mg(OH)₂).
3) По растворимости в воде:
Этот критерий важен для определения агрегатного состояния основания в водном растворе и его участия в реакциях ионного обмена.
Растворимые основания (щелочи): Хорошо растворяются в воде.
Это те же сильные основания, а также гидрат аммиака, который, хотя и является слабым основанием, хорошо растворим в воде.
Примеры: Гидроксид натрия (NaOH), гидроксид кальция (Ca(OH)₂), гидрат аммиака (NH₄OH).
Нерастворимые основания: Практически не растворяются в воде.
Большинство гидроксидов металлов, за исключением щелочных и некоторых щелочноземельных, относятся к нерастворимым основаниям.
Примеры: Гидроксид магния (Mg(OH)₂).
Вопрос 3
Химические свойства оснований определяются наличием в их составе гидроксильных групп (OH⁻).
Однако, растворимые и нерастворимые основания проявляют некоторые отличия в реакционной способности.
ЩЕЛОЧИ (Растворимые основания)
1. Взаимодействие с кислотами (реакция нейтрализации):
Суть: Это одна из наиболее характерных реакций для всех оснований.
Щелочь реагирует с кислотой, образуя соль и воду.
Это называется реакцией нейтрализации, потому что кислотные и основные свойства реагентов взаимно уничтожаются, образуя нейтральную воду и соль.
Пример: NaOH (щелочь) + HCl (кислота) → NaCl (соль) + H₂O (вода)
Ионное представление: Na⁺ + OH⁻ + H⁺ + Cl⁻ → Na⁺ + Cl⁻ + H₂O.
Сокращенное ионное: H⁺ + OH⁻ → H₂O.
Это показывает, что суть нейтрализации — это взаимодействие ионов водорода (из кислоты) с гидроксид-ионами (из основания) с образованием молекул воды.
2. Взаимодействие с оксидами неметаллов (кислотными оксидами):
Суть: Кислотные оксиды (например, CO₂, SO₂, SO₃, P₂O₅) — это оксиды, которые при растворении в воде образуют кислоты.
Поэтому их реакция со щелочами аналогична реакции нейтрализации.
Пример: 2NaOH (щелочь) + CO₂ (оксид неметалла) → Na₂CO₃ (соль) + H₂O (вода)
Объяснение: Углекислый газ (CO₂) в воде образует угольную кислоту (H₂CO₃), которая затем реагирует с NaOH.
3. Взаимодействие с солями:
Суть: Щелочи могут реагировать с растворами солей, если в результате реакции образуется нерастворимое основание (выпадает осадок) или выделяется газ.
Это реакции ионного обмена.
- Пример 1 (образование осадка): 2NaOH (щелочь) + CuSO₄ (соль) → Na₂SO₄ (новая соль) + Cu(OH)₂↓ (новое основание, осадок)
Объяснение: Гидроксид меди (II) Cu(OH)₂ является нерастворимым основанием, поэтому он выпадает в осадок, что является движущей силой реакции.
- Пример 2 (образование газа): NaOH (щелочь) + NH₄Cl (соль аммония) → NaCl (новая соль) + NH₃↑ (газ) + H₂O (вода)
Объяснение: Ионы аммония (NH₄⁺) реагируют с гидроксид-ионами (OH⁻) с образованием аммиака (NH₃) и воды.
Аммиак — это газ, который улетучивается из раствора, что также является движущей силой реакции.
НЕРАСТВОРИМЫЕ ОСНОВАНИЯ
1. Взаимодействие с кислотами:
Суть: Нерастворимые основания, несмотря на свою нерастворимость, также реагируют с кислотами, образуя соль и воду.
Кислота способна «растворить» нерастворимое основание, переводя его в растворённую соль.
Пример: Cu(OH)₂ (нерастворимое основание) + 2HCl (кислота) → CuCl₂ (соль) + 2H₂O (вода)
Объяснение: Ионы водорода из кислоты взаимодействуют с гидроксид-ионами нерастворимого основания, разрушая его кристаллическую решетку и переводя катионы металла в раствор в виде соли.
2. Разложение при нагревании:
Суть: Большинство нерастворимых оснований (за исключением гидроксидов щелочных металлов и некоторых щелочноземельных) термически неустойчивы.
При нагревании они разлагаются на соответствующий оксид металла и воду.
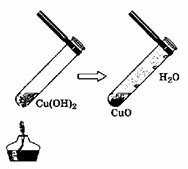
Пример: Cu(OH)₂ (нерастворимое основание) (при нагревании) → CuO (оксид металла) + H₂O (вода)
Объяснение: Гидроксид меди (II) — это голубой осадок.
При нагревании он разлагается, образуя черный оксид меди (II) и водяной пар.
Это качественная реакция на многие нерастворимые гидроксиды.
Вопрос 4
Для каждой реакции мы покажем три вида уравнений: молекулярное, полное ионное и сокращённое ионное.
- Молекулярное уравнение: Показывает вещества в виде их полных химических формул, как они существуют в недиссоциированном состоянии.
- Полное ионное уравнение: Показывает все растворимые сильные электролиты (сильные кислоты, сильные основания, растворимые соли) в виде ионов, а нерастворимые вещества, газы и воду — в виде молекул.
- Сокращённое ионное уравнение: Получается из полного ионного уравнения путем исключения «ионов-зрителей» (тех ионов, которые присутствуют в растворе до и после реакции, но не участвуют в химическом превращении).
Оно показывает только те частицы, которые непосредственно участвуют в реакции.
1) H₂SO₄ + 2NaOH → Na₂SO₄ + 2H₂O
Тип реакции: Нейтрализация (сильная кислота + сильное основание).
Молекулярное: H₂SO₄ + 2NaOH → Na₂SO₄ + 2H₂O
Полное ионное: 2H⁺ + SO₄²⁻ + 2Na⁺ + 2OH⁻ → 2Na⁺ + SO₄²⁻ + 2H₂O
Пояснение: H₂SO₄, NaOH, Na₂SO₄ — сильные растворимые электролиты, диссоциируют на ионы. H₂O — слабый электролит, пишется молекулой.
Сокращённое ионное: 2H⁺ + 2OH⁻ → 2H₂O (или H⁺ + OH⁻ → H₂O)
Пояснение: Ионы Na⁺ и SO₄²⁻ являются ионами-зрителями.
2) H₂SO₄ + Cu(OH)₂ → CuSO₄ + 2H₂O
Тип реакции: Взаимодействие сильной кислоты с нерастворимым основанием.
Молекулярное: H₂SO₄ + Cu(OH)₂ → CuSO₄ + 2H₂O
Полное ионное: 2H⁺ + SO₄²⁻ + Cu(OH)₂ → Cu²⁺ + SO₄²⁻ + 2H₂O
Пояснение: Cu(OH)₂ — нерастворимое основание, не диссоциирует, пишется молекулой.
Сокращённое ионное: 2H⁺ + Cu(OH)₂ → Cu²⁺ + 2H₂O
Пояснение: Ион SO₄²⁻ является ионом-зрителем.
3) SO₃ + 2NaOH → Na₂SO₄ + H₂O
Тип реакции: Взаимодействие кислотного оксида с сильным основанием.
Молекулярное: SO₃ + 2NaOH → Na₂SO₄ + H₂O
Полное ионное: SO₃ + 2Na⁺ + 2OH⁻ → 2Na⁺ + SO₄²⁻ + H₂O
Пояснение: SO₃ — оксид, не диссоциирует.
Сокращённое ионное: SO₃ + 2OH⁻ → SO₄²⁻ + H₂O
Пояснение: Ион Na⁺ является ионом-зрителем.
4) 3HNO₃ + Fe(OH)₃ → Fe(NO₃)₃ + 3H₂O
Тип реакции: Взаимодействие сильной кислоты с нерастворимым основанием.
Молекулярное: 3HNO₃ + Fe(OH)₃ → Fe(NO₃)₃ + 3H₂O
Полное ионное: 3H⁺ + 3NO₃⁻ + Fe(OH)₃ → Fe³⁺ + 3NO₃⁻ + 3H₂O
Пояснение: Fe(OH)₃ — нерастворимое основание, не диссоциирует.
Сокращённое ионное: 3H⁺ + Fe(OH)₃ → Fe³⁺ + 3H₂O
Пояснение: Ион NO₃⁻ является ионом-зрителем.
5) 2KOH + CuCl₂ → Cu(OH)₂↓ + 2KCl
Тип реакции: Взаимодействие щелочи с солью (реакция обмена с образованием осадка).
Молекулярное: 2KOH + CuCl₂ → Cu(OH)₂↓ + 2KCl
Полное ионное: 2K⁺ + 2OH⁻ + Cu²⁺ + 2Cl⁻ → Cu(OH)₂↓ + 2K⁺ + 2Cl⁻
Пояснение: Cu(OH)₂ — нерастворимое основание, выпадает в осадок, пишется молекулой.
Сокращённое ионное: Cu²⁺ + 2OH⁻ → Cu(OH)₂↓
Пояснение: Ионы K⁺ и Cl⁻ являются ионами-зрителями.
6) Ba(OH)₂ + Na₂SO₄ → BaSO₄↓ + 2NaOH
Тип реакции: Взаимодействие щелочи с солью (реакция обмена с образованием осадка).
Молекулярное: Ba(OH)₂ + Na₂SO₄ → BaSO₄↓ + 2NaOH
Полное ионное: Ba²⁺ + 2OH⁻ + 2Na⁺ + SO₄²⁻ → BaSO₄↓ + 2Na⁺ + 2OH⁻
Пояснение: BaSO₄ — нерастворимая соль, выпадает в осадок, пишется молекулой.
Сокращённое ионное: Ba²⁺ + SO₄²⁻ → BaSO₄↓
Пояснение: Ионы Na⁺ и OH⁻ являются ионами-зрителями.
7) NH₄Cl + NaOH → NaCl + NH₃↑ + H₂O
Тип реакции: Взаимодействие соли аммония с сильным основанием (реакция обмена с образованием газа).
Молекулярное: NH₄Cl + NaOH → NaCl + NH₃↑ + H₂O
Полное ионное: NH₄⁺ + Cl⁻ + Na⁺ + OH⁻ → Na⁺ + Cl⁻ + NH₃↑ + H₂O
Пояснение: NH₃ — газ, H₂O — слабый электролит, пишутся молекулами.
Сокращённое ионное: NH₄⁺ + OH⁻ → NH₃↑ + H₂O
Пояснение: Ионы Na⁺ и Cl⁻ являются ионами-зрителями.
Часть II
Вопрос 1
Ключевое вещество для анализа: Гидроксид натрия (NaOH) – сильное основание, сильный электролит.
1. Сульфат меди (II) (CuSO₄)
Тип вещества: Соль.
Молекулярное уравнение:
2NaOH(aq) + CuSO₄(aq) → Na₂SO₄(aq) + Cu(OH)₂↓(s)
Полное ионное уравнение:
2Na⁺(aq) + 2OH⁻(aq) + Cu²⁺(aq) + SO₄²⁻(aq) → 2Na⁺(aq) + SO₄²⁻(aq) + Cu(OH)₂↓(s)
Пояснение: NaOH, CuSO₄ и Na₂SO₄ – растворимые сильные электролиты, поэтому записываются в виде ионов. Cu(OH)₂ – нерастворимый осадок, записывается в виде молекулы.
Сокращенное ионное уравнение: (Сокращаем ионы-зрители: Na⁺ и SO₄²⁻)
Cu²⁺(aq) + 2OH⁻(aq) → Cu(OH)₂↓(s)
Объяснение: Реакция возможна, так как образуется нерастворимый осадок гидроксида меди (II) (голубого цвета).
2. Хлорид магния (MgCl₂)
Тип вещества: Соль.
Молекулярное уравнение:
2NaOH(aq) + MgCl₂(aq) → Mg(OH)₂↓(s) + 2NaCl(aq)
Полное ионное уравнение:
2Na⁺(aq) + 2OH⁻(aq) + Mg²⁺(aq) + 2Cl⁻(aq) → Mg(OH)₂↓(s) + 2Na⁺(aq) + 2Cl⁻(aq)
Пояснение: NaOH, MgCl₂ и NaCl – растворимые сильные электролиты, записываются в виде ионов. Mg(OH)₂ – нерастворимый осадок, записывается в виде молекулы.
Сокращенное ионное уравнение: (Сокращаем ионы-зрители: Na⁺ и Cl⁻)
Mg²⁺(aq) + 2OH⁻(aq) → Mg(OH)₂↓(s)
Объяснение: Реакция возможна, так как образуется нерастворимый осадок гидроксида магния (белого цвета).
3. Оксид меди (II) (CuO)
Тип вещества: Основной оксид.
Объяснение: Реакция невозможна, так как CuO является основным оксидом и не реагирует с NaOH, который сам является сильным основанием.
4. Оксид серы (IV) (SO₂)
Тип вещества: Кислотный оксид.
Молекулярное уравнение:
2NaOH(aq) + SO₂(g) → Na₂SO₃(aq) + H₂O(l)
Полное ионное уравнение:
2Na⁺(aq) + 2OH⁻(aq) + SO₂(g) → 2Na⁺(aq) + SO₃²⁻(aq) + H₂O(l)
Пояснение: NaOH и Na₂SO₃ – растворимые сильные электролиты, записываются в виде ионов. SO₂ – газ, H₂O – слабый электролит (вода), записываются в виде молекул.
Сокращенное ионное уравнение: (Сокращаем ионы-зрители: Na⁺)
2OH⁻(aq) + SO₂(g) → SO₃²⁻(aq) + H₂O(l)
Объяснение: Реакция возможна, так как SO₂ является кислотным оксидом и реагирует с основанием с образованием соли и воды.
5. Сульфат калия (K₂SO₄)
Тип вещества: Соль.
Объяснение: Реакция невозможна, так как все потенциальные продукты реакции (Na₂SO₄ и KOH) являются растворимыми и стабильными в растворе, и нет никакой движущей силы для протекания реакции обмена.
6. Азотная кислота (HNO₃)
Тип вещества: Сильная кислота.
Молекулярное уравнение:
NaOH(aq) + HNO₃(aq) → NaNO₃(aq) + H₂O(l)
Полное ионное уравнение:
Na⁺(aq) + OH⁻(aq) + H⁺(aq) + NO₃⁻(aq) → Na⁺(aq) + NO₃⁻(aq) + H₂O(l)
Пояснение: NaOH, HNO₃ и NaNO₃ – сильные электролиты, записываются в виде ионов. H₂O – слабый электролит (вода), записывается в виде молекулы.
Сокращенное ионное уравнение: (Сокращаем ионы-зрители: Na⁺ и NO₃⁻)
H⁺(aq) + OH⁻(aq) → H₂O(l)
Объяснение: Реакция возможна, так как это классическая реакция нейтрализации между сильным основанием и сильной кислотой.
7. Хлорид аммония (NH₄Cl)
Тип вещества: Соль аммония.
Молекулярное уравнение:
NaOH(aq) + NH₄Cl(aq) → NaCl(aq) + NH₃↑(g) + H₂O(l)
Полное ионное уравнение:
Na⁺(aq) + OH⁻(aq) + NH₄⁺(aq) + Cl⁻(aq) → Na⁺(aq) + Cl⁻(aq) + NH₃↑(g) + H₂O(l)
Пояснение: NaOH, NH₄Cl и NaCl – растворимые сильные электролиты, записываются в виде ионов. NH₃ – газ, H₂O – слабый электролит (вода), записываются в виде молекул.
Сокращенное ионное уравнение: (Сокращаем ионы-зрители: Na⁺ и Cl⁻)
OH⁻(aq) + NH₄⁺(aq) → NH₃↑(g) + H₂O(l)
Объяснение: Реакция возможна, так как образуется газообразный аммиак (NH₃), который покидает реакционную среду, и вода.
Итоговый ответ (формулами веществ, которые реагируют с NaOH):
CuSO₄, MgCl₂, SO₂, HNO₃, NH₄Cl.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!