
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 191-192 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
2.
3. Химические свойства солей.
1) Соль + кислота → ______ + ______, если образуется ↓ или ↑.
Приведите примеры для каждого случая, напишите молекулярное и ионные уравнения реакций:
а) ___________________________
б) ___________________________
2) Соль + щёлочь → ______ + ______, если образуется ↓ или ↑.
Приведите примеры для каждого случая, напишите молекулярное и ионные уравнения реакций:
а) ___________________________
б) ___________________________
3) Соль + металл → новая соль + металл исходной соли, если:
— металл стоит в ряду напряжений до ______
— обе соли растворимы.
Например:
a) CuSO₄ + Fe = ______ + ______ молекулярное уравнение
полное ионное уравнение
сокращённое ионное уравнение
б) HgCl₂ + Cu — + ____________ молекулярное уравнение
полное ионное уравнение
сокращённое ионное уравнение
Ho! Cu + ZnCl₂ ≠
Pb + CuSO₄ ≠
4) Соль + соль → две новые соли, если образуется ↓.
Например:
а) BaCl₂ + ____________ = BaSO₄↓ + ____________ молекулярное уравнение
полное ионное уравнение
сокращённое ионное уравнение
б) BaCl₂ + ____________ = AgCl↓ + ____________ молекулярное уравнение
полное ионное уравнение
сокращённое ионное уравнение
Часть II
1. Запишите формулы следующих солей:
1) сульфат алюминия __________________________
2) гидросульфат алюминия __________________________
3) фосфат кальция __________________________
4) гидрофосфат кальция __________________________
5) дигидрофосфат кальция __________________________
6) карбонат калия __________________________
7) гидрокарбонат калия __________________________
Вопрос 2
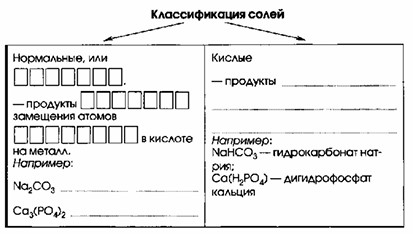
| Классификация солей | |
|---|---|
| Нормальные, или СРЕДНИЕ – продукты ПОЛНОГО замещения атомов ВОДОРОДА в кислоте на металл. Например: Na₂CO₃ – карбонат натрия Ca₃(PO₄)₂ – фосфат кальция | Кислые – продукты неполного замещения атомов водорода в кислоте на металл. Например: NaHCO₃ – гидрокарбонат натрия Ca(H₂PO₄)₂ – дигидрофосфат кальция |
Вопрос 3
1) Соль + кислота = соль + кислота
а) Na₂SiO₃ + 2HCl → 2NaCl + H₂SiO₃↓
б) K₂S + 2HNO₃ → 2KNO₃ + H₂S↑
2) Соль + щелочь = соль + основание
а) CuCl₂ + 2KOH → Cu(OH)₂↓ + 2KCl
б) (NH₄)₂SO₄ + 2NaOH → Na₂SO₄ + 2NH₃↑ + 2H₂O
3) Соль + металл = новая соль + металл исходной соли, если:
— металл стоит в ряду напряжений до H₂
— обе соли растворимы
Например:
а) CuSO₄ + Fe → FeSO₄ + Cu
Cu²⁺ + SO₄²⁻ + Fe → Fe²⁺ + SO₄²⁻ + Cu
Cu²⁺ + Fe → Fe²⁺ + Cu
б) HgCl₂ + Cu → Hg + CuCl₂
Hg²⁺ + 2Cl⁻ + Cu → Hg + Cu²⁺ + 2Cl⁻
Hg²⁺ + Cu → Hg + Cu²⁺
4) Соль + соль = две новые соли, если образуется осадок.
Например:
а) BaCl₂ + Li₂SO₄ → BaSO₄↓ + 2LiCl
Ba²⁺ + 2Cl⁻ + 2Li⁺ + SO₄²⁻ → BaSO₄↓ + 2Li⁺ + 2Cl⁻
Ba²⁺ + SO₄²⁻ → BaSO₄↓
б) BaCl₂ + 2AgNO₃ → Ba(NO₃)₂ + 2AgCl↓
Ba²⁺ + 2Cl⁻ + 2Ag⁺ + 2NO₃⁻ → Ba²⁺ + 2NO₃⁻ + 2AgCl↓
Ag⁺ + Cl⁻ → AgCl↓
Часть II
Вопрос 1
Сульфат алюминия — Al₂(SO₄)₃
Гидросульфат алюминия — Al(HSO₄)₃
Фосфат кальция — Ca₃(PO₄)₂
Гидрофосфат кальция — CaHPO₄
Дигидрофосфат кальция — Ca(H₂PO₄)₂
Карбонат калия — K₂CO₃
Гидрокарбонат калия — KHCO₃
Вопрос 2
Соли можно классифицировать по степени замещения атомов водорода в кислоте на атомы металла.
Нормальные, или СРЕДНИЕ соли
Определение: Это продукты ПОЛНОГО замещения атомов ВОДОРОДА в кислоте на металл.
Примеры:
- Na₂CO₃ (карбонат натрия) – в угольной кислоте (H₂CO₃) оба атома водорода замещены на натрий.
- Ca₃(PO₄)₂ (фосфат кальция) – в ортофосфорной кислоте (H₃PO₄) все три атома водорода замещены на кальций.
Кислые соли
Определение: Это продукты неполного замещения атомов водорода в кислоте на металл. В их составе остаются атомы водорода, способные к диссоциации. Такие соли образуются из многоосновных кислот.
Примеры:
- NaHCO₃ (гидрокарбонат натрия) – в угольной кислоте (H₂CO₃) замещен только один атом водорода.
- Ca(H₂PO₄)₂ (дигидрофосфат кальция) – в ортофосфорной кислоте (H₃PO₄) замещен только один атом водорода, два остались.
Вопрос 3
Химические свойства солей определяются их способностью вступать в реакции обмена или окислительно-восстановительные реакции.
1) Соль + кислота = новая соль + новая кислота
Условие протекания реакции: Реакция обмена между солью и кислотой протекает до конца (необратима) в одном из следующих случаев:
- Образуется осадок (нерастворимое вещество).
- Выделяется газ.
- Образуется слабая кислота (которая плохо диссоциирует на ионы или разлагается).
Пример А: Взаимодействие силиката натрия с соляной кислотой.
Молекулярное уравнение: Na₂SiO₃ + 2HCl → 2NaCl + H₂SiO₃↓
Объяснение: Кремниевая кислота (H₂SiO₃) является слабой и нерастворимой кислотой, поэтому она выпадает в осадок, что является движущей силой реакции.
Полное ионное уравнение: 2Na⁺ + SiO₃²⁻ + 2H⁺ + 2Cl⁻ → 2Na⁺ + 2Cl⁻ + H₂SiO₃↓
Объяснение: Все сильные электролиты (растворимые соли, сильные кислоты) записываются в виде ионов. Нерастворимые вещества (осадки) и слабые электролиты (слабые кислоты, вода) записываются в молекулярной форме.
Сокращённое ионное уравнение: SiO₃²⁻ + 2H⁺ → H₂SiO₃↓
Объяснение: Ионы, которые не участвуют в образовании осадка или газа (так называемые «зрители» ионы, в данном случае Na⁺ и Cl⁻), сокращаются.
Пример Б: Взаимодействие сульфида калия с азотной кислотой.
Молекулярное уравнение: K₂S + 2HNO₃ → 2KNO₃ + H₂S↑
Объяснение: Сероводород (H₂S) является слабой кислотой и газом, который выделяется из раствора, что также является движущей силой реакции.
Полное ионное уравнение: 2K⁺ + S²⁻ + 2H⁺ + 2NO₃⁻ → 2K⁺ + 2NO₃⁻ + H₂S↑
Сокращённое ионное уравнение: S²⁻ + 2H⁺ → H₂S↑
2) Соль + щёлочь = новая соль + новое основание
Условие протекания реакции: Реакция обмена между солью и щелочью протекает до конца, если образуется:
- Осадок (нерастворимое основание или нерастворимая соль).
- Газ (например, аммиак при реакции солей аммония со щелочами).
Пример А: Взаимодействие хлорида меди(II) с гидроксидом калия.
Молекулярное уравнение: CuCl₂ + 2KOH → Cu(OH)₂↓ + 2KCl
Объяснение: Гидроксид меди(II) (Cu(OH)₂) является нерастворимым основанием и выпадает в осадок.
Полное ионное уравнение: Cu²⁺ + 2Cl⁻ + 2K⁺ + 2OH⁻ → Cu(OH)₂↓ + 2K⁺ + 2Cl⁻
Сокращённое ионное уравнение: Cu²⁺ + 2OH⁻ → Cu(OH)₂↓
Пример Б: Взаимодействие сульфата аммония с гидроксидом натрия.
Молекулярное уравнение: (NH₄)₂SO₄ + 2NaOH → Na₂SO₄ + 2NH₃↑ + 2H₂O
Объяснение: Гидроксид аммония (NH₄OH), который должен был бы образоваться, является неустойчивым соединением и разлагается на аммиак (NH₃) – газ, и воду (H₂O). Выделение газа является движущей силой реакции.
Полное ионное уравнение: 2NH₄⁺ + SO₄²⁻ + 2Na⁺ + 2OH⁻ → 2Na⁺ + SO₄²⁻ + 2NH₃↑ + 2H₂O
Сокращённое ионное уравнение: 2NH₄⁺ + 2OH⁻ → 2NH₃↑ + 2H₂O (или NH₄⁺ + OH⁻ → NH₃↑ + H₂O)
3) Соль + металл = новая соль + металл исходной соли
Условие протекания реакции: Более активный металл вытесняет менее активный металл из раствора его соли. Для этого должны выполняться следующие условия:
- Металл (реагент) должен стоять в ряду напряжений (электрохимическом ряду активности металлов) до металла, входящего в состав соли. Например, Fe до Cu, Cu до Hg.
- Обе соли (исходная и образовавшаяся) должны быть растворимы в воде, чтобы реакция могла протекать в растворе.
Пример А: Взаимодействие сульфата меди(II) с железом.
Молекулярное уравнение: CuSO₄ + Fe → FeSO₄ + Cu
Объяснение: Железо (Fe) стоит в ряду активности металлов до меди (Cu), что означает, что железо более активно и может вытеснить медь из её соли. Сульфат меди(II) и сульфат железа(II) растворимы.
Полное ионное уравнение: Cu²⁺ + SO₄²⁻ + Fe → Fe²⁺ + SO₄²⁻ + Cu
Сокращённое ионное уравнение: Cu²⁺ + Fe → Fe²⁺ + Cu
Пример Б: Взаимодействие хлорида ртути(II) с медью.
Молекулярное уравнение: HgCl₂ + Cu → Hg + CuCl₂
Объяснение: Медь (Cu) стоит в ряду активности металлов до ртути (Hg). Хлорид ртути(II) и хлорид меди(II) растворимы.
Полное ионное уравнение: Hg²⁺ + 2Cl⁻ + Cu → Hg + Cu²⁺ + 2Cl⁻
Сокращённое ионное уравнение: Hg²⁺ + Cu → Hg + Cu²⁺
4) Соль + соль = две новые соли
Условие протекания реакции: Реакция обмена между двумя солями протекает до конца, если в результате образуется осадок. Обе исходные соли должны быть растворимы.
Пример А: Взаимодействие хлорида бария с сульфатом лития.
Молекулярное уравнение: BaCl₂ + Li₂SO₄ → BaSO₄↓ + 2LiCl
Объяснение: При смешивании растворов хлорида бария и сульфата лития образуется нерастворимый сульфат бария (BaSO₄), который выпадает в осадок.
Полное ионное уравнение: Ba²⁺ + 2Cl⁻ + 2Li⁺ + SO₄²⁻ → BaSO₄↓ + 2Li⁺ + 2Cl⁻
Сокращённое ионное уравнение: Ba²⁺ + SO₄²⁻ → BaSO₄↓
Пример Б: Взаимодействие хлорида бария с нитратом серебра.
Молекулярное уравнение: BaCl₂ + 2AgNO₃ → Ba(NO₃)₂ + 2AgCl↓
Объяснение: При смешивании растворов хлорида бария и нитрата серебра образуется нерастворимый хлорид серебра (AgCl), который выпадает в осадок.
Полное ионное уравнение: Ba²⁺ + 2Cl⁻ + 2Ag⁺ + 2NO₃⁻ → Ba²⁺ + 2NO₃⁻ + 2AgCl↓
Сокращённое ионное уравнение: Ag⁺ + Cl⁻ → AgCl↓
Часть II
Вопрос 1
Для составления формул солей необходимо знать заряды ионов металла (или аммония) и кислотных остатков, а затем уравнять суммарные заряды катионов и анионов, чтобы молекула была электронейтральной.
1. Сульфат алюминия
Ион алюминия: Al³⁺
Сульфат-ион (остаток серной кислоты H₂SO₄): SO₄²⁻
Для уравнивания зарядов (наименьшее общее кратное 3 и 2 равно 6): нужно 2 иона Al³⁺ (2*3 = 6) и 3 иона SO₄²⁻ (3*2 = 6).
Формула: Al₂(SO₄)₃
2. Гидросульфат алюминия
Ион алюминия: Al³⁺
Гидросульфат-ион (кислый остаток серной кислоты H₂SO₄): HSO₄⁻
Для уравнивания зарядов (3 и 1): нужно 1 ион Al³⁺ и 3 иона HSO₄⁻.
Формула: Al(HSO₄)₃
3. Фосфат кальция
Ион кальция: Ca²⁺
Фосфат-ион (остаток ортофосфорной кислоты H₃PO₄): PO₄³⁻
Для уравнивания зарядов (наименьшее общее кратное 2 и 3 равно 6): нужно 3 иона Ca²⁺ (3*2 = 6) и 2 иона PO₄³⁻ (2*3 = 6).
Формула: Ca₃(PO₄)₂
4. Гидрофосфат кальция
Ион кальция: Ca²⁺
Гидрофосфат-ион (кислый остаток ортофосфорной кислоты H₃PO₄): HPO₄²⁻
Для уравнивания зарядов (2 и 2): нужно 1 ион Ca²⁺ и 1 ион HPO₄²⁻.
Формула: CaHPO₄
5. Дигидрофосфат кальция
Ион кальция: Ca²⁺
Дигидрофосфат-ион (кислый остаток ортофосфорной кислоты H₃PO₄): H₂PO₄⁻
Для уравнивания зарядов (2 и 1): нужно 1 ион Ca²⁺ и 2 иона H₂PO₄⁻.
Формула: Ca(H₂PO₄)₂
6. Карбонат калия
Ион калия: K⁺
Карбонат-ион (остаток угольной кислоты H₂CO₃): CO₃²⁻
Для уравнивания зарядов (1 и 2): нужно 2 иона K⁺ и 1 ион CO₃²⁻.
Формула: K₂CO₃
7. Гидрокарбонат калия
Ион калия: K⁺
Гидрокарбонат-ион (кислый остаток угольной кислоты H₂CO₃): HCO₃⁻
Для уравнивания зарядов (1 и 1): нужно 1 ион K⁺ и 1 ион HCO₃⁻.
Формула: KHCO₃

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!