
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 196-197 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
1. Генетическая связь — это _____________________________________________
_______________________________________________________________
_______________________________________________________________
2. Генетический ряд металла объединяет:
— один и тот же элемент-металл;
— вещества разных классов, образованные этим металлом;
— взаимопревращения веществ ряда.
На примере:
а)
Название и формула вещества, обозначенного X:
______________________________________________________________
Уравнения реакций, соответствующих приведённым выше превращениям:
______________________________________________________________
______________________________________________________________
______________________________________________________________
______________________________________________________________
______________________________________________________________
б)
Названия и формулы веществ, обозначенных X и Y:
______________________________________________________________
______________________________________________________________
Уравнения реакций, соответствующих приведённым выше превращениям:
______________________________________________________________
______________________________________________________________
______________________________________________________________
______________________________________________________________
3. Генетический ряд неметалла объединяет:
— _______________________________________
— _______________________________________
— _______________________________________
На примере:
a)
Название и формула вещества, обозначенного X:
______________________________________________________________
Уравнения реакций, соответствующих приведённым выше превращениям:
______________________________________________________________
______________________________________________________________
______________________________________________________________
______________________________________________________________
б)
Названия и формулы веществ, обозначенных X и Y:
______________________________________________________________
______________________________________________________________
Уравнения реакций, соответствующих приведённым выше превращениям:
______________________________________________________________
______________________________________________________________
______________________________________________________________
______________________________________________________________
§40
Часть I
Вопрос 1
Генетическая связь — это взаимосвязь между веществами различных классов, которая основывается на их способности к взаимным превращениям и демонстрирует общность их происхождения, то есть генезис химических соединений.
Вопрос 2
а)
Название и формула вещества, обозначенного X: Li₂O
Уравнения реакций, соответствующих приведённым выше превращениям:
1) 4Li + O₂ → 2Li₂O
2) Li₂O + H₂O → 2LiOH
3) LiOH + HCl → LiCl + H₂O
4) LiCl + AgNO₃ → LiNO₃ + AgCl↓
5) Li₂O + 2HCl → 2LiCl + H₂O
6) 2Li + 2H₂O → 2LiOH + H₂↑
7) LiOH + HNO₃ → LiNO₃ + H₂O
б)
Названия и формулы веществ, обозначенных X и Y:
CuO и Cu(OH)₂.
Уравнения реакций, соответствующих приведённым выше превращениям:
1) 2Cu + O₂ → 2CuO
2) CuO + H₂SO₄ → CuSO₄ + H₂O
3) CuSO₄ + 2NaOH → Cu(OH)₂↓ + Na₂SO₄
4) Cu(OH)₂ + H₂SO₄ → CuSO₄ + 2H₂O
5) CuSO₄ + 2NaOH → Cu(OH)₂↓ + Na₂SO₄
6) Cu(OH)₂ → CuO + H₂O
7) CuO + H₂ → Cu + H₂O
Вопрос 3
Генетический ряд неметалла объединяет:
— Элемент неметалла
— Соединения разных классов, образованные этим неметаллом
— Взаимные превращения этих соединений.
a)
Название и формула вещества, обозначенного X: SO₂
Уравнения реакций, соответствующих приведённым выше превращениям:
1) S + O₂ → SO₂
2) SO₂ + H₂O → H₂SO₃
3) H₂SO₃ + 2NaOH → Na₂SO₃ + 2H₂O
4) Na₂SO₃ + 2HCl → SO₂↑ + H₂O + 2NaCl
Это генетический ряд серы.
б)
Названия и формулы веществ, обозначенных X и Y:
X: Оксид кремния(IV), SiO₂
Y: Кремниевая кислота, H₂SiO₃
Уравнения реакций, соответствующих приведённым выше превращениям:
1) Si + O₂ → SiO₂
2) SiO₂ + 2NaOH → Na₂SiO₃ + H₂O
3) H₂SiO₃ + 2NaOH → Na₂SiO₃ + 2H₂O
4) Na₂SiO₃ + 2HCl → H₂SiO₃↓ + 2NaCl
5) H₂SiO₃ → SiO₂ + H₂O
6) SiO₂ + 2Mg → Si + 2MgO (или SiO₂ + 2C → Si + 2CO)
Это генетический ряд кремния.
§40
Часть I
Вопрос 1
Генетическая связь представляет собой взаимосвязь между веществами, принадлежащими к различным классам, которая проявляется через их способность к взаимным химическим превращениям. Она отражает единство происхождения этих веществ, демонстрируя их общий генезис. Данный тип связи показывает, как вещества разных классов могут трансформироваться друг в друга в результате химических реакций, сохраняя определенную последовательность и закономерность. Например, органические соединения могут переходить из одного класса в другой, что свидетельствует о тесной взаимосвязи между ними. Таким образом, генетическая связь является важным принципом, объясняющим единство и взаимосвязь химических веществ в природе.
Вопрос 2
а)
Шаг 1: Определение вещества X.
Мы видим, что Литий (Li) превращается в X, а затем X превращается в Гидроксид лития (LiOH).
Литий (Li) — это щелочной металл. Щелочные металлы при взаимодействии с кислородом образуют оксиды. Оксиды активных металлов (основные оксиды) затем реагируют с водой, образуя гидроксиды (основания).
Следовательно, наиболее логичным веществом X, которое получается из Li и из которого получается LiOH, является оксид лития (Li₂O).
Название и формула вещества, обозначенного X: Оксид лития, Li₂O
Шаг 2: Написание уравнений реакций.
1. Li → X (Li₂O):
Принцип: Металл (литий) реагирует с неметаллом (кислородом) с образованием оксида. Это реакция соединения.
Уравнение: 4Li + O₂ → 2Li₂O
Объяснение: Четыре атома лития реагируют с одной молекулой кислорода, образуя две молекулы оксида лития.
2. X (Li₂O) → LiOH:
Принцип: Основный оксид (оксид лития) активного металла реагирует с водой, образуя соответствующее основание (гидроксид лития). Это реакция соединения (гидратации).
Уравнение: Li₂O + H₂O → 2LiOH
Объяснение: Одна молекула оксида лития реагирует с одной молекулой воды, образуя две молекулы гидроксида лития.
3. LiOH → LiCl:
Принцип: Основание (гидроксид лития) реагирует с кислотой (соляной кислотой, HCl) с образованием соли (хлорида лития) и воды. Это реакция нейтрализации (обмена).
Уравнение: LiOH + HCl → LiCl + H₂O
Объяснение: Одна молекула гидроксида лития реагирует с одной молекулой соляной кислоты, образуя одну молекулу хлорида лития и одну молекулу воды.
4. LiCl → LiNO₃:
Принцип: Соль (хлорид лития) реагирует с другой солью (нитратом серебра, AgNO₃) с образованием двух новых солей. Реакция обмена идет до конца, если образуется осадок, газ или вода. В данном случае, хлорид серебра (AgCl) является нерастворимым осадком.
Уравнение: LiCl + AgNO₃ → LiNO₃ + AgCl↓
Объяснение: Одна молекула хлорида лития реагирует с одной молекулой нитрата серебра, образуя одну молекулу нитрата лития (растворимая соль) и одну молекулу хлорида серебра (белый осадок).
5. X (Li₂O) → LiCl:
Принцип: Основный оксид (оксид лития) реагирует с кислотой (соляной кислотой) с образованием соли (хлорида лития) и воды. Это реакция обмена (нейтрализации оксида).
Уравнение: Li₂O + 2HCl → 2LiCl + H₂O
Объяснение: Одна молекула оксида лития реагирует с двумя молекулами соляной кислоты, образуя две молекулы хлорида лития и одну молекулу воды.
6. Li → LiOH:
Принцип: Активный металл (литий) реагирует с водой, образуя основание (гидроксид лития) и выделяя водород. Это окислительно-восстановительная реакция.
Уравнение: 2Li + 2H₂O → 2LiOH + H₂↑
Объяснение: Два атома лития реагируют с двумя молекулами воды, образуя две молекулы гидроксида лития и одну молекулу газообразного водорода.
7. LiOH → LiNO₃:
Принцип: Основание (гидроксид лития) реагирует с кислотой (азотной кислотой, HNO₃) с образованием соли (нитрата лития) и воды. Это реакция нейтрализации (обмена).
Уравнение: LiOH + HNO₃ → LiNO₃ + H₂O
Объяснение: Одна молекула гидроксида лития реагирует с одной молекулой азотной кислоты, образуя одну молекулу нитрата лития и одну молекулу воды.
б)
Шаг 1: Определение веществ X и Y.
Cu → X: Медь (Cu) — это металл. При взаимодействии с кислородом металлы образуют оксиды. Медь обычно образует оксид меди(II). Предположим, X = CuO (Оксид меди(II)).
X (CuO) → CuSO₄: Оксид меди(II) (основный оксид) реагирует с кислотой (серной кислотой, H₂SO₄) с образованием соли (сульфата меди(II)) и воды. Это подтверждает, что X = CuO.
CuSO₄ → Y: Сульфат меди(II) (растворимая соль) при взаимодействии со щелочью (например, NaOH) образует нерастворимое основание — гидроксид меди(II). Предположим, Y = Cu(OH)₂ (Гидроксид меди(II)).
Y (Cu(OH)₂) → CuSO₄: Гидроксид меди(II) (нерастворимое основание) реагирует с кислотой (серной кислотой) с образованием соли (сульфата меди(II)) и воды. Это подтверждает, что Y = Cu(OH)₂.
Y (Cu(OH)₂) → X (CuO): Гидроксид меди(II) при нагревании разлагается на оксид меди(II) и воду. Это также подтверждает наши предположения для X и Y.
X (CuO) → Cu: Оксид меди(II) может быть восстановлен до чистой меди, например, водородом или углеродом при нагревании.
Названия и формулы веществ, обозначенных X и Y:
X: Оксид меди(II), CuO
Y: Гидроксид меди(II), Cu(OH)₂
Шаг 2: Написание уравнений реакций.
1. Cu → X (CuO):
Принцип: Металл (медь) реагирует с неметаллом (кислородом) с образованием оксида. Это реакция соединения.
Уравнение: 2Cu + O₂ → 2CuO
Объяснение: Два атома меди реагируют с одной молекулой кислорода при нагревании, образуя две молекулы оксида меди(II) (черное вещество).
2. X (CuO) → CuSO₄:
Принцип: Основный оксид (оксид меди(II)) реагирует с кислотой (серной кислотой) с образованием соли (сульфата меди(II)) и воды. Это реакция обмена.
Уравнение: CuO + H₂SO₄ → CuSO₄ + H₂O
Объяснение: Одна молекула оксида меди(II) реагирует с одной молекулой серной кислоты, образуя одну молекулу сульфата меди(II) (голубой раствор) и одну молекулу воды.
3. CuSO₄ → Y (Cu(OH)₂):
Принцип: Растворимая соль (сульфат меди(II)) реагирует со щелочью (гидроксидом натрия, NaOH) с образованием нерастворимого основания (гидроксида меди(II)) и новой соли. Это реакция обмена, идущая до конца за счет образования осадка.
Уравнение: CuSO₄ + 2NaOH → Cu(OH)₂↓ + Na₂SO₄
Объяснение: Одна молекула сульфата меди(II) реагирует с двумя молекулами гидроксида натрия, образуя одну молекулу гидроксида меди(II) (голубой студенистый осадок) и одну молекулу сульфата натрия (растворимая соль).
4. Y (Cu(OH)₂) → CuSO₄:
Принцип: Нерастворимое основание (гидроксид меди(II)) реагирует с кислотой (серной кислотой) с образованием соли (сульфата меди(II)) и воды. Это реакция нейтрализации (обмена).
Уравнение: Cu(OH)₂ + H₂SO₄ → CuSO₄ + 2H₂O
Объяснение: Одна молекула гидроксида меди(II) реагирует с одной молекулой серной кислоты, образуя одну молекулу сульфата меди(II) и две молекулы воды.
5. CuSO₄ → Y (Cu(OH)₂):
Принцип: Это повторение реакции 3. Подчеркивает возможность получения гидроксида меди из сульфата.
Уравнение: CuSO₄ + 2NaOH → Cu(OH)₂↓ + Na₂SO₄
6. Y (Cu(OH)₂) → X (CuO):
Принцип: Нерастворимые гидроксиды металлов при нагревании разлагаются на соответствующий оксид и воду. Это реакция разложения.
Уравнение: Cu(OH)₂ → CuO + H₂O
Объяснение: Одна молекула гидроксида меди(II) при нагревании разлагается на одну молекулу оксида меди(II) (черное вещество) и одну молекулу воды.
7. X (CuO) → Cu:
Принцип: Оксид металла может быть восстановлен до чистого металла с помощью восстановителя (например, водорода, угарного газа, углерода) при нагревании. Это окислительно-восстановительная реакция.
Уравнение: CuO + H₂ → Cu + H₂O
Объяснение: Одна молекула оксида меди(II) реагирует с одной молекулой водорода при нагревании, образуя один атом меди (красновато-коричневый металл) и одну молекулу воды.
Вопрос 3
Генетический ряд неметалла аналогичен генетическому ряду металла, но центральным элементом здесь является неметалл. Он включает:
- Сам элемент неметалл: Исходное простое вещество.
- Соединения разных классов, образованные этим неметаллом: Это могут быть:
Оксиды: Например, кислотные оксиды (SO₂, SiO₂).
Гидроксиды: В случае неметаллов это будут кислоты (H₂SO₃, H₂SiO₃).
Соли: Например, сульфиты, силикаты (Na₂SO₃, Na₂SiO₃). - Взаимопревращения этих соединений: Реакции, позволяющие переходить между различными формами соединений неметалла.
Ответ: Генетический ряд неметалла объединяет:
- Элемент неметалла
- Соединения разных классов, образованные этим неметаллом
- Взаимные превращения этих соединений.
а)
Шаг 1: Определение вещества X.
Мы видим, что Сера (S) превращается в X, а затем X превращается в Сернистую кислоту (H₂SO₃).
Сера (S) — это неметалл. Неметаллы при взаимодействии с кислородом образуют кислотные оксиды. Кислотные оксиды затем реагируют с водой, образуя соответствующие кислоты.
Следовательно, наиболее логичным веществом X, которое получается из S и из которого получается H₂SO₃, является оксид серы(IV) (SO₂). Также, из сульфита натрия (Na₂SO₃) можно получить SO₂.
Название и формула вещества, обозначенного X: Оксид серы(IV), SO₂
Шаг 2: Написание уравнений реакций.
1. S → X (SO₂):
Принцип: Неметалл (сера) реагирует с неметаллом (кислородом) с образованием кислотного оксида. Это реакция соединения.
Уравнение: S + O₂ → SO₂
Объяснение: Один атом серы реагирует с одной молекулой кислорода при горении, образуя одну молекулу оксида серы(IV) (сернистого газа).
2. X (SO₂) → H₂SO₃:
Принцип: Кислотный оксид (оксид серы(IV)) реагирует с водой, образуя соответствующую кислоту (сернистую кислоту). Это реакция соединения.
Уравнение: SO₂ + H₂O → H₂SO₃
Объяснение: Одна молекула оксида серы(IV) реагирует с одной молекулой воды, образуя одну молекулу сернистой кислоты (слабая кислота).
3. H₂SO₃ → Na₂SO₃:
Принцип: Кислота (сернистая кислота) реагирует с основанием (гидроксидом натрия, NaOH) с образованием соли (сульфита натрия) и воды. Это реакция нейтрализации (обмена).
Уравнение: H₂SO₃ + 2NaOH → Na₂SO₃ + 2H₂O
Объяснение: Одна молекула сернистой кислоты реагирует с двумя молекулами гидроксида натрия, образуя одну молекулу сульфита натрия и две молекулы воды.
4. Na₂SO₃ → X (SO₂):
Принцип: Соль слабой кислоты (сульфит натрия) реагирует с сильной кислотой (например, соляной кислотой, HCl) с образованием новой соли, воды и оксида слабой кислоты (который выделяется в виде газа). Это реакция обмена.
Уравнение: Na₂SO₃ + 2HCl → SO₂↑ + H₂O + 2NaCl
Объяснение: Одна молекула сульфита натрия реагирует с двумя молекулами соляной кислоты, образуя газообразный оксид серы(IV), воду и две молекулы хлорида натрия.
Это генетический ряд серы.
б)
Шаг 1: Определение веществ X и Y.
Si → X: Кремний (Si) — это неметалл. При взаимодействии с кислородом образует оксид кремния(IV). Предположим, X = SiO₂ (Оксид кремния(IV)).
X (SiO₂) → H₂SiO₃: Оксид кремния(IV) (кремнезем) является кислотным оксидом, но, в отличие от SO₂ или CO₂, он не реагирует напрямую с водой с образованием кремниевой кислоты (H₂SiO₃). Кремниевая кислота является очень слабой и нерастворимой кислотой. Ее обычно получают из растворимых солей кремниевой кислоты — силикатов — при действии на них сильных кислот. Однако в рамках генетического ряда подразумевается, что SiO₂ является ангидридом H₂SiO₃.
H₂SiO₃ → Na₂SiO₃: Кремниевая кислота (слабая кислота) реагирует с основанием (гидроксидом натрия) с образованием соли (силиката натрия). Это подтверждает, что H₂SiO₃ является частью ряда.
Na₂SiO₃ → Y: Силикат натрия (растворимая соль) при взаимодействии с сильной кислотой образует нерастворимую кремниевую кислоту. Предположим, Y = H₂SiO₃ (Кремниевая кислота).
Y (H₂SiO₃) → X (SiO₂): Кремниевая кислота при нагревании разлагается на оксид кремния(IV) и воду. Это подтверждает наши предположения для X и Y.
X (SiO₂) → Si: Оксид кремния(IV) может быть восстановлен до чистого кремния при высоких температурах.
Названия и формулы веществ, обозначенных X и Y:
X: Оксид кремния(IV), SiO₂
Y: Кремниевая кислота, H₂SiO₃
Шаг 2: Написание уравнений реакций.
1. Si → X (SiO₂):
Принцип: Неметалл (кремний) реагирует с неметаллом (кислородом) с образованием оксида. Это реакция соединения.
Уравнение: Si + O₂ → SiO₂
Объяснение: Один атом кремния реагирует с одной молекулой кислорода при нагревании, образуя одну молекулу оксида кремния(IV) (кварц, песок).
2. X (SiO₂) → H₂SiO₃:
Принцип: Как было сказано, SiO₂ напрямую с водой не реагирует. Для получения H₂SiO₃ из SiO₂ сначала получают силикат, а затем из силиката — кислоту. В данном случае, реакция 2 в решении показывает получение силиката из оксида.
Уравнение (промежуточная стадия): SiO₂ + 2NaOH → Na₂SiO₃ + H₂O
Объяснение: Оксид кремния(IV) (кислотный оксид) реагирует с сильным основанием (гидроксидом натрия) при нагревании, образуя силикат натрия (растворимая соль) и воду. Затем из силиката натрия можно получить H₂SiO₃ (см. реакцию 4).
3. H₂SiO₃ → Na₂SiO₃:
Принцип: Кислота (кремниевая кислота) реагирует с основанием (гидроксидом натрия) с образованием соли (силиката натрия) и воды. Это реакция нейтрализации (обмена).
Уравнение: H₂SiO₃ + 2NaOH → Na₂SiO₃ + 2H₂O
Объяснение: Одна молекула кремниевой кислоты реагирует с двумя молекулами гидроксида натрия, образуя одну молекулу силиката натрия и две молекулы воды.
4. Na₂SiO₃ → Y (H₂SiO₃):
Принцип: Соль слабой нерастворимой кислоты (силикат натрия) реагирует с сильной кислотой (например, соляной кислотой, HCl) с образованием новой соли и осадка слабой нерастворимой кислоты. Это реакция обмена, идущая до конца за счет образования осадка.
Уравнение: Na₂SiO₃ + 2HCl → H₂SiO₃↓ + 2NaCl
Объяснение: Одна молекула силиката натрия реагирует с двумя молекулами соляной кислоты, образуя осадок кремниевой кислоты (студенистый белый осадок) и две молекулы хлорида натрия.
5. Y (H₂SiO₃) → X (SiO₂):
Принцип: Кремниевая кислота (очень слабая и нерастворимая) при нагревании разлагается на соответствующий оксид и воду. Это реакция разложения.
Уравнение: H₂SiO₃ → SiO₂ + H₂O
Объяснение: Одна молекула кремниевой кислоты при нагревании разлагается на одну молекулу оксида кремния(IV) и одну молекулу воды.
6. X (SiO₂) → Si:
Принцип: Оксид неметалла может быть восстановлен до простого неметалла с помощью сильного восстановителя (например, магния или углерода) при высокой температуре. Это окислительно-восстановительная реакция.
Уравнение: SiO₂ + 2Mg → Si + 2MgO (или SiO₂ + 2C → Si + 2CO)
Объяснение: Одна молекула оксида кремния(IV) реагирует с двумя атомами магния при нагревании, образуя один атом кремния и две молекулы оксида магния.
Это генетический ряд кремния.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.


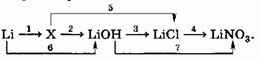
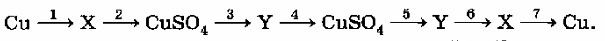
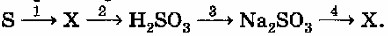
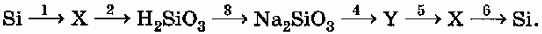



Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!