
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 20-22 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
Часть I
1.
2. Аᵣ элемента показывает, во сколько раз масса его атома больше ____________________________
Она указана в таблице Д. И. Менделеева, например*:
Aᵣ(H) = ☐
Aᵣ(O) = ☐☐
Aᵣ(N) = ☐☐
Aᵣ(☐☐) = 56
Aᵣ(☐☐) = 64
Aᵣ(☐☐) = 35,5
* Укажите информацию, которую несёт символика элемента (подпишите, что обозначают слова, числа и знаки, размещённые в каждой клетке таблицы).
3. Мᵣ вещества показывает, во сколько раз масса ________________________________________________
Мᵣ равна сумме Аᵣ элементов с учётом их индексов.
Mᵣ(H₂O) =
Mᵣ(H₂SO₄) =
Mᵣ(CO₂) =
Mᵣ[Ca₃(PO₄)₂] =
4. Заполните таблицу «Информация о веществе».
| ИНФОРМАЦИЯ О ВЕЩЕСТВЕ | O₂ | H₃PO₄ |
|---|---|---|
| Название вещества | ||
| Тип вещества (простое или сложное) | ||
| Качественный состав (какими элементами образовано вещество) | ||
| Количественный состав (сколько атомов каждого элемента содержится в молекуле) | ||
| Mᵣ вещества | ||
| Массовая доля каждого элемента в составе вещества |
Часть II
1. Установите соответствие между формулой вещества и составом молекулы вещества.
ФОРМУЛА ВЕЩЕСТВА
А) CH₄
Б) N₂O₅
В) PCl₅
Г) SiCl₄
СОСТАВ МОЛЕКУЛЫ ВЕЩЕСТВА
1) один атом кремния и четыре атома водорода
2) один атом фосфора и пять атомов хлора
3) один атом углерода и два атома кислорода
4) один атом углерода и четыре атома водорода
5) один атом кремния и четыре атома хлора
6) два атома азота и пять атомов кислорода
2. Разделите указанные вещества на простые и сложные:
N₂, NO, O₃, AlCl₃, Na₂SO₄, FeCl₂, Ca, Cl₂, KMnO₄, P₄.
| ПРОСТЫЕ ВЕЩЕСТВА | |
| СЛОЖНЫЕ ВЕЩЕСТВА |
3. Исправьте неверно вычисленные значения относительных молекулярных масс для некоторых из приведённых формул.
1) Mᵣ(CH₃COOH) = 60
2) Mᵣ(CaCO₃) = 100
3) Mᵣ(AlCl₃) = 132
4) Mᵣ(HNO₃) = 63
5) Mᵣ(Ca(OH)₂) = 74
6) Mᵣ(Al₂(SO₄)₃) = 315
Вопрос 1
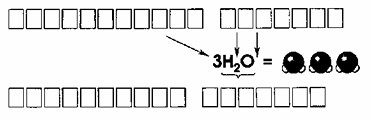
КОЭФФИЦИЕНТ ИНДЕКСЫ
3 H₂O
ХИМИЧЕСКАЯ ФОРМУЛА
Вопрос 2
Ar элемента показывает, во сколько раз масса его атома больше 1/12
массы атома углерода С-12
Она указана в таблице Д. И. Менделеева, например:
Aᵣ(H) = 1
Aᵣ(O) = 16
Aᵣ(N) = 14
Aᵣ(Fe) = 56
Aᵣ(Cu) = 64
Aᵣ(Cl) = 35,5
Вопрос 3
Mᵣ вещества показывает, во сколько раз масса молекулы вещества больше 1/12 массы атома углерода С-12
Mᵣ равна сумме Aᵣ элементов с учетом их индексов.
Mᵣ(H₂O) = 1 · 2 + 16 = 18
Mᵣ(H₂SO₄) = 1 · 2 + 32 + 16 · 4 = 98
Mᵣ(CO₂) = 12 + 16 · 2 = 44
Mᵣ(Ca₃(PO₄)₂) = 40 · 3 + (31 + 16 · 4) · 2 = 310
Вопрос 4
| ИНФОРМАЦИЯ О ВЕЩЕСТВЕ | O₂ | H₃PO₄ |
|---|---|---|
| Название вещества | Кислород | Фосфорная кислота |
| Тип вещества | Простое | Сложное |
| Качественный состав | Кислород | Водород, фосфор, кислород |
| Количественный состав | 2 атома кислорода | 3 атома водорода, 1 атом фосфора, 4 атома кислорода |
| Mᵣ вещества | Mᵣ(O₂) = 16 · 2 = 32 | Mᵣ(H₃PO₄) = 1 · 3 + 31 + 16 · 4 = 98 |
| Массовая доля каждого элемента в составе вещества | ω(O) = 100% | ω(H) = 3Aᵣ(H) / Mᵣ(H₃PO₄) = 3 / 98 = 0,031 = 3,1% ω(P) = Aᵣ(P) / Mᵣ(H₃PO₄) = 31 / 98 = 0,316 = 31,6% ω(O) = 4Aᵣ(O) / Mᵣ(H₃PO₄) = 64 / 98 = 0,653 = 65,3% |
Часть II
Вопрос 1
| A | Б | В | Г |
|---|---|---|---|
| 4 | 6 | 2 | 5 |
Вопрос 2
| Простые вещества | N₂, O₃, Ca, Cl₂, P₄ |
| Сложные вещества | NO, AlCl₃, Na₂SO₄, FeCl₂, KMnO₄ |
Вопрос 3
1. Mr(CH₃COOH) = 12 + 3 + 12 + 16 + 16 + 1 = 60 – верно
2. Mr(CaCO₃) = 40 + 12 + 16 + 16 + 16 = 100 – верно
3. Mr(AlCl₃) = 27 + 35,5 + 35,5 + 35,5 = 133,5 – 132 неверно
4. Mr(HNO₃) = 1 + 14 + 16 + 16 + 16 = 63 – верно
5. Mr(Ca(OH)₂) = 40 + 16 + 1 + 16 + 1 = 74 – верно
6. Mr(Al₂(SO₄)₃) = 27 + 27 + (32 + 16 · 4) · 3 = 342 – 315 неверно
Ответ: 3, 6.
Часть I
Вопрос 1
Шаг 1: Что такое коэффициент?
Сначала давайте посмотрим на число перед формулой — это коэффициент. В формуле \(3H_2O\) коэффициент равен 3. Это означает, что мы рассматриваем три молекулы воды.
— То есть, перед формулой стоит число 3, что означает, что у нас есть три молекулы вещества.
Шаг 2: Что такое индексы?
Теперь разберем индексы, которые находятся внизу рядом с символами химических элементов. В химической формуле воды \(H_2O\):
— Индекс 2 у водорода (H) означает, что в одной молекуле воды содержится два атома водорода.
— Индекс у кислорода (O) отсутствует, но это означает, что в каждой молекуле воды один атом кислорода.
Таким образом, в одной молекуле воды:
— 2 атома водорода.
— 1 атом кислорода.
Шаг 3: Что такое химическая формула?
Теперь у нас есть формула \(H_2O\). Это обозначение для воды, где:
- \(H_2\) — это два атома водорода.
- \(O\) — это один атом кислорода.
Шаг 4: Как все это применить?
Теперь посмотрим на всё вместе: 3H₂O.
— Мы видим, что перед формулой стоит коэффициент 3, это значит, что у нас есть три молекулы воды.
— В каждой молекуле воды два атома водорода и один атом кислорода.
Когда мы умножаем на 3:
— У нас будет 6 атомов водорода (3 × 2 атома водорода).
— У нас будет 3 атома кислорода (3 × 1 атом кислорода).
Итог:
1. Коэффициент: 3 (три молекулы воды).
2. Индексы:
- У водорода индекс 2 — два атома водорода в молекуле.
- У кислорода индекс 1 — один атом кислорода в молекуле.
3. Химическая формула: \(3H_2O\) (три молекулы воды).
Вопрос 2
Аᵣ элемента показывает, во сколько раз масса его атома больше 1/12 массы атома углерода С-12.
Что такое относительная атомная масса (\(A_r\))?
Относительная атомная масса (\(A_r\)) — это безразмерная величина, которая показывает, во сколько раз средняя масса атома данного химического элемента больше 1/12 массы атома изотопа углерода-12 (\(^{12}C\)).
Почему именно 1/12 массы атома углерода С-12?
Исторически для определения атомных масс использовались разные эталоны (например, водород или кислород), но в 1961 году Международный союз теоретической и прикладной химии (ИЮПАК) принял в качестве единого стандарта 1/12 массы атома изотопа углерода-12 (\(^{12}C\)).
Причины выбора углерода-12:
— Стабильность: Изотоп углерода-12 очень стабилен.
— Распространенность: Углерод широко распространен в природе.
— Удобство: Его использование позволяет получить атомные массы большинства элементов, близкие к целым числам, что удобно для расчетов.
Эталонная масса, равная 1/12 массы атома углерода-12, называется атомной единицей массы (а.е.м.) или дальтоном (Да).
— 1 а.е.м. \(= 1/12 \times\) масса атома \(^{12}C \approx 1.6605 \times 10^{-27}\) кг.
Как это работает на практике?
Когда мы говорим, что относительная атомная масса кислорода \(A_r(O) \approx 16\), это означает, что средняя масса атома кислорода примерно в 16 раз больше, чем 1/12 массы атома углерода-12.
Где найти \(A_r\)?
Значения относительных атомных масс для каждого химического элемента указаны в периодической таблице Д. И. Менделеева. Обычно они приводятся под символом элемента и, как правило, округлены до целых чисел или до одного-двух знаков после запятой для удобства расчетов. Однако важно помнить, что точные значения являются дробными, так как они учитывают среднюю массу атомов природной смеси изотопов данного элемента.
Пример:
— Водород (H): В таблице Менделеева \(A_r(H) \approx 1.008\). Это означает, что атом водорода в среднем примерно в 1.008 раза тяжелее 1/12 массы атома углерода-12.
— Кислород (O): В таблице Менделеева \(A_r(O) \approx 15.999\). Это означает, что атом кислорода в среднем примерно в 15.999 раза тяжелее 1/12 массы атома углерода-12.
Таким образом, относительная атомная масса — это удобный способ сравнивать массы атомов разных элементов без использования очень малых абсолютных значений массы в килограммах или граммах.
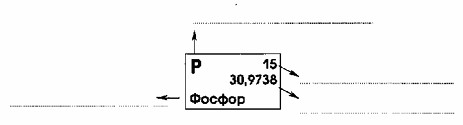
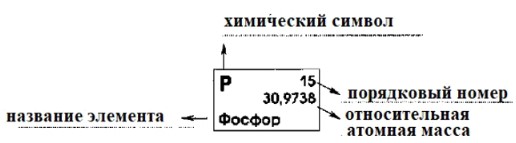
На представленном изображении показан элементный блок из Периодической системы химических элементов Д.И. Менделеева, в данном случае — для элемента Фосфор (P). Каждый такой блок содержит ключевую информацию о конкретном химическом элементе.
Рассмотрим подробно каждый обозначенный компонент:
Химический символ (P):
— Это буквенное обозначение элемента. Каждый химический элемент имеет свой уникальный символ, состоящий из одной или двух латинских букв (в данном случае «P» для Фосфора). Символ используется для краткой записи химических формул и уравнений реакций.
Порядковый номер (15):
— Это целое число, расположенное обычно в верхнем правом или левом углу символа. Порядковый номер элемента равен количеству протонов в ядре его атома. Он также определяет место элемента в Периодической системе и является его уникальной характеристикой. Для Фосфора порядковый номер 15 означает, что атом Фосфора имеет 15 протонов в ядре. В нейтральном атоме количество электронов также равно порядковому номеру.
Относительная атомная масса (30,9738):
— Это значение, как правило, не является целым числом и представляет собой среднюю массу атома элемента, выраженную в атомных единицах массы (а.е.м.). Она учитывает распространенность различных изотопов элемента в природе. Для Фосфора относительная атомная масса составляет 30,9738. В большинстве школьных задач это значение округляется до ближайшего целого числа (в данном случае до 31) и называется массовым числом, которое приблизительно равно сумме протонов и нейтронов в ядре атома.
Название элемента (Фосфор):
— Это полное словесное название химического элемента, которое используется в повседневной речи и научных текстах.
Таким образом, блок элемента в Периодической системе является своего рода «паспортом» элемента, предоставляя основную информацию, необходимую для понимания его строения и химических свойств.
Aᵣ(H) = 1
— Объяснение: Водород (H) является самым легким химическим элементом. Его наиболее распространенный изотоп, протий (¹H), состоит из одного протона и не имеет нейтронов. Его масса очень близка к одной атомной единице массы (а.е.м.), поэтому его относительная атомная масса округляется до 1. Точное значение в таблице обычно около 1.008.
Aᵣ(O) = 16
— Объяснение: Кислород (O) — это элемент с атомным номером 8. Его наиболее распространенный изотоп — кислород-16 (¹⁶O), который имеет 8 протонов и 8 нейтронов. Соответственно, его относительная атомная масса очень близка к 16 и округляется до этого значения. Точное значение в таблице обычно около 15.999.
Aᵣ(N) = 14
— Объяснение: Азот (N) — это элемент с атомным номером 7. Его основной изотоп — азот-14 (¹⁴N), который содержит 7 протонов и 7 нейтронов. Поэтому его относительная атомная масса округляется до 14. Точное значение в таблице обычно около 14.007.
Aᵣ(Fe) = 56
— Объяснение: Если относительная атомная масса равна 56, то это соответствует Железу (Fe). Железо имеет несколько стабильных изотопов, но наиболее распространенный из них — железо-56 (⁵⁶Fe). Средняя атомная масса железа в природе очень близка к 55.845, поэтому она округляется до 56.
Aᵣ(Cu) = 64
— Объяснение: Если относительная атомная масса равна 64, то это соответствует Меди (Cu). Медь имеет два основных стабильных изотопа: медь-63 (⁶³Cu) и медь-65 (⁶⁵Cu). Их природное соотношение таково, что средняя атомная масса меди составляет примерно 63.546. В некоторых учебных материалах или для упрощения расчетов это значение может быть округлено до 64.
Aᵣ(Cl) = 35,5
— Объяснение: Если относительная атомная масса равна 35,5, то это соответствует Хлору (Cl). Хлор является классическим примером элемента, чья относительная атомная масса не является целым числом из-за природного соотношения его изотопов. Хлор имеет два основных стабильных изотопа: хлор-35 (³⁵Cl) и хлор-37 (³⁷Cl). В природе приблизительно 75% атомов хлора составляют хлор-35, а около 25% — хлор-37. Средневзвешенная масса этих изотопов дает значение около 35.453, которое обычно округляется до 35,5.
Общий принцип:
Относительные атомные массы, указанные в периодической таблице, являются средневзвешенными значениями масс всех природных изотопов элемента, с учетом их распространенности. Именно поэтому многие значения не являются идеально целыми числами, хотя для простых расчетов их часто округляют.
Вопрос 3
Относительная молекулярная масса (Mᵣ) вещества показывает, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода С-12. Это безразмерная величина.
Mᵣ равна сумме относительных атомных масс (Aᵣ) всех элементов, входящих в состав молекулы, с учетом их индексов (количества атомов каждого элемента).
Давайте рассчитаем Mᵣ для каждого вещества:
1. Mᵣ(H₂O) — Относительная молекулярная масса воды.
— В молекуле H₂O содержится 2 атома Водорода (H) и 1 атом Кислорода (O).
— Aᵣ(H) = 1
— Aᵣ(O) = 16
— Расчет: (2 — Aᵣ(H)) + (1 — Aᵣ(O)) = (2 — 1) + (1 — 16) = 2 + 16 = 18
— Таким образом, Mᵣ(H₂O) = 18.
2. Mᵣ(H₂SO₄) — Относительная молекулярная масса серной кислоты.
— В молекуле H₂SO₄ содержится 2 атома Водорода (H), 1 атом Серы (S) и 4 атома Кислорода (O).
— Aᵣ(H) = 1
— Aᵣ(S) = 32 (стандартное округленное значение)
— Aᵣ(O) = 16
— Расчет: (2 — Aᵣ(H)) + (1 — Aᵣ(S)) + (4 — Aᵣ(O)) = (2 — 1) + (1 — 32) + (4 — 16) = 2 + 32 + 64 = 98
— Таким образом, Mᵣ(H₂SO₄) = 98.
3. Mᵣ(CO₂) — Относительная молекулярная масса углекислого газа.
— В молекуле CO₂ содержится 1 атом Углерода (C) и 2 атома Кислорода (O).
— Aᵣ(C) = 12 (стандартное округленное значение)
— Aᵣ(O) = 16
— Расчет: (1 — Aᵣ(C)) + (2 — Aᵣ(O)) = (1 — 12) + (2 — 16) = 12 + 32 = 44
— Таким образом, Mᵣ(CO₂) = 44.
4. Mᵣ[Ca₃(PO₄)₂] — Относительная молекулярная масса фосфата кальция.
— В формульной единице Ca₃(PO₄)₂ содержится 3 атома Кальция (Ca), а также две фосфатные группы (PO₄), каждая из которых содержит 1 атом Фосфора (P) и 4 атома Кислорода (O).
— Aᵣ(Ca) = 40 (стандартное округленное значение)
— Aᵣ(P) = 31 (стандартное округленное значение)
— Aᵣ(O) = 16
— Расчет:
- Масса атомов Кальция: 3 — Aᵣ(Ca) = 3 — 40 = 120
- Масса одной фосфатной группы (PO₄): Aᵣ(P) + (4 — Aᵣ(O)) = 31 + (4 — 16) = 31 + 64 = 95
- Поскольку таких групп две (индекс 2 за скобками): 2 — 95 = 190
- Общая сумма: 120 + 190 = 310
- Таким образом, Mᵣ[Ca₃(PO₄)₂] = 310.
В каждом случае относительная молекулярная масса получается путем сложения относительных атомных масс всех атомов, присутствующих в молекуле, с учетом их количества, указанного индексами в химической формуле.
Вопрос 4
Представленная таблица содержит информацию о двух различных веществах: кислороде (O₂) и фосфорной кислоте (H₃PO₄). Давайте подробно рассмотрим каждую строку и столбец.
Общая структура таблицы:
— Название вещества: Название химического соединения.
— Тип вещества: Классификация вещества как простого (состоящего из атомов одного элемента) или сложного (состоящего из атомов двух или более элементов).
— Качественный состав: Перечень химических элементов, из которых состоит вещество.
— Количественный состав: Указание числа атомов каждого элемента в одной молекуле (или формульной единице) вещества.
— Mᵣ вещества (относительная молекулярная масса): Безразмерная величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода-12. Рассчитывается как сумма относительных атомных масс всех атомов в молекуле.
— Массовая доля каждого элемента в составе вещества (ω): Доля массы каждого элемента в общей массе вещества, выраженная в долях единицы или в процентах.
Рассмотрим столбец для O₂ (Кислород):
— Название вещества: Кислород.
- Объяснение: Это общепринятое название химического элемента и простого вещества O₂.
— Тип вещества: Простое.
- Объяснение: Простое вещество состоит из атомов одного химического элемента. Молекула кислорода (O₂) состоит только из атомов кислорода.
— Качественный состав: Кислород.
- Объяснение: Качественный состав указывает, какие именно элементы входят в состав вещества. В данном случае это только кислород.
— Количественный состав: 2 атома кислорода.
- Объяснение: Количественный состав показывает количество атомов каждого элемента в молекуле. Индекс «2» в формуле O₂ означает, что молекула кислорода состоит из двух атомов кислорода.
— Mᵣ вещества: Mᵣ(O₂) = 16 · 2 = 32.
- Объяснение: Для расчета относительной молекулярной массы (Mᵣ) необходимо знать относительную атомную массу (Aᵣ) кислорода, которая равна 16 (Aᵣ(O) = 16). Поскольку в молекуле O₂ два атома кислорода, их суммарная относительная масса будет 16 — 2 = 32.
— Массовая доля каждого элемента в составе вещества: ω(O) = 100%.
- Объяснение: Массовая доля элемента в простом веществе всегда составляет 100%, так как вещество целиком состоит из атомов только этого элемента.
Рассмотрим столбец для H₃PO₄ (Фосфорная кислота):
— Название вещества: Фосфорная кислота.
- Объяснение: Это общепринятое название химического соединения с формулой H₃PO₄.
— Тип вещества: Сложное.
- Объяснение: Сложное вещество состоит из атомов двух или более различных химических элементов. Молекула фосфорной кислоты (H₃PO₄) состоит из атомов водорода, фосфора и кислорода.
— Качественный состав: Водород, фосфор, кислород.
- Объяснение: Молекула H₃PO₄ содержит атомы трех разных элементов: H (водород), P (фосфор) и O (кислород).
— Количественный состав: 3 атома водорода, 1 атом фосфора, 4 атома кислорода.
- Объяснение: Индексы в формуле H₃PO₄ указывают на количество атомов каждого элемента: «3» для водорода, «1» (подразумевается, если индекс не указан) для фосфора и «4» для кислорода.
— Mᵣ вещества: Mᵣ(H₃PO₄) = 1 · 3 + 31 + 16 · 4 = 98.
- Объяснение: Для расчета Mᵣ(H₃PO₄) используем относительные атомные массы:
Aᵣ(H) = 1
Aᵣ(P) = 31
Aᵣ(O) = 16
Суммируем массы всех атомов: (3 атома H · Aᵣ(H)) + (1 атом P · Aᵣ(P)) + (4 атома O · Aᵣ(O)) = (3 · 1) + (1 · 31) + (4 · 16) = 3 + 31 + 64 = 98.
— Массовая доля каждого элемента в составе вещества:
- Объяснение: Массовая доля элемента (ω) рассчитывается по формуле:
ω(Элемент) = (количество атомов элемента · Aᵣ(Элемент)) / Mᵣ(Вещества) - ω(H) = 3Aᵣ(H) / Mᵣ(H₃PO₄) = 3 / 98 ≈ 0,031 = 3,1%.
Объяснение: Общая относительная масса водорода в молекуле H₃PO₄ составляет 3 · 1 = 3. Делим это на общую молекулярную массу 98: 3 / 98 ≈ 0,0306. Округляем до 0,031 и переводим в проценты: 3,1%. - ω(P) = Aᵣ(P) / Mᵣ(H₃PO₄) = 31 / 98 ≈ 0,316 = 31,6%.
Объяснение: Общая относительная масса фосфора в молекуле H₃PO₄ составляет 1 · 31 = 31. Делим это на 98: 31 / 98 ≈ 0,3163. Округляем до 0,316 и переводим в проценты: 31,6%. - ω(O) = 4Aᵣ(O) / Mᵣ(H₃PO₄) = 64 / 98 ≈ 0,653 = 65,3%.
Объяснение: Общая относительная масса кислорода в молекуле H₃PO₄ составляет 4 · 16 = 64. Делим это на 98: 64 / 98 ≈ 0,6530. Округляем до 0,653 и переводим в проценты: 65,3%.
Проверка: Сумма массовых долей должна быть близка к 100% (неточность может быть из-за округления): 3,1% + 31,6% + 65,3% = 100%. Это подтверждает правильность расчетов.
Часть II
Вопрос 1
Для установления соответствия между химической формулой вещества и составом его молекулы, необходимо внимательно рассмотреть индексы после каждого химического символа в формуле. Индекс указывает на количество атомов данного элемента в одной молекуле. Если индекс отсутствует, это означает, что в молекуле присутствует один атом данного элемента.
Рассмотрим каждое вещество по отдельности:
А) CH₄ (Метан)
— Химические элементы: C (углерод), H (водород).
— Количество атомов:
- Индекс после C отсутствует, значит, 1 атом углерода.
- Индекс после H равен 4, значит, 4 атома водорода.
— Состав молекулы: Один атом углерода и четыре атома водорода.
— Соответствие: Это описание точно совпадает с пунктом 4) один атом углерода и четыре атома водорода.
Б) N₂O₅ (Пентаоксид диазота)
— Химические элементы: N (азот), O (кислород).
— Количество атомов:
- Индекс после N равен 2, значит, 2 атома азота.
- Индекс после O равен 5, значит, 5 атомов кислорода.
— Состав молекулы: Два атома азота и пять атомов кислорода.
— Соответствие: Это описание точно совпадает с пунктом 6) два атома азота и пять атомов кислорода.
В) PCl₅ (Пентахлорид фосфора)
— Химические элементы: P (фосфор), Cl (хлор).
— Количество атомов:
- Индекс после P отсутствует, значит, 1 атом фосфора.
- Индекс после Cl равен 5, значит, 5 атомов хлора.
— Состав молекулы: Один атом фосфора и пять атомов хлора.
— Соответствие: Это описание точно совпадает с пунктом 2) один атом фосфора и пять атомов хлора.
Г) SiCl₄ (Тетрахлорид кремния)
— Химические элементы: Si (кремний), Cl (хлор).
— Количество атомов:
- Индекс после Si отсутствует, значит, 1 атом кремния.
- Индекс после Cl равен 4, значит, 4 атома хлора.
— Состав молекулы: Один атом кремния и четыре атома хлора.
— Соответствие: Это описание точно совпадает с пунктом 5) один атом кремния и четыре атома хлора.
Таким образом, окончательное соответствие:
А) CH₄ → 4
Б) N₂O₅ → 6
В) PCl₅ → 2
Г) SiCl₄ → 5
Вопрос 2
Для разделения веществ на простые и сложные необходимо понимать их определения:
- Простые вещества – это вещества, молекулы которых состоят из атомов одного химического элемента. Они не могут быть разложены на более простые вещества химическими методами.
- Сложные вещества (химические соединения) – это вещества, молекулы которых состоят из атомов двух или более различных химических элементов, химически связанных между собой. Они могут быть разложены на простые вещества или другие сложные вещества.
Рассмотрим каждое вещество по отдельности:
1. N₂ (Азот)
— Состоит только из атомов элемента Азот (N).
— Следовательно, это простое вещество.
2. NO (Оксид азота(II))
— Состоит из атомов элементов Азот (N) и Кислород (O). Это два разных химических элемента.
— Следовательно, это сложное вещество.
3. O₃ (Озон)
— Состоит только из атомов элемента Кислород (O).
— Следовательно, это простое вещество.
4. AlCl₃ (Хлорид алюминия)
— Состоит из атомов элементов Алюминий (Al) и Хлор (Cl). Это два разных химических элемента.
— Следовательно, это сложное вещество.
5. Na₂SO₄ (Сульфат натрия)
— Состоит из атомов элементов Натрий (Na), Сера (S) и Кислород (O). Это три разных химических элемента.
— Следовательно, это сложное вещество.
6. FeCl₂ (Хлорид железа(II))
— Состоит из атомов элементов Железо (Fe) и Хлор (Cl). Это два разных химических элемента.
— Следовательно, это сложное вещество.
7. Ca (Кальций)
— Состоит только из атомов элемента Кальций (Ca).
— Следовательно, это простое вещество.
8. Cl₂ (Хлор)
— Состоит только из атомов элемента Хлор (Cl).
— Следовательно, это простое вещество.
9. KMnO₄ (Перманганат калия)
— Состоит из атомов элементов Калий (K), Марганец (Mn) и Кислород (O). Это три разных химических элемента.
— Следовательно, это сложное вещество.
10. P₄ (Белый фосфор)
— Состоит только из атомов элемента Фосфор (P).
— Следовательно, это простое вещество.
Вопрос 3
Для исправления неверно вычисленных значений относительных молекулярных масс необходимо пересчитать каждое значение, используя относительные атомные массы элементов из Периодической системы. Обычно для таких расчетов используются округленные значения атомных масс.
Используем следующие округленные значения относительных атомных масс:
— Aᵣ(H) ≈ 1
— Aᵣ(C) ≈ 12
— Aᵣ(O) ≈ 16
— Aᵣ(Ca) ≈ 40
— Aᵣ(Al) ≈ 27
— Aᵣ(Cl) ≈ 35.5
— Aᵣ(N) ≈ 14
— Aᵣ(S) ≈ 32
Рассмотрим каждое вычисление по порядку:
1. Mᵣ(CH₃COOH) = 60
— Формула CH₃COOH содержит: 2 атома углерода (C), 4 атома водорода (H) и 2 атома кислорода (O).
— Расчет: (2 × Aᵣ(C)) + (4 × Aᵣ(H)) + (2 × Aᵣ(O)) = (2 × 12) + (4 × 1) + (2 × 16) = 24 + 4 + 32 = 60.
— Вывод: Значение 60 вычислено верно.
2. Mᵣ(CaCO₃) = 100
— Формула CaCO₃ содержит: 1 атом кальция (Ca), 1 атом углерода (C) и 3 атома кислорода (O).
— Расчет: Aᵣ(Ca) + Aᵣ(C) + (3 × Aᵣ(O)) = 40 + 12 + (3 × 16) = 40 + 12 + 48 = 100.
— Вывод: Значение 100 вычислено верно.
3. Mᵣ(AlCl₃) = 132
— Формула AlCl₃ содержит: 1 атом алюминия (Al) и 3 атома хлора (Cl).
— Расчет: Aᵣ(Al) + (3 × Aᵣ(Cl)) = 27 + (3 × 35.5) = 27 + 106.5 = 133.5.
— Вывод: Значение 132 вычислено неверно. Правильное значение Mᵣ(AlCl₃) = 133.5.
4. Mᵣ(HNO₃) = 63
— Формула HNO₃ содержит: 1 атом водорода (H), 1 атом азота (N) и 3 атома кислорода (O).
— Расчет: Aᵣ(H) + Aᵣ(N) + (3 × Aᵣ(O)) = 1 + 14 + (3 × 16) = 1 + 14 + 48 = 63.
— Вывод: Значение 63 вычислено верно.
5. Mᵣ(Ca(OH)₂) = 74
— Формула Ca(OH)₂ содержит: 1 атом кальция (Ca), 2 атома кислорода (O) и 2 атома водорода (H).
— Расчет: Aᵣ(Ca) + (2 × (Aᵣ(O) + Aᵣ(H))) = 40 + (2 × (16 + 1)) = 40 + (2 × 17) = 40 + 34 = 74.
— Вывод: Значение 74 вычислено верно.
6. Mᵣ(Al₂(SO₄)₃) = 315
— Формула Al₂(SO₄)₃ содержит: 2 атома алюминия (Al), 3 атома серы (S) и (3 × 4) = 12 атомов кислорода (O).
— Расчет: (2 × Aᵣ(Al)) + (3 × (Aᵣ(S) + (4 × Aᵣ(O)))) = (2 × 27) + (3 × (32 + (4 × 16))) = 54 + (3 × (32 + 64)) = 54 + (3 × 96) = 54 + 288 = 342.
— Вывод: Значение 315 вычислено неверно. Правильное значение Mᵣ(Al₂(SO₄)₃) = 342.
Таким образом, неверно вычисленные значения относительных молекулярных масс были для формул под номерами 3 и 6.
Ответ: 3, 6.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!