
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 201-202 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
1. ОВР — это реакции, в результате которых
________________________________________________________
________________________________________________________
2. Восстановитель — это элемент или вещество, __________________________ __________________________ электроны. Само оно при этом __________________________
Окислитель — это элемент или вещество, __________________________
__________________________ электроны. Само оно при этом __________________________
3. Некоторые активные окислители:
4) Сера в серной кислоте:
4. Некоторые активные восстановители:
3) Азот в аммиаке:
4) Сера в сероводороде:
Часть II
1. Самым сильным восстановителем среди элементов IV A группы является:
1) германий
2) углерод
3) кремний
4) свинец
Ответ. Обоснуйте свой выбор.
2. Наиболее слабым окислителем среди элементов V A группы является:
1) мышьяк
2) сурьма
3) азот
4) фосфор
Ответ. Обоснуйте свой выбор.
§41
Часть I
Вопрос 1
Окислительно-восстановительные реакции — это процессы, в ходе которых изменяются степени окисления атомов химических элементов или ионов, входящих в состав взаимодействующих веществ.
Вопрос 2
Восстановитель — это элемент или вещество, отдающее электроны. Само оно при этом окисляется.
Окислитель — это элемент или вещество, принимающее электроны. Само оно при этом восстанавливается.
Вопрос 3
Вопрос 4
Часть II
Вопрос 1
Наиболее мощным восстановителем считается свинец, что связано с его большим атомным радиусом (радиус увеличивается сверху вниз в группе). Благодаря этому электроны находятся на значительном расстоянии от ядра, что облегчает их отдачу и усиливает восстановительные свойства элемента.
Ответ. 4.
Вопрос 2
Сурьма считается самым слабым окислителем, поскольку окислительные свойства элементов снижаются при движении сверху вниз по группе.
Ответ. 2.
Часть I
Вопрос 1
Окислительно-восстановительные реакции представляют собой химические процессы, при которых происходит изменение степеней окисления атомов. В них участвуют элементы или ионы, входящие в состав реагирующих веществ. В ходе таких реакций одни частицы отдают электроны (проявляя свойства восстановителей), а другие их принимают (выступая в роли окислителей). Эти процессы лежат в основе множества природных и технологических явлений, таких как горение, коррозия металлов, дыхание и фотосинтез.
Вопрос 2
Эти два понятия являются центральными в ОВР и всегда идут рука об руку.
Восстановитель:
Это химический элемент или вещество, которое отдает (теряет) электроны в ходе химической реакции. Когда восстановитель отдает электроны, его собственная степень окисления повышается.
Процесс отдачи электронов называется окислением. Таким образом, восстановитель сам окисляется.
Мнемоническое правило: «Восстановитель — это тот, кто восстанавливает других, а сам окисляется».
Пример: В реакции Zn⁰ + 2H⁺¹Cl⁻¹ → Zn⁺²Cl₂⁻¹ + H₂⁰, цинк (Zn⁰) является восстановителем, так как он отдает электроны и окисляется до Zn⁺².
Окислитель:
Это химический элемент или вещество, которое принимает (присоединяет) электроны в ходе химической реакции. Когда окислитель принимает электроны, его собственная степень окисления понижается.
Процесс принятия электронов называется восстановлением. Таким образом, окислитель сам восстанавливается.
Мнемоническое правило: «Окислитель — это тот, кто окисляет других, а сам восстанавливается».
Пример: В реакции Zn⁰ + 2H⁺¹Cl⁻¹ → Zn⁺²Cl₂⁻¹ + H₂⁰, ионы водорода (H⁺¹) являются окислителем, так как они принимают электроны и восстанавливаются до H₂⁰.
Схема «Окислитель ⇌ Восстановитель»:
Эта схема прекрасно иллюстрирует взаимосвязь:
- Восстановитель — это элемент или вещество, отдающее электроны. Само оно при этом окисляется.
- Окислитель — это элемент или вещество, принимающее электроны. Само оно при этом восстанавливается.
Это всегда парный процесс: не может быть окисления без восстановления и наоборот.
Вопрос 3
Активные окислители — это вещества, которые очень легко принимают электроны.
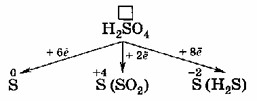
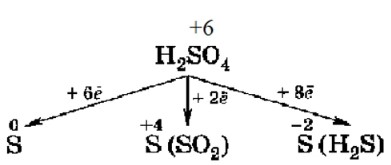
4. Сера в серной кислоте (H₂SO₄):
Сера (S) в H₂SO₄ также находится в своей высшей степени окисления (+6). Подобно азоту в HNO₃, сера в H₂SO₄ может только принимать электроны, выступая в роли окислителя. Концентрированная серная кислота является сильным окислителем, особенно при нагревании. Продукты ее восстановления также зависят от концентрации и силы восстановителя:
- S(+6) → S(+4) (в SO₂): +2e⁻ (типично для концентрированной H₂SO₄ с менее активными металлами)
- S(+6) → S(0) (элементарная сера): +6e⁻ (с более активными металлами или сильными восстановителями)
- S(+6) → S(-2) (в H₂S): +8e⁻ (с очень активными металлами или очень сильными восстановителями)
Вопрос 4
Активные восстановители — это вещества, которые очень легко отдают электроны.
3. Азот в аммиаке (NH₃):
Азот (N) в аммиаке (NH₃) находится в своей низшей степени окисления (-3). Это означает, что он уже «принял» максимально возможное количество электронов. Следовательно, он не может принять больше электронов, а может только отдавать их, то есть быть восстановителем.
Аммиак может быть окислен до различных степеней окисления азота, например:
- N(-3) → N(+2) (в NO): -5e⁻ (например, при каталитическом окислении аммиака)
- N(-3) → N(0) (в N₂): -3e⁻ (например, при горении аммиака на воздухе или реакции с сильными окислителями)
4. Сера в сероводороде (H₂S):
Сера (S) в сероводороде (H₂S) находится в своей низшей степени окисления (-2). Подобно азоту в аммиаке, сера в H₂S может только отдавать электроны, выступая в роли восстановителя.
Сероводород является сильным восстановителем. Продукты его окисления зависят от силы окислителя и условий:
- S(-2) → S(+4) (в SO₂): -6e⁻ (например, при полном сгорании H₂S в избытке кислорода)
- S(-2) → S(0) (элементарная сера): -2e⁻ (например, при неполном сгорании H₂S или реакции с мягкими окислителями)
Часть II
Вопрос 1
Элементы IVA группы (углерод, кремний, германий, олово, свинец) расположены в Периодической системе следующим образом:
C
Si
Ge
Sn
Pb
Тенденции восстановительных свойств в группах:
Восстановительные свойства (способность отдавать электроны) усиливаются при движении сверху вниз по главной подгруппе Периодической системы.
Почему?
1. Увеличение атомного радиуса: При движении сверху вниз по группе, каждый новый элемент имеет на один энергетический уровень больше, чем предыдущий. Это приводит к значительному увеличению размера атома (атомного радиуса).
2. Экранирование (экранирующий эффект): Внутренние электронные слои «экранируют» (защищают) внешние валентные электроны от притяжения положительно заряженного ядра. Чем больше внутренних слоев, тем сильнее эффект экранирования.
3. Уменьшение эффективного ядерного заряда: Хотя заряд ядра (количество протонов) увеличивается вниз по группе, увеличение экранирования приводит к тому, что валентные электроны испытывают меньшее эффективное притяжение со стороны ядра. Они находятся дальше от ядра и слабее им притягиваются.
4. Уменьшение энергии ионизации: Поскольку валентные электроны слабее связаны с ядром, требуется меньше энергии для их удаления. Энергия ионизации (энергия, необходимая для отрыва электрона) уменьшается сверху вниз по группе.
Вывод: Чем легче атом отдает электроны (чем ниже энергия ионизации), тем сильнее он проявляет восстановительные свойства.
Свинец (Pb) находится в самом низу списка предложенных элементов IVA группы. Следовательно, он будет иметь самый большой атомный радиус, наименьшую энергию ионизации и, как следствие, будет самым сильным восстановителем среди них.
Ответ: 4) свинец
Вопрос 2
Элементы VA группы (азот, фосфор, мышьяк, сурьма, висмут) расположены в Периодической системе следующим образом:
N
P
As
Sb
Bi
Тенденции окислительных свойств в группах:
Окислительные свойства (способность принимать электроны) ослабевают при движении сверху вниз по главной подгруппе Периодической системы.
Почему?
1. Увеличение атомного радиуса и экранирования: Как уже объяснялось, размер атома увеличивается, и внутренние электроны сильнее экранируют ядро.
2. Уменьшение электроотрицательности: Электроотрицательность (способность атома притягивать электроны в химической связи) уменьшается сверху вниз по группе. Это означает, что атомы внизу группы менее склонны притягивать электроны.
3. Уменьшение сродства к электрону: Сродство к электрону (энергия, выделяющаяся при присоединении электрона к атому) также, как правило, уменьшается сверху вниз по группе (хотя есть некоторые исключения, например, у азота и фосфора). Это указывает на то, что атомам внизу группы менее выгодно принимать дополнительные электроны.
Вывод: Чем менее охотно атом принимает электроны (чем ниже электроотрицательность и сродство к электрону), тем слабее он проявляет окислительные свойства.
Сурьма (Sb) находится ниже всех остальных предложенных элементов VA группы (азот, фосфор, мышьяк). Следовательно, она будет иметь наименьшую склонность к приему электронов и будет самым слабым окислителем среди них.
Ответ: 2) сурьма

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.


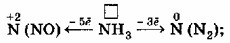
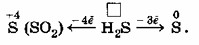
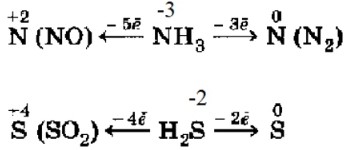



Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!