
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 204-205 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
7. Окислительно-восстановительная реакция возможна между:
1) CaO и H₂O
2) CuO и HNO₃
3) CaCO₃ и HCl
4) CuO и C
Ответ.
Запишите уравнение ОВР и составьте электронный баланс.
8. Сера проявляет восстановительные свойства в реакции, схема которой:
1) H₂S + KOH → K₂S + H₂O
2) Na₂S + Pb(NO₃)₂ → PbS + NaNO₃
3) H₂S + O₂ → SO₂ + H₂O
4) Na₂S + HCl → H₂S + NaCl
Запишите уравнение искомой ОВР и составьте электронный баланс.
9. Рассмотрите взаимодействие алюминия с соляной кислотой:
— в свете теории электролитической диссоциации
молекулярное уравнение
полное ионное уравнение
сокращённое ионное уравнение
— в свете процессов окисления-восстановления
10. Верны ли следующие суждения?
А. Сероводород проявляет только восстановительные свойства.
Б. Серная кислота проявляет как окислительные, так и восстановительные свойства.
1) оба суждения верны
2) верно только А
3) верно только Б
4) оба суждения неверны
Ответ.
Обоснуйте свой ответ.
Вопрос 7
Cu⁺²O⁻² + C⁰ → C⁺²O⁻² + Cu⁰
Ответ. 4.
Вопрос 8
1) H₂S⁻² + KOH → K₂S⁻² + H₂O
2) Na₂S⁻² + Pb(NO₃)₂ → PbS⁻² + NaNO₃
3) H₂S⁻² + O₂ → SO₂⁺⁴ + H₂O
4) Na₂S⁻² + HCl → H₂S⁻² + NaCl
ОВР:
H⁺₂S⁻² + O⁰₂ → S⁺⁴O⁻²₂ + H⁺₂O⁻²
| O⁰₂ + 4e → 2O⁻² | 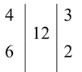 | окислитель, восстановление |
| S⁻² — 6e → S⁺⁴ | восстановитель, окисление |
2H⁺₂S⁻² + 3O⁰₂ = 2S⁺⁴O⁻²₂ + 2H⁺₂O⁻²
Вопрос 9
Теория электролитической диссоциации:
2Al + 6HCl → 2AlCl₃ + 3H₂
2Al + 6H⁺ + 6Cl⁻ → 2Al³⁺ + 6Cl⁻ + 3H₂
2Al + 6H⁺ → 2Al³⁺ + 3H₂
ОВР:
Al⁰ + H⁺Cl⁻ → Al⁺³Cl⁻₃ + H₂⁰
2Al + 6HCl = 2AlCl₃ + 3H₂
Вопрос 10
А. Сероводород проявляет только восстановительные свойства.
Верно. Сера в составе сероводорода обладает минимальной степенью окисления (-2), что делает её способной выступать исключительно в роли восстановителя в окислительно-восстановительных реакциях.
Б. Серная кислота проявляет как окислительные, так и восстановительные свойства.
Неверно. В молекуле серной кислоты сера имеет высшую степень окисления (+6), благодаря чему она способна проявлять исключительно окислительные свойства.
Верно только А.
Ответ. 2.
Вопрос 7
Окислительно-восстановительная реакция (ОВР) – это химическая реакция, в которой происходит изменение степеней окисления атомов элементов. Это означает, что один элемент теряет электроны (окисляется, является восстановителем), а другой принимает электроны (восстанавливается, является окислителем).
Для определения, является ли реакция ОВР, необходимо определить степени окисления всех элементов в исходных веществах и продуктах реакции.
1) CaO и H₂O:
CaO (оксид кальция): Кальций (Ca) – элемент II группы, всегда имеет степень окисления +2. Кислород (O) в оксидах обычно имеет степень окисления -2. Значит, Ca⁺²O⁻².
H₂O (вода): Водород (H) имеет степень окисления +1. Кислород (O) имеет степень окисления -2. Значит, H⁺₂O⁻².
Реакция: CaO + H₂O → Ca(OH)₂ (гидроксид кальция)
Продукты: В Ca(OH)₂: Ca⁺², O⁻², H⁺.
Изменение степеней окисления:
- Ca: +2 → +2 (не изменилось)
- O: -2 → -2 (не изменилось)
- H: +1 → +1 (не изменилось)
Вывод: Степени окисления ни одного элемента не изменились. Это реакция соединения, но не ОВР.
2) CuO и HNO₃:
CuO (оксид меди(II)): Медь (Cu) +2, Кислород (O) -2. Значит, Cu⁺²O⁻².
HNO₃ (азотная кислота): Водород (H) +1, Кислород (O) -2. Для азота (N) рассчитываем: 1*(+1) + N + 3*(-2) = 0 => N = +5. Значит, H⁺N⁺⁵O⁻²₃.
Реакция: CuO + 2HNO₃ → Cu(NO₃)₂ + H₂O (нитрат меди(II) и вода)
Продукты: В Cu(NO₃)₂: Cu⁺², N⁺⁵, O⁻². В H₂O: H⁺, O⁻².
Изменение степеней окисления:
- Cu: +2 → +2 (не изменилось)
- O: -2 → -2 (не изменилось)
- H: +1 → +1 (не изменилось)
- N: +5 → +5 (не изменилось)
Вывод: Степени окисления ни одного элемента не изменились. Это реакция обмена, но не ОВР.
3) CaCO₃ и HCl:
CaCO₃ (карбонат кальция): Кальций (Ca) +2, Кислород (O) -2. Для углерода (C) рассчитываем: 1*(+2) + C + 3*(-2) = 0 => C = +4. Значит, Ca⁺²C⁺⁴O⁻²₃.
HCl (соляная кислота): Водород (H) +1, Хлор (Cl) -1. Значит, H⁺Cl⁻.
Реакция: CaCO₃ + 2HCl → CaCl₂ + H₂O + CO₂ (хлорид кальция, вода, углекислый газ)
Продукты: В CaCl₂: Ca⁺², Cl⁻. В H₂O: H⁺, O⁻². В CO₂: C⁺⁴, O⁻².
Изменение степеней окисления:
- Ca: +2 → +2 (не изменилось)
- C: +4 → +4 (не изменилось)
- O: -2 → -2 (не изменилось)
- H: +1 → +1 (не изменилось)
- Cl: -1 → -1 (не изменилось)
Вывод: Степени окисления ни одного элемента не изменились. Это реакция обмена, но не ОВР.
4) CuO и C:
CuO (оксид меди(II)): Медь (Cu) +2, Кислород (O) -2. Значит, Cu⁺²O⁻².
C (углерод): Простое вещество, степень окисления 0. Значит, C⁰.
Реакция: CuO + C → Cu + CO (медь и монооксид углерода)
Продукты: В Cu: Простое вещество, степень окисления 0. Значит, Cu⁰. В CO: Кислород (O) -2. Для углерода (C) рассчитываем: C + (-2) = 0 => C = +2. Значит, C⁺²O⁻².
Изменение степеней окисления:
- Cu: +2 → 0 (понизилась) – медь восстановилась. CuO является окислителем.
- C: 0 → +2 (повысилась) – углерод окислился. C является восстановителем.
Вывод: Степени окисления меди и углерода изменились. Это окислительно-восстановительная реакция.
Запишите уравнение ОВР и составьте электронный баланс:
Уравнение реакции: CuO + C → Cu + CO
Электронный баланс:
1. Определяем элементы, изменившие степень окисления, и записываем полуреакции:
- Медь: Cu⁺² + 2e⁻ → Cu⁰ (Медь принимает электроны, её степень окисления понижается – это процесс восстановления. CuO – окислитель.)
- Углерод: C⁰ — 2e⁻ → C⁺² (Углерод отдаёт электроны, его степень окисления повышается – это процесс окисления. C – восстановитель.)
2. Находим наименьшее общее кратное (НОК) для числа отданных и принятых электронов:
НОК для 2 и 2 равно 2.
3. Делим НОК на число электронов в каждой полуреакции, чтобы получить стехиометрические коэффициенты:
Для Cu: 2 / 2 = 1
Для C: 2 / 2 = 1
4. Подставляем полученные коэффициенты в уравнение реакции:
1CuO + 1C → 1Cu + 1CO
Или просто: CuO + C = Cu + CO
Ответ: 4) Окислительно-восстановительная реакция возможна между CuO и C.
Вопрос 8
Восстановительные свойства проявляет элемент, который отдаёт электроны и при этом повышает свою степень окисления. Для того чтобы сера могла проявить восстановительные свойства, она должна находиться в низкой или промежуточной степени окисления, чтобы у неё была возможность повысить её. Минимальная степень окисления серы -2.
Рассмотрим степени окисления серы в каждом случае:
1) H₂S + KOH → K₂S + H₂O
В H₂S (сероводород) сера имеет степень окисления -2 (H⁺₂S⁻²).
В K₂S (сульфид калия) сера также имеет степень окисления -2 (K⁺₂S⁻²).
Вывод: Степень окисления серы не изменилась (-2 → -2). Сера не проявила восстановительных свойств. Это реакция нейтрализации (кислота + основание).
2) Na₂S + Pb(NO₃)₂ → PbS + NaNO₃
В Na₂S (сульфид натрия) сера имеет степень окисления -2 (Na⁺₂S⁻²).
В PbS (сульфид свинца) сера также имеет степень окисления -2 (Pb⁺²S⁻²).
Вывод: Степень окисления серы не изменилась (-2 → -2). Сера не проявила восстановительных свойств. Это реакция обмена.
3) H₂S + O₂ → SO₂ + H₂O
В H₂S (сероводород) сера имеет степень окисления -2 (H⁺₂S⁻²).
В O₂ (кислород) кислород как простое вещество имеет степень окисления 0 (O⁰₂).
В SO₂ (сернистый газ) кислород -2. Для серы: S + 2*(-2) = 0 => S = +4. Значит, S⁺⁴O⁻²₂.
В H₂O (вода) водород +1, кислород -2.
Изменение степеней окисления:
- Сера: S⁻² → S⁺⁴ (степень окисления повысилась с -2 до +4). Это означает, что сера отдала электроны и проявила восстановительные свойства.
- Кислород: O⁰ → O⁻² (степень окисления понизилась с 0 до -2). Это означает, что кислород принял электроны и проявил окислительные свойства.
Вывод: Сера проявила восстановительные свойства.
4) Na₂S + HCl → H₂S + NaCl
В Na₂S (сульфид натрия) сера имеет степень окисления -2 (Na⁺₂S⁻²).
В HCl (соляная кислота) хлор -1.
В H₂S (сероводород) сера также имеет степень окисления -2 (H⁺₂S⁻²).
В NaCl (хлорид натрия) хлор -1.
Вывод: Степень окисления серы не изменилась (-2 → -2). Сера не проявила восстановительных свойств. Это реакция обмена (вытеснение слабой кислоты из её соли более сильной кислотой).
Запишите уравнение искомой ОВР и составьте электронный баланс:
Уравнение реакции: H₂S + O₂ → SO₂ + H₂O
Электронный баланс:
1. Определяем элементы, изменившие степень окисления, и записываем полуреакции:
- Сера: S⁻² — 6e⁻ → S⁺⁴ (Сера отдаёт 6 электронов – окисление, H₂S – восстановитель.)
- Кислород: O⁰₂ + 4e⁻ → 2O⁻² (Кислород принимает 4 электрона на молекулу O₂ – восстановление, O₂ – окислитель.) Важно: если в исходном веществе элемент находится в виде двухатомной молекулы (O₂, Cl₂, N₂ и т.д.), то при записи полуреакции необходимо учитывать это, чтобы правильно сбалансировать атомы.
2. Находим наименьшее общее кратное (НОК) для числа отданных и принятых электронов:
НОК для 6 и 4 равно 12.
3. Делим НОК на число электронов в каждой полуреакции, чтобы получить стехиометрические коэффициенты:
Для S: 12 / 6 = 2
Для O: 12 / 4 = 3
4. Подставляем полученные коэффициенты в уравнение реакции и уравниваем остальные атомы:
Коэффициент 2 для H₂S (из-за S) и 2 для SO₂ (из-за S).
Коэффициент 3 для O₂ (из-за O).
Предварительное уравнение: 2H₂S + 3O₂ → 2SO₂ + ?H₂O
Считаем атомы водорода (H) слева: 2 * 2 = 4 атома H.
Чтобы уравнять водород справа, ставим коэффициент 2 перед H₂O: 2H₂S + 3O₂ → 2SO₂ + 2H₂O
Проверяем кислород (O) справа: 2 * 2 (в SO₂) + 2 * 1 (в H₂O) = 4 + 2 = 6 атомов O.
Кислород слева: 3 * 2 (в O₂) = 6 атомов O.
Уравнение сбалансировано.
Ответ: Сера проявляет восстановительные свойства в реакции: 2H₂S + 3O₂ → 2SO₂ + 2H₂O.
Вопрос 9
Теория электролитической диссоциации описывает поведение веществ (электролитов) в растворах, где они распадаются на ионы.
Молекулярное уравнение:
Это стандартное уравнение реакции, показывающее формулы реагентов и продуктов без учета их ионного состояния.
2Al + 6HCl → 2AlCl₃ + 3H₂
Полное ионное уравнение:
В этом уравнении сильные электролиты (растворимые соли, сильные кислоты, сильные основания) записываются в виде ионов, а неэлектролиты, слабые электролиты, газы, осадки и простые вещества – в молекулярной форме.
- Al (алюминий): Простое вещество, не диссоциирует.
- HCl (соляная кислота): Сильная кислота, полностью диссоциирует на ионы H⁺ и Cl⁻. Так как у нас 6 молекул HCl, то будет 6H⁺ и 6Cl⁻.
- AlCl₃ (хлорид алюминия): Растворимая соль, сильный электролит, диссоциирует на ионы Al³⁺ и Cl⁻. Так как у нас 2 молекулы AlCl₃, то будет 2Al³⁺ и 6Cl⁻ (2 * 3 = 6).
- H₂ (водород): Газ, простое вещество, не диссоциирует.
Итак, полное ионное уравнение:
2Al + 6H⁺ + 6Cl⁻ → 2Al³⁺ + 6Cl⁻ + 3H₂
Сокращённое ионное уравнение:
Получается из полного ионного уравнения путем исключения «ионов-зрителей» – тех ионов, которые присутствуют как в левой, так и в правой части уравнения и не участвуют непосредственно в химической реакции. В данном случае ионом-зрителем является Cl⁻.
Убираем 6Cl⁻ с обеих сторон:
2Al + 6H⁺ → 2Al³⁺ + 3H₂
В свете процессов окисления-восстановления (ОВР):
Рассмотрим изменения степеней окисления и электронный баланс.
1. Определяем степени окисления всех элементов:
Al⁰ (алюминий) – простое вещество, степень окисления 0.
H⁺Cl⁻ (соляная кислота) – водород +1, хлор -1.
Al⁺³Cl⁻₃ (хлорид алюминия) – алюминий +3, хлор -1.
H₂⁰ (водород) – простое вещество, степень окисления 0.
2. Определяем, какие элементы изменили степень окисления:
Алюминий: Al⁰ → Al⁺³ (степень окисления повысилась).
Водород: H⁺ → H₂⁰ (степень окисления понизилась).
3. Записываем полуреакции окисления и восстановления:
Окисление (отдача электронов): Al⁰ — 3e⁻ → Al⁺³
Алюминий является восстановителем.
Восстановление (приём электронов): 2H⁺ + 2e⁻ → H₂⁰
Ионы водорода (H⁺) являются окислителем. (Важно: H⁺ превращается в молекулу H₂, поэтому нужно 2H⁺ и 2 электрона).
4. Составляем электронный баланс:
Для Al: 3 электрона
Для H: 2 электрона
Наименьшее общее кратное (НОК) для 3 и 2 равно 6.
Делим НОК на число электронов в каждой полуреакции, чтобы получить коэффициенты:
Для Al: 6 / 3 = 2
Для H: 6 / 2 = 3
5. Подставляем коэффициенты в молекулярное уравнение и уравниваем:
Коэффициент 2 перед Al и AlCl₃.
Коэффициент 3 перед H₂.
У нас 3 * 2 = 6 атомов водорода справа (в H₂), значит, нужно 6 атомов водорода слева, поэтому ставим 6 перед HCl.
Проверяем хлор: 6 атомов хлора слева (в HCl) и 2 * 3 = 6 атомов хлора справа (в AlCl₃).
Уравнение сбалансировано:
2Al + 6HCl = 2AlCl₃ + 3H₂
Вопрос 10
Для ответа на этот вопрос нужно понимать, как степень окисления элемента влияет на его окислительно-восстановительные свойства.
Минимальная степень окисления: Элемент может только повышать свою степень окисления, то есть только отдавать электроны. Следовательно, он проявляет только восстановительные свойства.
Максимальная степень окисления: Элемент может только понижать свою степень окисления, то есть только принимать электроны. Следовательно, он проявляет только окислительные свойства.
Промежуточная степень окисления: Элемент может как повышать, так и понижать свою степень окисления, то есть как отдавать, так и принимать электроны. Следовательно, он может проявлять как окислительные, так и восстановительные свойства.
А. Сероводород проявляет только восстановительные свойства.
В молекуле сероводорода (H₂S) сера находится в степени окисления -2. (H⁺₂S⁻²).
Степень окисления -2 является минимальной возможной степенью окисления для серы.
Поскольку сера уже находится в минимальной степени окисления, она не может её понизить (принять электроны). Она может только повысить свою степень окисления (отдать электроны).
Когда элемент отдаёт электроны, он является восстановителем.
Вывод: Утверждение А верно. Сера в H₂S может окисляться до S⁰, S⁺⁴ (SO₂), S⁺⁶ (H₂SO₄). Например, H₂S + O₂ → SO₂ + H₂O (как в вопросе 8), где S⁻² → S⁺⁴.
Б. Серная кислота проявляет как окислительные, так и восстановительные свойства.
В молекуле серной кислоты (H₂SO₄) сера находится в степени окисления +6. (H⁺₂S⁺⁶O⁻²₄).
Степень окисления +6 является максимальной возможной степенью окисления для серы.
Поскольку сера уже находится в максимальной степени окисления, она не может её повысить (отдать электроны). Она может только понизить свою степень окисления (принять электроны).
Когда элемент принимает электроны, он является окислителем.
Вывод: Утверждение Б неверно. Серная кислота (за счет серы +6) может проявлять только окислительные свойства. Например, концентрированная серная кислота окисляет медь: Cu + 2H₂SO₄(конц.) → CuSO₄ + SO₂ + 2H₂O, где S⁺⁶ → S⁺⁴. Разбавленная серная кислота также является окислителем, но за счет ионов водорода (H⁺), а не серы (+6), которая не меняет свою степень окисления в реакциях с металлами, стоящими до водорода в ряду активности.
Утверждение А верно, потому что сера в сероводороде (H₂S) находится в своей минимальной степени окисления (-2), что позволяет ей только отдавать электроны и выступать в роли восстановителя.
Утверждение Б неверно, потому что сера в серной кислоте (H₂SO₄) находится в своей максимальной степени окисления (+6), что позволяет ей только принимать электроны и выступать в роли окислителя. Она не может проявлять восстановительные свойства, так как не может повысить свою степень окисления выше +6.
Ответ: Верно только А.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.


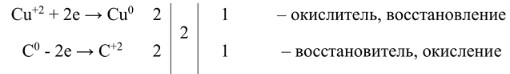
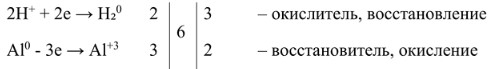



Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!