
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 26-27 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
5. Изменение числа нейтронов в ядре атома химического элемента приводит к образованию ☐☐☐☐☐☐☐☐.
Часть II
1. Выберите верные утверждения.
1) Ядро атома содержит протоны и нейтроны, суммарная масса которых равна массовому числу атома.
2) Нейтрон — это электронейтральная частица с массой, равной 1.
3) Ядро атома не имеет заряда.
4) Электрон — это отрицательно заряженная частица с массой, равной 1.
5) Химический элемент — это мельчайшая частица, сохраняющая его химические свойства.
2. Заполните таблицу «Состав атомов химических элементов».
| ХАРАКТЕРИСТИКА ХИМИЧЕСКОГО ЭЛЕМЕНТА | ЗНАКИ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ | ||||
|---|---|---|---|---|---|
| S | Si | Fe | Zn | Br | |
| Число протонов | |||||
| Число электронов | |||||
| Число нейтронов | |||||
3. Установите соответствие между названием химического элемента и условными обозначениями его атомов. Из букв, соответствующих правильным ответам, вы составите название самого лёгкого из изотопов водорода: ☐☐☐☐☐
| НАЗВАНИЕ ХИМИЧЕСКОГО ЭЛЕМЕНТА | 3517Э | 3919Э | 168Э | 3717Э | 4019Э | 178Э |
|---|---|---|---|---|---|---|
| Хлор | П | К | Н | Т | Г | О |
| Калий | И | Р | В | Ц | И | Л |
| Кислород | М | Д | О | У | Ч | Й |
4. Определите, в каких парах химических элементов число нейтронов в ядре атома одного из элементов вдвое больше.
1. \(^{108}_{47}Ag\) и \(^{56}_{26}Fe\)
2. \(^{12}_{6}C\) и \(^{27}_{13}Al\)
3. \(^{20}_{10}Ne\) и \(^{9}_{4}Be\)
4. \(^{20}_{10}Ne\) и \(^{40}_{20}Ca\)
5. Приведите примеры использования явления радиактивности, применения ядерных процессов, подчеркнув их положительное и отрицательное влияние на человека.
| Положительное | Отрицательное |
|---|---|
6. Запишите названия и символы химических элементов, в атомах которых:
1. 5 протонов, 6 нейтронов и 5 электронов
2. 10 протонов, 10 нейтронов и 9 электронов
3. 15 протонов, 15 электронов и 16 нейтронов
Вопрос 5
Изменение числа нейтронов в ядре атома химического элемента приводит к образованию изотопов.
Часть II
Вопрос 1
1. Ядро атома содержит протоны и нейтроны, суммарная масса которых равна массовому числу атома. Верно.
2. Нейтрон – это электронейтральная частица с массой, равной 1. Верно.
3. Ядро атома не имеет заряда. Неверно, ядро заряжено положительно, заряд равен числу протонов.
4. Электрон – это отрицательно заряженная частица с массой, равной 1. Неверно, масса электрона во много раз меньше 1.
5. Химический элемент – это мельчайшая частица, сохраняющая его химические свойства. Неверно, химический элемент – это вид атомов.
Ответ: 1, 2.
Вопрос 2
| Характеристика химического элемента | Знаки химических элементов | ||||
|---|---|---|---|---|---|
| S | Si | Fe | Zn | Br | |
| Число протонов | 16 | 14 | 26 | 30 | 35 |
| Число электронов | 16 | 14 | 26 | 30 | 35 |
| Число нейтронов | 16 | 14 | 30 | 35 | 45 |
Вопрос 3
| Хлор | ³⁵₁₇Cl | П |
|---|---|---|
| ³⁷₁₇Cl | Т | |
| Калий | ³⁹₁₉K | Р |
| ⁴⁰₁₉K | И | |
| Кислород | ¹⁶₈O | О |
| ¹⁷₈O | Й |
Название самого легкого из изотопов водорода: ПРОТИЙ.
Вопрос 4
| 1) | 10847Ag | N = 108 — 47 = 61 | 61/30 = 2,03 > 2 |
| 5626Fe | N = 56 — 26 = 30 | ||
| 2) | 126C | N = 12 — 6 = 6 | 14/6 = 2,33 > 2 |
| 2713Al | N = 27 — 13 = 14 | ||
| 3) | 2010Ne | N = 20 — 10 = 10 | 10/5 = 2 |
| 94Be | N = 9 — 4 = 5 | ||
| 4) | 2010Ne | N = 20 — 10 = 10 | 20/10 = 2 |
| 4020Ca | N = 40 — 20 = 20 |
Ответ: 3, 4.
Вопрос 5
| Положительное | Отрицательное |
|---|---|
| Использование в медицине | Негативное влияние на здоровье |
| Использование в АЭС | Экологические и техногенные катастрофы |
| Использование в науке | Ядерное оружие |
Вопрос 6
- 5 протонов, 6 нейтронов и 5 электронов — бор (B)
- 10 протонов, 10 нейтронов и 9 электронов — неон (Ne)
- 15 протонов, 15 электронов и 16 нейтронов — фосфор (P)
Вопрос 5
1. Что такое изотопы?
— Изотопы — это атомы одного и того же химического элемента, которые имеют одинаковое количество протонов (они принадлежат к одному и тому же элементу) и разное количество нейтронов. Из-за различного числа нейтронов изотопы имеют разную атомную массу.
— Важно, что атомы одного химического элемента, но с разным числом нейтронов, имеют одинаковое химическое поведение, так как определяющим для химических свойств является количество протонов в ядре атома (то есть атомный номер).
2. Как изменение числа нейтронов приводит к образованию изотопов?
— Число нейтронов может изменяться в ядре атома, что приводит к образованию изотопов. Если количество нейтронов в атоме изменяется, то его масса изменяется, но элемент остается тем же, так как число протонов в атоме не меняется.
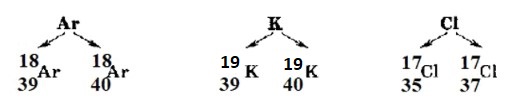
Пример с атомами на картинке:
— Аргон (Ar) с атомной массой 39 и 40. Это два изотопа аргона, так как у них одинаковое количество протонов (18), но разное количество нейтронов — 21 и 22 соответственно.
— Калий (K) с атомной массой 39 и 40. Это два изотопа калия с атомным номером 19, но разным количеством нейтронов — 20 и 21.
— Хлор (Cl) с атомной массой 35 и 37. Это два изотопа хлора с атомным номером 17, но разным количеством нейтронов — 18 и 20.
Ответ:
— Изотопы — это атомы одного и того же химического элемента, но с разным числом нейтронов.
Итог:
— Изменение числа нейтронов в ядре атома химического элемента приводит к образованию изотопов этого элемента.
Часть II
Вопрос 1
Давайте разберем каждый пункт по порядку, объясняя, почему каждый из них верен или неверен.
1) Ядро атома содержит протоны и нейтроны, суммарная масса которых равна массовому числу атома.
Верно.
— В ядре атома содержатся два типа частиц: протоны и нейтроны. Протоны — это положительно заряженные частицы, а нейтроны не имеют заряда.
— Массовое число атома — это сумма протонов и нейтронов в его ядре. Массовое число не учитывает электроны, так как их масса очень мала по сравнению с массой протонов и нейтронов.
— Таким образом, сумма массы протонов и нейтронов (в граммах на моль) как раз и составляет массовое число атома.
2) Нейтрон — это электронейтральная частица с массой, равной 1.
Верно.
— Нейтрон — это частица в ядре атома, которая не имеет заряда, то есть она электронейтральна.
— Масса нейтрона примерно равна 1 а.е.м. (атомной единице массы), что примерно равно массе протона. Эта масса составляет примерно 1 (в атомных единицах массы), но масса электрона в тысячу раз меньше.
— Нейтрон участвует в образовании ядра атома, но не влияет на его химические свойства, поскольку не несет электрического заряда.
3) Ядро атома не имеет заряда.
Неверно.
— Ядро атома всегда имеет положительный заряд, поскольку оно состоит из протонов (которые имеют положительный заряд) и нейтронов (которые нейтральны, то есть не имеют заряда).
— Количество протонов в ядре определяет заряд атома, и это количество всегда равно атомному номеру. Например, в ядре атома водорода (1 протон) заряд ядра будет +1.
4) Электрон — это отрицательно заряженная частица с массой, равной 1.
Неверно.
— Электрон — это отрицательно заряженная частица, которая вращается вокруг ядра атома. Но его масса очень мала по сравнению с массой протона или нейтрона.
— Массой электрона пренебрегают при расчете массового числа, так как она составляет примерно \(9.11 \times 10^{-31}\) кг — в много раз меньше 1 (по сравнению с массой протона, которая составляет около \(1.67 \times 10^{-27}\) кг).
— Электрон играет ключевую роль в химическом поведении атома, так как он отвечает за образование химических связей, но его масса не равна единице.
5) Химический элемент — это мельчайшая частица, сохраняющая его химические свойства.
Неверно.
— Химический элемент — это совокупность атомов, имеющих одинаковое количество протонов в ядре. В то время как атом является мельчайшей частицей вещества, сохраняющей его химические свойства, химический элемент представляет собой группу атомов, объединенных по количеству протонов.
— Например, все атомы с 6 протонами в ядре — это углерод. Сам атом углерода является той частицей, которая сохраняет химические свойства этого элемента.
Правильные утверждения: 1, 2.
— 1: Верно, ядро атома действительно содержит протоны и нейтроны, и их суммарная масса равна массовому числу атома.
— 2: Верно, нейтрон — это электронейтральная частица с массой, равной 1.
Итог:
— Утверждения 1 и 2 верны, так как они правильно объясняют основные характеристики частиц атома.
— Утверждения 3, 4 и 5 неверны, поскольку они не соответствуют научным фактам о строении атома и его частиц.
Вопрос 2
Давайте подробно разберем, как мы заполняем таблицу «Состав атомов химических элементов», и почему значения в таблице такие.
Таблица содержит атомы различных химических элементов, и нам нужно заполнить информацию о каждом из них.
- S — сера
- Si — кремний
- Fe — железо
- Zn — цинк
- Br — бром
Мы будем заполнять таблицу тремя характеристиками: число протонов, число электронов и число нейтронов.
1. Число протонов:
Число протонов в атоме определяет атомный номер элемента. Это число нельзя изменить для атомов одного элемента, так как оно уникально для каждого химического элемента.
- S (сера) — атом серы имеет атомный номер 16, то есть в его ядре 16 протонов.
- Si (кремний) — атом кремния имеет атомный номер 14, то есть в его ядре 14 протонов.
- Fe (железо) — атом железа имеет атомный номер 26, то есть в его ядре 26 протонов.
- Zn (цинк) — атом цинка имеет атомный номер 30, то есть в его ядре 30 протонов.
- Br (бром) — атом брома имеет атомный номер 35, то есть в его ядре 35 протонов.
2. Число электронов:
Для нейтральных атомов число электронов равно числу протонов (так как атом в целом не имеет заряда). То есть количество электронов в атоме будет таким же, как количество протонов.
- S (сера) — 16 электронов.
- Si (кремний) — 14 электронов.
- Fe (железо) — 26 электронов.
- Zn (цинк) — 30 электронов.
- Br (бром) — 35 электронов.
3. Число нейтронов:
Число нейтронов в атоме можно рассчитать, зная массовое число и число протонов. Массовое число равно сумме числа протонов и числа нейтронов. Из этого мы можем вычесть число протонов, чтобы узнать количество нейтронов.
Формула для расчета числа нейтронов:
\(\text{Число нейтронов} = \text{Массовое число} — \text{Число протонов}\)
Массовое число элемента — это сумма числа протонов и нейтронов в атоме.
S (сера) — массовое число серы 32 (основной изотоп), следовательно:
\(32 — 16 = 16 \text{ нейтронов}.\)
Si (кремний) — массовое число кремния 28, следовательно:
\(28 — 14 = 14 \text{ нейтронов}.\)
Fe (железо) — массовое число железа 56, следовательно:
\(56 — 26 = 30 \text{ нейтронов}.\)
Zn (цинк) — массовое число цинка 65, следовательно:
\(65 — 30 = 35 \text{ нейтронов}.\)
Br (бром) — массовое число брома 80, следовательно:
\(80 — 35 = 45 \text{ нейтронов}.\)
Заключение:
1. Число протонов — это атомный номер химического элемента, который однозначно определяет элемент.
2. Число электронов — равно числу протонов в нейтральном атоме.
3. Число нейтронов — можно найти, вычитая число протонов из массового числа атома.
Вопрос 3
Необходимо установить соответствие между химическим элементом и условными обозначениями его атомов. Затем, из букв, которые соответствуют правильным ответам, нужно составить название самого легкого из изотопов водорода.
1. Хлор (Cl)
Химический элемент хлор имеет атомный номер 17, что означает, что в ядре атома хлора всегда 17 протонов.
Изотопы хлора:
\(^{35}_{17}Cl\) — это основной изотоп хлора с 35 массовым числом, то есть 18 нейтронов.
\(^{37}_{17}Cl\) — это изотоп хлора с 37 массовым числом, то есть 20 нейтронов.
По условиям задачи, для хлора:
\(^{35}_{17}Cl\) обозначается буквой П.
\(^{37}_{17}Cl\) обозначается буквой Т.
2. Калий (K)
Химический элемент калий имеет атомный номер 19, что означает, что в ядре атома калия всегда 19 протонов.
Изотопы калия:
\(^{39}_{19}K\) — это основной изотоп калия с 39 массовым числом, то есть 20 нейтронов.
\(^{40}_{19}K\) — это изотоп калия с 40 массовым числом, то есть 21 нейтрон.
По условиям задачи, для калия:
\(^{39}_{19}K\) обозначается буквой Р.
\(^{40}_{19}K\) обозначается буквой И.
3. Кислород (O)
Химический элемент кислород имеет атомный номер 8, что означает, что в ядре атома кислорода всегда 8 протонов.
Изотопы кислорода:
\(^{16}_{8}O\) — это основной изотоп кислорода с 16 массовым числом, то есть 8 нейтронов.
\(^{17}_{8}O\) — это изотоп кислорода с 17 массовым числом, то есть 9 нейтронов.
По условиям задачи, для кислорода:
\(^{16}_{8}O\) обозначается буквой О.
\(^{17}_{8}O\) обозначается буквой Й.
4. Самый легкий изотоп водорода: ПРОТИЙ.
Изотопы водорода:
Протий — самый легкий изотоп водорода, который состоит из 1 протона и 0 нейтронов. Его массовое число равно 1. Это обозначение водорода \(^{1}H\).
Другие изотопы водорода: дейтерий (\(^{2}H\), 1 протон и 1 нейтрон) и тритий
(\(^{3}H\), 1 протон и 2 нейтрона).
ПРОТИЙ — это тот изотоп водорода, который имеет минимальное массовое число (1). Из букв, соответствующих правильным ответам для хлора, калия и кислорода, мы составляем это слово:
П — из хлора (\(^{35}Cl\)).
Р — из калия (\(^{39}K\)).
О — из кислорода (\(^{16}O\)).
Итак, мы составляем слово ПРОТИЙ.
Резюме:
1. Мы определили, что хлор, калий и кислород имеют разные изотопы, которые отличаются количеством нейтронов.
2. Составили слово ПРОТИЙ из букв, соответствующих правильным ответам для хлора, калия и кислорода.
3. ПРОТИЙ — это самый легкий изотоп водорода, который имеет 1 протон и 0 нейтронов.
Вопрос 4
Число нейтронов (N) в ядре атома определяется как разность между массовым числом (A) и атомным номером (Z):
\(
N = A — Z
\)
Атомный номер (Z) — это число протонов в ядре, и он указывается в нижнем индексе перед символом элемента (например, в \(^{108}_{47}Ag\), 47 — это атомный номер). Массовое число (A) указывается в верхнем индексе (например, в \(^{108}_{47}Ag\), 108 — это массовое число).
Наша задача — найти пары, где число нейтронов одного элемента ровно в два раза больше числа нейтронов другого элемента.
1. \(^{108}_{47}Ag\) и \(^{56}_{26}Fe\)
Для \(^{108}_{47}Ag\) (Серебро):
— Атомный номер (Z) = 47.
— Массовое число (A) = 108.
— Число нейтронов \(N_{Ag} = A — Z = 108 — 47 = 61\).
Для \(^{56}_{26}Fe\) (Железо):
— Атомный номер (Z) = 26.
— Массовое число (A) = 56.
— Число нейтронов \(N_{Fe} = A — Z = 56 — 26 = 30\).
Проверяем отношение:
— Мы ищем, является ли число нейтронов одного элемента вдвое больше, чем у другого. В данном случае, \(N_{Ag}\) больше, чем \(N_{Fe}\).
— \(N_{Ag} / N_{Fe} = 61 / 30 \approx 2.033\).
— Это значение не равно точно 2.
— Вывод: Эта пара не соответствует условию.
2. \(^{12}_{6}C\) и \(^{27}_{13}Al\)
Для \(^{12}_{6}C\) (Углерод):
— Атомный номер (Z) = 6.
— Массовое число (A) = 12.
— Число нейтронов \(N_C = A — Z = 12 — 6 = 6\).
-Для \(^{27}_{13}Al\) (Алюминий):
— Атомный номер (Z) = 13.
— Массовое число (A) = 27.
— Число нейтронов \(N_{Al} = A — Z = 27 — 13 = 14\).
Проверяем отношение:
— \(N_{Al}\) больше, чем \(N_C\).
— \(N_{Al} / N_C = 14 / 6 \approx 2.333\).
— Это значение не равно точно 2.
— Вывод: Эта пара не соответствует условию.
3. \(^{20}_{10}Ne\) и \(^{9}_{4}Be\)
Для \(^{20}_{10}Ne\) (Неон):
— Атомный номер (Z) = 10.
— Массовое число (A) = 20.
— Число нейтронов \(N_{Ne} = A — Z = 20 — 10 = 10\).
Для \(^{9}_{4}Be\) (Бериллий):
— Атомный номер (Z) = 4.
— Массовое число (A) = 9.
— Число нейтронов \(N_{Be} = A — Z = 9 — 4 = 5\).
Проверяем отношение:
— \(N_{Ne}\) больше, чем \(N_{Be}\).
— \(N_{Ne} / N_{Be} = 10 / 5 = 2\).
— Это значение равно точно 2.
— Вывод: Эта пара соответствует условию.
4. \(^{20}_{10}Ne\) и \(^{40}_{20}Ca\)
Для \(^{20}_{10}Ne\) (Неон):
— Атомный номер (Z) = 10.
— Массовое число (A) = 20.
— Число нейтронов \(N_{Ne} = A — Z = 20 — 10 = 10\).
Для \(^{40}_{20}Ca\) (Кальций):
— Атомный номер (Z) = 20.
— Массовое число (A) = 40.
— Число нейтронов \(N_{Ca} = A — Z = 40 — 20 = 20\).
Проверяем отношение:
— \(N_{Ca}\) больше, чем \(N_{Ne}\).
— \(N_{Ca} / N_{Ne} = 20 / 10 = 2\).
— Это значение равно точно 2.
— Вывод: Эта пара соответствует условию.
Итоговый ответ:
Пары, в которых число нейтронов в ядре атома одного из элементов в два раза больше, чем у другого, это:
3. \(^{20}_{10}Ne\) и \(^{9}_{4}Be\)
4. \(^{20}_{10}Ne\) и \(^{40}_{20}Ca\)
Вопрос 5
Давайте разберем задание более детально, чтобы понять, как можно сформулировать положительные и отрицательные воздействия использования явлений радиационности и ядерных процессов на человека.
Радиоактивность и ядерные процессы:
Радиоактивность — это процесс, при котором атомные ядра нестабильных элементов распадаются с выделением радиоактивных частиц и энергии. Это явление используется в самых разных областях, таких как медицина, энергетика и научные исследования. Однако, как и любое технологическое достижение, радиоактивность и ядерные процессы имеют как положительные, так и отрицательные последствия.
Положительное влияние радиоактивности и ядерных процессов:
1) Использование в медицине:
— Радиоактивные вещества активно применяются в медицинской диагностике и лечении. Например, радиоизотопные исследования (например, использование радиоактивного йода для диагностики и лечения заболеваний щитовидной железы) позволяют точно обнаружить опухоли или другие заболевания.
— Лучевая терапия используется для уничтожения раковых клеток в организме, и она является важной частью лечения онкологических заболеваний.
2) Использование в АЭС (атомных электростанциях):
— Атомные электростанции являются источником чистой энергии, который не загрязняет атмосферу углекислым газом, как угольные или газовые станции.
— АЭС обеспечивает огромные объемы энергии для множества отраслей промышленности и для бытового использования, обеспечивая развитие стран и улучшение качества жизни.
3) Использование в науке:
— Ядерные реакции используются для изучения структуры материи, в том числе для синтеза новых химических элементов в лабораториях.
— Радиоактивные изотопы широко применяются в научных исследованиях, например, в геологии для определения возраста древних камней (метод радиоактивного датирования).
Отрицательное влияние радиоактивности и ядерных процессов:
1) Негативное влияние на здоровье:
— Ионизирующее излучение, которое сопровождает радиоактивный распад, может оказывать вредное влияние на клетки организма, что ведет к раковым заболеваниям, генетическим мутациям и другим серьезным заболеваниям.
— Люди, работающие в радиационно опасных областях (например, атомных электростанциях или с радиоактивными изотопами), могут подвергаться лучевой болезни, что значительно увеличивает риск заболеваний в долгосрочной перспективе.
2) Экологические и техногенные катастрофы:
— Примером техногенной катастрофы, вызванной радиоактивностью, является Чернобыльская авария в 1986 году, которая привела к масштабному радиоактивному загрязнению и экологическим последствиям в радиусе сотен километров.
— Аварии на атомных электростанциях, такие как в Фукусиме в 2011 году, также приводят к экологическим катастрофам, включая загрязнение водоемов, атмосферного воздуха и сельскохозяйственных земель.
3) Ядерное оружие:
— Ядерные взрывы, такие как бомбардировка Хиросимы и Нагасаки в 1945 году, продемонстрировали разрушительную силу ядерных технологий.
— Ядерное оружие является угрозой для всего человечества, так как оно может привести к масштабным разрушениям, долгосрочным последствиям для здоровья людей и окружающей среды (например, радиоактивные осадки).
Вывод:
Положительные аспекты:
— Радиоактивность помогает в медицине, науке и энергетике, позволяя эффективно лечить болезни, обеспечивать энергией большую часть мира и делать важные открытия в области науки.
Отрицательные аспекты:
— Наряду с этим, использование радиоактивных веществ может оказывать вредное воздействие на здоровье, а также вызывает серьезные экологические и социальные проблемы в случае аварий или при применении ядерного оружия.
Эти примеры подчеркивают, как важно тщательно контролировать использование радиоактивных материалов и ядерных технологий, чтобы минимизировать их вредное воздействие и максимально использовать их преимущества для общества.
Вопрос 6
Необходимо определить химические элементы, зная количество протонов, нейтронов и электронов в их атомах. Мы будем использовать атомные числа и массовые числа.
1. 5 протонов, 6 нейтронов и 5 электронов:
— Число протонов определяет атомный номер химического элемента. Если в атоме 5 протонов, то это бор (B), так как атомный номер бором равен 5.
— Число электронов в нейтральном атоме будет равно числу протонов (для нейтральных атомов), поэтому в этом случае будет 5 электронов.
— Число нейтронов можно вычислить как разницу между массовым числом и числом протонов:
\(
\text{Массовое число} = \text{Число протонов} + \text{Число нейтронов} = 5 + 6 = 11.
\)
Таким образом, атом бор (B) имеет массовое число 11 и состоит из 5 протонов, 6 нейтронов и 5 электронов.
Ответ: 5 протонов, 6 нейтронов и 5 электронов — бор (B).
2. 10 протонов, 10 нейтронов и 9 электронов:
— Число протонов определяет атомный номер. В данном случае, если 10 протонов, то это неон (Ne), так как атомный номер неона равен 10.
— Число электронов в нейтральном атоме будет равно числу протонов, но здесь указано, что 9 электронов. Это означает, что атом неона положительно заряжен, так как один электрон был удален, оставив положительный заряд (это ион неона \(\text{Ne}^+\).
— Число нейтронов вычисляем по аналогии:
\(
\text{Массовое число} = \text{Число протонов} + \text{Число нейтронов} = 10 + 10 = 20.
\)
Следовательно, неон имеет массовое число 20.
Ответ: 10 протонов, 10 нейтронов и 9 электронов — неон (Ne).
3. 15 протонов, 15 электронов и 16 нейтронов:
— Число протонов опять определяет атомный номер. В данном случае, если 15 протонов, то это фосфор (P), так как атомный номер фосфора равен 15.
— Число электронов в нейтральном атоме будет равно числу протонов, так что здесь будет 15 электронов.
— Число нейтронов можно вычислить, зная массовое число:
\(
\text{Массовое число} = \text{Число протонов} + \text{Число нейтронов} = 15 + 16 = 31.
\)
Таким образом, атом фосфора имеет массовое число 31.
Ответ: 15 протонов, 15 электронов и 16 нейтронов — фосфор (P).
Итог:
1. 5 протонов, 6 нейтронов и 5 электронов — бор (B)
2. 10 протонов, 10 нейтронов и 9 электронов — неон (Ne)
3. 15 протонов, 15 электронов и 16 нейтронов — фосфор (P)

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!