
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 32-33 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
Часть I
1.
2. Металлы в стремлении получить завершённый внешний электронный слой атома ______ свои внешние ______ , а неметаллы ______ недостающие до 8 электроны.
3. В группе с ростом порядкового номера элементов усиливаются ______ свойства и ослабевают ______ , потому что:
1) увеличивается число ______
2) постоянно число ______
3) увеличивается ______
4. В периоде с ростом порядкового номера элементов усиливаются ______ свойства и ослабевают ______ , потому что:
1) увеличивается число ______
2) постоянно число ______
3) увеличивается ______
5. Заполните таблицу «Свойства химических элементов», указав усиление или ослабление свойств в ряду.
| РЯД ЭЛЕМЕНТОВ | МЕТАЛЛИЧЕСКИЕ СВОЙСТВА | НЕМЕТАЛЛИЧЕСКИЕ СВОЙСТВА |
|---|---|---|
| P, S, Cl | ||
| P, As, Sb | ||
| C, B, Be | ||
| Sn, Ge, Si |
Часть II
1. Выберите символы химических элементов-неметаллов. Из букв, соответствующих правильным ответам, вы составите название чрезвычайно токсичного газа бледно-жёлтого цвета с резким запахом: ☐☐☐☐.
1) F
2) K
3) Na
4) Pb
5) I
6) C
7) As
8) Ca
2. Верны ли следующие суждения?
А. По периоду слева направо радиус атома увеличивается.
Б. По группе снизу вверх радиус атома уменьшается.
1) оба суждения верны
2) верно только А
3) верно только Б
4) оба суждения неверны
§7
Часть I
Вопрос 1
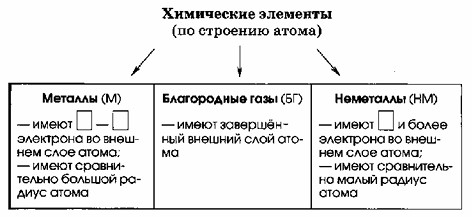
| Металлы (М) | Благородные газы (БГ) | Неметаллы (НМ) |
|---|---|---|
| Имеют 1-3 электрона на внешнем слое атома. Имеют сравнительно большой радиус атома. | Имеют завершенный внешний слой атома. | Имеют 4 и более электронов на внешнем слое атома. Имеют сравнительно малый радиус атома. |
Вопрос 2
Металлы в стремлении получить завершенный внешний электронный слой атома ОТДАЮТ свои внешние ЭЛЕКТРОНЫ, а неметаллы ПРИНИМАЮТ недостающие до 8 электроны.
Вопрос 3
В группе с ростом порядкового номера элементов усиливаются МЕТАЛЛИЧЕСКИЕ свойства и ослабевают НЕМЕТАЛЛИЧЕСКИЕ, потому что:
1) увеличивается число ЭНЕРГЕТИЧЕСКИХ УРОВНЕЙ
2) постоянно число ВНЕШНИХ ЭЛЕКТРОНОВ
3) увеличивается АТОМНЫЙ РАДИУС
Вопрос 4
В периоде с ростом порядкового номера элементов усиливаются НЕМЕТАЛЛИЧЕСКИЕ свойства и ослабевают МЕТАЛЛИЧЕСКИЕ, потому что:
1) увеличивается число ВНЕШНИХ ЭЛЕКТРОНОВ
2) постоянно число ЭНЕРГЕТИЧЕСКИХ УРОВНЕЙ
3) увеличивается ЗАРЯД ЯДРА
Вопрос 5
| Ряд элементов | Металлические свойства | Неметаллические свойства |
|---|---|---|
| P, S, Cl | ослабевают | усиливаются |
| P, As, Sb | усиливаются | ослабевают |
| C, B, Be | усиливаются | ослабевают |
| Sn, Ge, Si | ослабевают | усиливаются |
Часть II
Вопрос 1
| 1) F | Неметалл | Ф |
| 2) Na | Металл | Т |
| 3) K | Металл | А |
| 4) Pb | Металл | Е |
| 5) I | Неметалл | Т |
| 6) C | Неметалл | О |
| 7) As | Неметалл | Р |
| 8) Ca | Металл | Д |
Название чрезвычайно токсичного газа бледно-желтого цвета с резким запахом: ФТОР.
Вопрос 2
А. По периоду слева направо радиус атома увеличивается. Это неверно, поскольку при неизменном количестве энергетических уровней увеличивается заряд ядра, что приводит к усилению силы притяжения внешних электронов к ядру, и, как следствие, радиус атома уменьшается.
Б. По группе снизу вверх радиус атома уменьшается. Это верно, так как количество энергетических уровней уменьшается при движении снизу вверх по таблице.
Верно только Б.
Ответ: 3.
§7
Часть I
Вопрос 1
На картинке представлена схема, классифицирующая химические элементы по их строению атома. Нужно заполнить таблицу по классификации химических элементов: металлы, благородные газы и неметаллы.
Разбор ответа:
1. Металлы (М):
Металлы — это элементы, которые:
— Имеют 1-3 электрона на внешнем энергетическом уровне. Это связано с тем, что они располагаются в группах 1-3 (щелочные металлы, щелочноземельные металлы и т.д.), где количество электронов на внешнем уровне варьируется от 1 до 3.
— Имеют сравнительно большой радиус атома, поскольку электронные оболочки (слои) у них не заполняются полностью и находятся далеко от ядра.
Пример:
- Натрий (Na) — 1 электрон на внешнем уровне.
- Кальций (Ca) — 2 электрона на внешнем уровне.
- Алюминий (Al) — 3 электрона на внешнем уровне.
2. Благородные газы (БГ):
Благородные газы — это элементы, которые:
— Имеют завершённый внешний слой атома, что означает, что их внешний энергетический уровень полностью заполнен электронами (обычно 8 электронов на внешнем уровне, за исключением гелия, у которого 2 электрона на внешнем уровне).
— Эти элементы стабильны, и, как правило, они инертны и не склонны к химическим реакциям с другими веществами.
Пример:
- Неон (Ne) — 8 электронов на внешнем уровне.
- Аргон (Ar) — 8 электронов на внешнем уровне.
- Гелий (He) — 2 электрона на внешнем уровне.
3. Неметаллы (НМ):
Неметаллы — это элементы, которые:
— Имеют 4 и более электронов на внешнем энергетическом уровне (группы 14-17).
— Имеют сравнительно малый радиус атома, потому что в неметаллов электроны более плотно притягиваются к ядру, и внешние электроны находятся ближе к нему.
Пример:
- Кислород (O) — 6 электронов на внешнем уровне.
- Азот (N) — 5 электронов на внешнем уровне.
- Фтор (F) — 7 электронов на внешнем уровне.
Итог:
Заполнив таблицу, мы получаем:
| Металлы (М) | Благородные газы (БГ) | Неметаллы (НМ) |
|---|---|---|
| Имеют 1-3 электрона на внешнем слое атома. | Имеют завершённый внешний слой атома. | Имеют 4 и более электронов на внешнем слое атома. |
| Имеют сравнительно большой радиус атома. | Имеют сравнительно малый радиус атома. |
Почему так:
— Металлы обычно имеют малое количество валентных электронов (1-3) на внешнем уровне, что делает их склонными к отдаче электронов и образованию положительных ионов. Они также имеют больший атомный радиус из-за слабой связи между электронами и ядром.
— Благородные газы имеют полный внешний слой (8 электронов, за исключением гелия, у которого 2), что делает их стабильными и малореактивными.
— Неметаллы имеют больше электронов на внешнем уровне (4 и более), что делает их склонными к принятию электронов и образованию отрицательных ионов, а также имеют меньший радиус из-за сильного притяжения электронов к ядру.
Вопрос 2
В данном предложении речь идет о поведении металлов и неметаллов в контексте их стремления достичь стабильной электронной конфигурации, которая обычно соответствует заполненному внешнему электронному слою.
1. Металлы:
Металлы, как правило, имеют небольшое количество электронов на своем внешнем уровне (обычно от 1 до 3). Для достижения стабильной конфигурации они стремятся избавиться от этих электронов, чтобы перейти на более низкий уровень энергии, где электронных оболочек меньше. Это позволяет им достичь состояния, близкого к инертным газам, которые имеют полный внешний уровень. Поэтому мы говорим, что металлы отдают свои внешние электроны.
2. Неметаллы:
В отличие от металлов, неметаллы обычно имеют большее количество электронов на внешнем уровне (от 4 до 7) и стремятся заполнить этот уровень до 8 электронов, чтобы достичь стабильной конфигурации. Они делают это, принимая недостающие электроны от других элементов (например, от металлов), что позволяет им достичь полного внешнего уровня. Таким образом, неметаллы принимают недостающие до 8 электроны.
В итоге, взаимодействие между металлами и неметаллами приводит к образованию ионных связей, где металлы становятся положительно заряженными ионами (катионами), а неметаллы – отрицательно заряженными ионами (анионами). Это объясняет основные принципы химической связи и реакций между различными элементами.
Вопрос 3
В данном предложении рассматриваются изменения свойств элементов в периодической таблице в зависимости от их порядкового номера, особенно в рамках одной группы (колонки). Давайте подробнее разберем каждую часть ответа.
1. Усиление металлических свойств:
Металлические свойства включают в себя такие характеристики, как проводимость электричества, тепла, а также способность отдавать электроны. При росте порядкового номера в группе металлические свойства усиливаются, потому что элементы становятся более склонными к отдаче электронов.
2. Ослабление неметаллических свойств:
Неметаллические свойства, напротив, связаны с тенденцией элементов принимать электроны. В группе с увеличением порядкового номера эти свойства ослабевают, так как элементы становятся менее привлекательными для захвата электронов.
Теперь давайте рассмотрим причины этих изменений:
1. Увеличивается число энергетических уровней:
С увеличением порядкового номера каждого элемента добавляется новый энергетический уровень (или оболочка) электронов. Это приводит к тому, что внешние электроны находятся дальше от ядра и меньше подвержены его притяжению. Это делает металлы более склонными к отдаче своих электронов.
2. Постоянное число внешних электронов:
В пределах одной группы количество внешних электронов остается постоянным. Например, все элементы группы щелочных металлов имеют один внешний электрон. Это означает, что несмотря на увеличение числа энергетических уровней, способность элементов отдавать электроны остается относительно высокой.
3. Увеличивается атомный радиус:
С увеличением порядкового номера атомный радиус также увеличивается, поскольку добавляются новые энергетические уровни. Более крупные атомы имеют более слабое притяжение между ядром и внешними электронами, что облегчает отдачу электронов и усиливает металлические свойства.
Таким образом, с ростом порядкового номера в группе усиливаются металлические свойства и ослабевают неметаллические свойства из-за увеличения числа энергетических уровней, постоянства числа внешних электронов и увеличения атомного радиуса.
Вопрос 4
В данном предложении рассматриваются изменения свойств элементов в периодической таблице в зависимости от их порядкового номера, особенно в рамках одного периода (строки). Давайте подробнее разберем каждую часть ответа.
1. Усиление неметаллических свойств:
Неметаллические свойства включают в себя такие характеристики, как высокая электроотрицательность, способность принимать электроны и образовывать ковалентные связи. В периоде с увеличением порядкового номера неметаллические свойства усиливаются, так как элементы становятся более склонными к захвату электронов.
2. Ослабление металлических свойств:
Металлические свойства, такие как проводимость электричества и тепла, а также способность отдавать электроны, ослабевают. Это связано с тем, что элементы в правой части периода становятся менее склонными к отдаче своих электронов.
Теперь рассмотрим причины этих изменений:
1. Увеличивается число внешних электронов:
С увеличением порядкового номера в пределах одного периода количество валентных (внешних) электронов увеличивается. Это делает элементы более похожими на неметаллы, поскольку они стремятся заполнить свой внешний уровень до 8 электронов.
2. Постоянное число энергетических уровней:
В пределах одного периода количество энергетических уровней остается постоянным (все элементы находятся на одном уровне, например, втором или третьем). Это означает, что все элементы имеют одинаковое количество оболочек, но различаются по количеству внешних электронов.
3. Увеличивается заряд ядра:
По мере увеличения порядкового номера увеличивается и заряд ядра (количество протонов). Это приводит к более сильному притяжению внешних электронов к ядру, что делает элементы более электроотрицательными и усиливает их неметаллические свойства. Более высокий заряд ядра также уменьшает радиус атома, что усиливает притяжение между ядром и внешними электронами.
Таким образом, в периоде с ростом порядкового номера действительно наблюдается усиление неметаллических свойств и ослабление металлических свойств из-за указанных факторов.
Вопрос 5
Давайте подробнее разберем изменения металлических и неметаллических свойств в указанных рядах элементов.
1. Ряд P, S, Cl:
— Металлические свойства: ослабевают. Фосфор (P) — это неметалл, серый (S) — тоже неметалл, а хлор (Cl) — галоген. В этом ряду элементы становятся более неметаллическими, и их металлические свойства снижаются.
— Неметаллические свойства: усиливаются. Поскольку элементы становятся более неметаллическими, их способность принимать электроны и образовывать ковалентные связи увеличивается.
2. Ряд P, As, Sb:
— Металлические свойства: усиливаются. Фосфор (P) — неметалл, арсен (As) — полуметалл, а сурьма (Sb) — также полуметалл, но с более выраженными металлическими свойствами. Таким образом, в этом ряду наблюдается переход к более металлическим свойствам.
— Неметаллические свойства: ослабевают. С увеличением порядкового номера свойства, характерные для неметаллов, становятся менее выраженными.
3. Ряд C, B, Be:
— Металлические свойства: усиливаются. Углерод (C) — неметалл, бор (B) — полуметалл, а бериллий (Be) — металл. Здесь наблюдается переход от неметаллических к металлическим свойствам.
— Неметаллические свойства: ослабевают. Поскольку мы движемся от углерода к бериллию, неметаллические свойства становятся менее выраженными.
4. Ряд Sn, Ge, Si:
— Металлические свойства: ослабевают. Олово (Sn) — металл, германий (Ge) — полуметалл, а кремний (Si) — тоже полуметалл, но с более выраженными неметаллическими свойствами. В этом ряду наблюдается снижение металлических свойств.
— Неметаллические свойства: усиливаются. Поскольку мы движемся от олова к кремнию, неметаллические свойства становятся более выраженными.
Таким образом, в каждом ряду наблюдаются изменения в характере свойств элементов в зависимости от их положения в периодической таблице.
Часть II
Вопрос 1
Химические элементы и их символы:
1. F — Неметалл (фтор)
2. K — Металл (калий)
3. Na — Металл (натрий)
4. Pb — Металл (свинец)
5. I — Неметалл (йод)
6. C — Неметалл (углерод)
7. As — Неметалл (мышьяк)
8. Ca — Металл (кальций)
Неметаллы среди них:
F (фтор) — неметалл.
I (йод) — неметалл.
C (углерод) — неметалл.
As (мышьяк) — неметалл.
Задание указывает на чрезвычайно токсичный газ бледно-желтого цвета с резким запахом. Это описание подходит для фтора (F₂).
Фтор — это очень опасный газ, который имеет желтоватый цвет и резкий, раздражающий запах. Он относится к неметаллам, как и йод, углерод и мышьяк, но для составления названия нужного газа, из правильных символов нам нужно взять F (фтор).
Окончательный ответ:
— Правильные буквы: F, I, C, As.
— Эти буквы составляют название фтор.
Фтор (F₂) — это один из самых токсичных газов, который используется в различных химических процессах, включая производство пластмасс и в некоторых химических реакциях.
Почему фтор?
Фтор — это газы, которые обладают желтым цветом и резким запахом, и его молекулы (F₂) действительно обладают высокой токсичностью.
Итог:
Правильный ответ: ФТОР.
Мы выбрали правильные символы химических элементов-неметаллов, и, составив их, получили название токсичного газа.
Вопрос 2
Суждение А:
«По периоду слева направо радиус атома увеличивается.»
Это суждение неверно. При движении по периоду (слева направо) количество валентных электронов увеличивается, но при этом также увеличивается заряд ядра (количество протонов в ядре). Это приводит к усилению электростатического притяжения между ядром и внешними электронами. В результате, несмотря на увеличение количества валентных электронов, радиус атома уменьшается, так как электроны притягиваются сильнее к ядру.
Суждение Б:
«По группе снизу вверх радиус атома уменьшается.»
Это суждение верно. При движении снизу вверх по группе (колонке) количество энергетических уровней (оболочек) уменьшается. Например, у элементов в нижней части группы больше энергетических уровней, чем у элементов в верхней части. Поскольку количество энергетических уровней уменьшается, радиус атома также уменьшается. Это связано с тем, что внешние электроны находятся ближе к ядру, так как меньшее количество оболочек создает меньшую «дистанцию» от ядра до внешних электронов.
Вывод:
Таким образом, из двух суждений:
— Суждение А неверно.
— Суждение Б верно.
Ответ: 3) верно только Б.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!