
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 41-43 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
4. Дополните таблицу «Ковалентная связь».
Часть II
1. Поиграйте в «крестики-нолики». Покажите выигрышный путь, состоящий из формул веществ с ковалентной связью, и запишите схемы их образования.
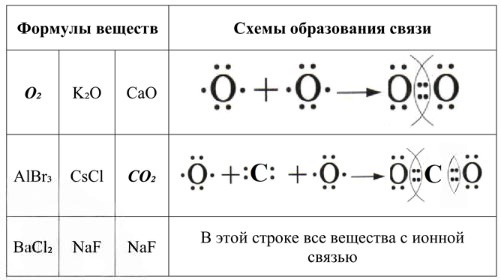
| ФОРМУЛЫ ВЕЩЕСТВ | СХЕМЫ ОБРАЗОВАНИЯ СВЯЗИ | ||
|---|---|---|---|
| O₂ | K₂O | CaO | |
| AlBr₃ | CsCl | CO₂ | |
| BaCl₂ | NaF | NaF | |
2. Выберите формулы соединений с ковалентной химической связью. Из букв, соответствующих правильным ответам, составьте название химического элемента, который входит в состав чёрного пороха:
1) KF _______ M
2) Al _______ X
3) Br₂ ______ C
4) BaO₂ _____ O
5) P₄________ E
6) KCl _______H
7) O₃ _______ P
8) Ca _______ И
9) S₂ _______ A
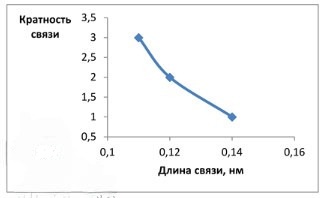
3*. Постройте график зависимости кратности химической связи от её длины.
Сделайте вывод.
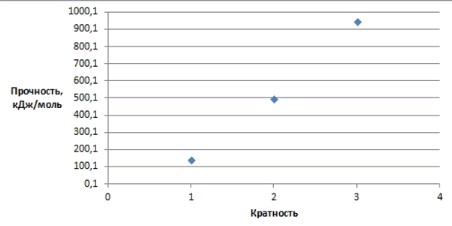
4*. Постройте график зависимости прочности химической связи от её кратности.
Сделайте вывод.
5*. Придумайте рисунок в стиле комиксов, отражающий процесс образования ковалентной неполярной химической связи.
Вопрос 4
Часть II
Вопрос 1
Вопрос 2
| 1. KF | Ионная связь | M |
| 2. Al | Металлическая связь | X |
| 3. Br₂ | Ковалентная связь | C |
| 4. BaO₂ | Ионная связь | O |
| 5. P₄ | Ковалентная связь | E |
| 6. KCl | Ионная связь | H |
| 7. O₃ | Ковалентная связь | P |
| 8. Ca | Металлическая связь | И |
| 9. S₂ | Ковалентная связь | A |
Название химического элемента, который входит в состав черного пороха: СЕРА.
Вопрос 3
| Кратность связи | Длина связи, нм |
|---|---|
| 1 | 0,14 (фтор) |
| 2 | 0,12 (кислород) |
| 3 | 0,11 (азот) |
Вывод: с увеличением кратности связи наблюдается сокращение ее длины.
Вопрос 4
| Молекула | Кратность связи | Прочность связи (энергия связи, кДж/моль) |
|---|---|---|
| F-F | 1 | 139 |
| O=O | 2 | 494 |
| N≡N | 3 | 945 |
Вывод: с увеличением кратности связи возрастает ее прочность.
Вопрос 5
Образование ковалентной неполярной связи:
Вопрос 4
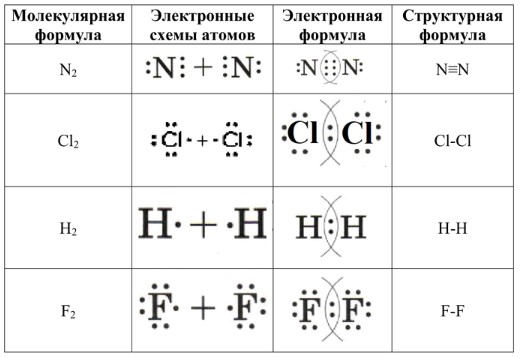
В таблице у нас четыре столбца:
1. Молекулярная формула — молекула вещества представлена с помощью химических символов. Это краткая запись того, какие атомы входят в состав вещества и в каком количестве.
2. Электронные схемы атомов — здесь показано распределение электронов в атомах, на внешнем энергетическом уровне. Это важно, потому что именно внешние электроны (или валентные электроны) участвуют в образовании химической связи.
3. Электронная формула — в этой строке изображается, как атомы обмениваются или делят электроны в процессе образования молекулы. Это дает представление о том, как электроны «обобществляются» между атомами для создания стабильной связи.
4. Структурная формула — это упрощенная форма представления молекулы, где общие электронные пары (которые участвуют в связи) обозначаются линией. Это наиболее компактная и удобная форма записи, в которой каждая линия символизирует пару общих электронов, связывающих два атома.
Теперь давайте разберемся с примерами из таблицы:
Пример 1: \(N_2\) — молекула азота
— Молекулярная формула: \(N_2\)
— Электронные схемы атомов: Атомы азота (N) имеют 5 электронов на внешнем уровне. Таким образом, каждый атом в молекуле азота будет стремиться поделиться 3 электронами с другим атомом, образуя тройную связь.
Электронная схема атомов будет выглядеть так:
Это означает, что каждый атом азота имеет по три электрона на внешнем уровне, которые они обмениваются, образуя тройную связь.
— Электронная формула: Так как атомы делят 3 пары электронов, мы можем обозначить эту связь как
— Структурная формула: Структурная формула будет записана как \(N \equiv N\), показывая, что между двумя атомами азота есть тройная связь.
Пример 2: \(Cl_2\) — молекула хлора
— Молекулярная формула: \(Cl_2\)
— Электронные схемы атомов: Хлор (Cl) имеет 7 электронов на внешнем уровне. Чтобы получить стабильную структуру, два атома хлора обмениваются по одному электрону, образуя одинарную ковалентную связь.
Электронная схема атомов будет выглядеть так:
Это показывает, что каждый атом хлора делится одним своим электроном с другим атомом хлора.
— Электронная формула: Электронная формула будет 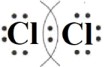
— Структурная формула: Структурная формула будет записана как \(Cl — Cl\), показывая одинарную связь между атомами хлора.
Пример 3: \(H_2\) — молекула водорода
— Молекулярная формула: \(H_2\)
— Электронные схемы атомов: Атом водорода имеет один электрон на внешнем уровне. Чтобы образовать молекулу, два атома водорода обмениваются этими электронами, создавая одну общую пару.
Электронная схема атомов будет выглядеть так:
— Электронная формула: Электронная формула будет 
— Структурная формула: Структурная формула будет также \(H — H\), показывая одинарную связь между атомами водорода.
Пример 4: \(F_2\) — молекула фтора
— Молекулярная формула: \(F_2\)
— Электронные схемы атомов: Атомы фтора имеют 7 электронов на внешнем уровне. Чтобы стать стабильными, два атома фтора делят по одному электрону, образуя одинарную связь.
Электронная схема атомов будет выглядеть так:
— Электронная формула: Электронная формула будет 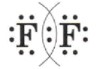
— Структурная формула: Структурная формула будет записана как \(F — F\), показывая одинарную связь между атомами фтора.
Важные моменты:
— Ковалентная связь образуется, когда два атома делят свои внешние электроны, чтобы достичь более стабильного состояния.
— Количество общих электронных пар между атомами определяет тип связи: одинарная (одна пара), двойная (две пары), тройная (три пары).
— Структурные формулы являются самым упрощённым способом изобразить молекулы, где каждая линия (или пара точек) между атомами представляет собой пару общих электронов.
Часть II
Вопрос 1
Для решения задачи «крестики-нолики» с веществами, имеющими ковалентную связь, выполним следующие шаги:
1. Классификация веществ по типу химической связи
Сначала определим тип химической связи для каждого вещества в таблице.
— Ковалентная связь образуется между атомами неметаллов путем обобществления электронов.
— Ионная связь образуется между атомами металла и неметалла путем полной передачи электронов.
Рассмотрим вещества из таблицы:
- O₂ (Кислород): Состоит из двух атомов кислорода (неметаллы). Ковалентная связь.
- K₂O (Оксид калия): Калий (металл) и кислород (неметалл). Ионная связь.
- CaO (Оксид кальция): Кальций (металл) и кислород (неметалл). Ионная связь.
- AlBr₃ (Бромид алюминия): Алюминий (металл) и бром (неметалл). Несмотря на некоторую долю ковалентности, для базовой классификации в рамках школьной программы часто рассматривается как ионная связь или связь с преобладанием ионного характера.
- CsCl (Хлорид цезия): Цезий (металл) и хлор (неметалл). Ионная связь.
- CO₂ (Углекислый газ): Углерод (неметалл) и кислород (неметалл). Ковалентная связь.
- BaCl₂ (Хлорид бария): Барий (металл) и хлор (неметалл). Ионная связь.
- NaF (Фторид натрия): Натрий (металл) и фтор (неметалл). Ионная связь.
2. Заполнение «поля» типами связи
Теперь представим таблицу, заменив вещества на тип их связи (К — ковалентная, И — ионная):
| K (O₂) | И (K₂O) | И (CaO) |
| И (AlBr₃) | И (CsCl) | K (CO₂) |
| И (BaCl₂) | И (NaF) | И (NaF) |
3. Поиск «выигрышного пути»
Для того чтобы найти «выигрышный путь» в «крестиках-ноликах», необходимо, чтобы три клетки подряд (по горизонтали, вертикали или диагонали) содержали вещества только с ковалентной связью.
Проанализируем полученную сетку:
Горизонтальные ряды:
— Ряд 1: К, И, И (нет выигрыша)
— Ряд 2: И, И, К (нет выигрыша)
— Ряд 3: И, И, И (нет выигрыша)
Вертикальные ряды:
— Столбец 1: К, И, И (нет выигрыша)
— Столбец 2: И, И, И (нет выигрыша)
— Столбец 3: И, К, И (нет выигрыша)
Диагональные ряды:
— Из верхнего левого угла: К, И, И (нет выигрыша)
— Из верхнего правого угла: И, И, И (нет выигрыша)
Вывод: В данной таблице невозможно найти «выигрышный путь» (три вещества подряд) из формул веществ, имеющих только ковалентную связь. В таблице присутствует всего два вещества с ковалентной связью (O₂ и CO₂), а для выигрышного пути необходимо минимум три.
4. Схемы образования связи для веществ с ковалентной связью, присутствующих в таблице
Хотя «выигрышный путь» не найден, мы можем показать схемы образования связи для тех веществ с ковалентной связью, которые есть в таблице, так как они являются частью задания.
1. Образование ковалентной связи в молекуле кислорода (O₂)
— Тип связи: Ковалентная неполярная.
— Атомы: Каждый атом кислорода (O) имеет 6 валентных электронов. Для достижения стабильного октета (8 электронов) каждому атому необходимо получить 2 электрона.
— Схема образования (по Льюису): Атомы кислорода образуют двойную связь, обобществляя по две пары электронов.
(Две пары электронов между атомами являются общими, образуя двойную связь. Остальные электроны на каждом атоме образуют неподеленные электронные пары.)
2. Образование ковалентной связи в молекуле углекислого газа (CO₂)
— Тип связи: Ковалентная полярная.
— Атомы: Атом углерода (C) имеет 4 валентных электрона. Каждый атом кислорода (O) имеет 6 валентных электронов. Углероду необходимо 4 электрона, каждому атому кислорода — 2 электрона.
— Схема образования (по Льюису): Атом углерода образует две двойные связи, по одной с каждым атомом кислорода.
(Каждый атом кислорода образует двойную связь с атомом углерода, обобществляя по две пары электронов. На каждом атоме кислорода остаются две неподеленные электронные пары.)
Вопрос 2
Для решения этой задачи необходимо определить тип химической связи в каждом из представленных соединений. Существуют три основных типа химических связей: ковалентная, которая образуется между атомами неметаллов путем образования общих электронных пар (может быть полярной или неполярной); ионная, возникающая между атомами металла и неметалла за счет полного перехода электронов и образования ионов; и металлическая, характерная для чистых металлов и сплавов, где электроны свободно перемещаются между положительно заряженными ионами.
Рассмотрим каждое соединение по порядку:
1. KF (Фторид калия):
Калий (K) – металл, фтор (F) – неметалл. Связь между металлом и неметаллом всегда ионная, поскольку калий отдает электрон, а фтор его принимает. Соответствующая буква – M. Это не ковалентная связь.
2. Al (Алюминий):
Алюминий (Al) – это чистый металл. Связь в чистых металлах называется металлической. Соответствующая буква – X. Это не ковалентная связь.
3. Br₂ (Бром):
Молекула брома состоит из двух одинаковых атомов неметалла (Br). В таких случаях образуется ковалентная неполярная связь, так как атомы делят электроны поровну. Соответствующая буква – C. Это ковалентная связь.
4. BaO₂ (Пероксид бария):
Барий (Ba) – металл, а кислород (O) – неметалл. Несмотря на то, что внутри пероксидного иона O₂²⁻ атомы кислорода связаны ковалентно, общая связь между ионом бария (Ba²⁺) и пероксидным ионом (O₂²⁻) является ионной. Соответствующая буква – O. Это не ковалентная связь в контексте всего соединения.
5. P₄ (Белый фосфор):
Молекула фосфора состоит из четырех одинаковых атомов неметалла (P). Между ними образуется ковалентная неполярная связь. Соответствующая буква – E. Это ковалентная связь.
6. KCl (Хлорид калия):
Калий (K) – металл, хлор (Cl) – неметалл. Аналогично KF, связь между ними ионная, так как калий отдает электрон, а хлор принимает. Соответствующая буква – H. Это не ковалентная связь.
7. O₃ (Озон):
Молекула озона состоит из трех одинаковых атомов неметалла (O). Между ними образуется ковалентная связь, которая является полярной из-за резонансных структур и углового строения молекулы, но по своей природе это ковалентная связь. Соответствующая буква – P. Это ковалентная связь.
8. Ca (Кальций):
Кальций (Ca) – это чистый металл. Связь в чистых металлах – металлическая. Соответствующая буква – И. Это не ковалентная связь.
9. S₂ (Дисульфид):
Молекула дисульфида состоит из двух одинаковых атомов неметалла (S). Между ними образуется ковалентная неполярная связь. Соответствующая буква – A. Это ковалентная связь.
Теперь выберем буквы, соответствующие соединениям с ковалентной химической связью:
— Br₂ (C)
— P₄ (E)
— O₃ (P)
— S₂ (A)
Составив слово из этих букв, получаем СЕРА.
Именно сера является одним из ключевых компонентов чёрного пороха, наряду с калиевой селитрой и древесным углем.
Вопрос 3
Для построения графика зависимости кратности химической связи от её длины, мы будем использовать данные для молекул фтора (F₂), кислорода (O₂) и азота (N₂), так как они содержат типичные одинарные, двойные и тройные связи соответственно.
1. Подготовка данных:
Сначала соберем необходимые данные о кратности связи и её длине для выбранных молекул:
Молекула фтора (F₂):
— Тип связи: Одинарная связь (F-F)
— Кратность связи: 1
— Длина связи: приблизительно 0,14 нм
Молекула кислорода (O₂):
— Тип связи: Двойная связь (O=O)
— Кратность связи: 2
— Длина связи: приблизительно 0,12 нм
Молекула азота (N₂):
— Тип связи: Тройная связь (N≡N)
— Кратность связи: 3
— Длина связи: приблизительно 0,11 нм
Сведем эти данные в таблицу для удобства:
| Молекула | Кратность связи | Длина связи, нм |
|---|---|---|
| F₂ | 1 | 0,14 |
| O₂ | 2 | 0,12 |
| N₂ | 3 | 0,11 |
2. Построение графика:
Для построения графика выполним следующие шаги:
Выбор осей:
— По оси X (горизонтальная ось) отложим длину связи в нанометрах (нм). Это независимая переменная.
— По оси Y (вертикальная ось) отложим кратность связи. Это зависимая переменная.
Определение масштаба осей:
— Для оси X (Длина связи): Значения варьируются от 0,11 до 0,14 нм. Выберем масштаб, охватывающий, например, от 0,1 до 0,16 нм, с делениями через каждые 0,02.
— Для оси Y (Кратность связи): Значения варьируются от 1 до 3. Выберем масштаб, охватывающий, например, от 0,5 до 3,5, с делениями через 0,5.
Нанесение точек:
Нанесем каждую пару значений из таблицы как точку на график:
1. Для фтора (F₂): Найдем на оси X значение 0,14 нм и поднимемся до уровня 1 на оси Y. Поставим точку с координатами (0,14; 1).
2. Для кислорода (O₂): Найдем на оси X значение 0,12 нм и поднимемся до уровня 2 на оси Y. Поставим точку с координатами (0,12; 2).
3. Для азота (N₂): Найдем на оси X значение 0,11 нм и поднимемся до уровня 3 на оси Y. Поставим точку с координатами (0,11; 3).
Соединение точек:
Соединим нанесенные точки плавной линией или отрезками. В данном случае, точки будут образовывать кривую, которая идет вниз и вправо (или вверх и влево, в зависимости от направления чтения).
Оформление графика:
— Обязательно подпишите оси: «Длина связи, нм» для оси X и «Кратность связи» для оси Y.
— При необходимости добавьте заголовок графика, например, «Зависимость кратности химической связи от её длины».
3. Анализ графика и вывод:
После построения графика мы видим следующую закономерность:
— По мере того как мы движемся по оси X влево (то есть, длина связи уменьшается), соответствующая точка на графике поднимается вверх по оси Y (то есть, кратность связи увеличивается).
— И наоборот, по мере того как мы движемся по оси X вправо (то есть, длина связи увеличивается), соответствующая точка на графике опускается вниз по оси Y (то есть, кратность связи уменьшается).
Вывод:
На основе построенного графика можно сделать вывод, что между кратностью химической связи и её длиной существует обратная зависимость: чем выше кратность химической связи, тем меньше её длина.
Химическое объяснение:
Это явление объясняется тем, что увеличение кратности связи означает увеличение количества общих электронных пар между двумя атомами. Чем больше электронных пар участвует в образовании связи, тем сильнее притяжение между ядрами атомов, что приводит к их более тесному сближению и, соответственно, к уменьшению длины связи. Тройная связь (как в N₂) является самой короткой и самой прочной, тогда как одинарная связь (как в F₂) является самой длинной и наименее прочной из этих трех типов.
Вопрос 4
Для выполнения задания и построения графика зависимости прочности химической связи от её кратности, а также для формулирования вывода, мы будем использовать стандартные примеры молекул, которые наглядно демонстрируют эту зависимость: фтор (F-F), кислород (O=O) и азот (N≡N). Эти молекулы содержат одинарные, двойные и тройные связи соответственно, что позволяет проследить изменение прочности.
1. Исходные данные:
Соберем данные о кратности и прочности связи для выбранных молекул:
| Молекула | Кратность связи | Прочность связи (энергия связи, кДж/моль) |
|---|---|---|
| F-F | 1 | 139 |
| O=O | 2 | 494 |
| N≡N | 3 | 945 |
2. Построение графика:
Для построения графика зависимости прочности химической связи от её кратности выполним следующие шаги:
— Выбор осей координат:
- Ось X (горизонтальная): Кратность связи. Это независимая переменная, так как мы исследуем, как прочность связи зависит от её кратности.
- Ось Y (вертикальная): Прочность связи, кДж/моль. Это зависимая переменная, значение которой меняется в зависимости от кратности.
— Определение масштаба осей:
- Для оси X (Кратность связи): Значения варьируются от 1 до 3. Целесообразно выбрать диапазон, например, от 0 до 4, с делениями через 1 единицу.
- Для оси Y (Прочность связи, кДж/моль): Значения варьируются от 139 до 945 кДж/моль. Выберем диапазон, например, от 0,1 до 1000,1 кДж/моль, с удобными делениями, например, через каждые 100 кДж/моль.
— Нанесение точек на график:
Нанесем каждую пару значений из таблицы как отдельную точку на координатную плоскость:
1. Для F-F: Найдем на оси X значение 1 и поднимемся до уровня 139 на оси Y. Поставим точку с координатами (1; 139).
2. Для O=O: Найдем на оси X значение 2 и поднимемся до уровня 494 на оси Y. Поставим точку с координатами (2; 494).
3. Для N≡N: Найдем на оси X значение 3 и поднимемся до уровня 945 на оси Y. Поставим точку с координатами (3; 945).
— Соединение точек:
Соединим нанесенные точки. В данном случае, точки не лежат на одной прямой, но образуют восходящую кривую, что указывает на нелинейную, но прямую зависимость.
— Оформление графика:
- Обязательно подпишите оси: «Кратность связи» для оси X и «Прочность связи, кДж/моль» для оси Y.
- Добавьте заголовок графика, например, «Зависимость прочности химической связи от её кратности».
3. Вывод:
На основе построенного графика можно сделать следующий вывод:
Между кратностью химической связи и её прочностью (энергией связи) существует прямая зависимость: чем выше кратность химической связи, тем больше её прочность.
4. Подробное объяснение:
— Наблюдение по графику:
График наглядно демонстрирует, что по мере увеличения кратности связи (переход от одинарной к двойной, а затем к тройной), значение прочности связи значительно возрастает. Точка, соответствующая тройной связи (N≡N), находится на графике значительно выше, чем точка для двойной связи (O=O), которая, в свою очередь, значительно выше, чем точка для одинарной связи (F-F).
— Химическое обоснование:
1. Что такое кратность связи? Кратность связи (или порядок связи) указывает на количество общих электронных пар, удерживающих два атома вместе:
— Одинарная связь (например, в F-F) образуется одной общей электронной парой.
— Двойная связь (например, в O=O) образуется двумя общими электронными парами.
— Тройная связь (например, в N≡N) образуется тремя общими электронными парами.
2. Что такое прочность связи (энергия связи)? Это количество энергии, которое необходимо затратить, чтобы разорвать химическую связь между двумя атомами в газообразном состоянии. Чем больше энергии требуется, тем прочнее связь.
3. Взаимосвязь: Увеличение кратности связи означает, что между атомами находится большее количество общих электронов. Эти дополнительные электронные пары усиливают электростатическое притяжение между положительно заряженными ядрами атомов и отрицательно заряженными электронами связи. В результате:
— Увеличивается сила притяжения: Атомы притягиваются друг к другу сильнее.
— Уменьшается длина связи: Атомы располагаются ближе друг к другу.
— Увеличивается энергия, необходимая для разрыва: Чтобы преодолеть это усиленное притяжение и разорвать связь, требуется значительно больше энергии.
Таким образом, тройная связь является самой прочной из-за максимального количества общих электронных пар, обеспечивающих сильное притяжение между атомами. Одинарная связь, имея только одну электронную пару, является наименее прочной. Это фундаментальный принцип в химии, объясняющий стабильность и реакционную способность многих молекул.
Вопрос 5
Представленный рисунок в стиле комиксов (мем с Человеком-пауком и Джоном Траволтой) очень наглядно и остроумно иллюстрирует процесс образования ковалентной неполярной химической связи.
Давайте подробно разберем, как элементы этого мема отражают химический процесс:
1. Два Человека-паука, указывающие друг на друга:
— Что они представляют: Каждый Человек-паук символизирует атом неметалла.
— Почему их двое и почему они одинаковые: Ковалентная неполярная связь образуется между двумя одинаковыми атомами неметаллов (например, H₂, O₂, Cl₂, F₂, N₂). Их идентичность на рисунке подчеркивает, что оба атома имеют одинаковую электроотрицательность, а значит, будут притягивать общие электроны с одинаковой силой.
— Действие «указывают друг на друга»: Это символизирует их взаимодействие и «нацеленность» на создание общей электронной пары. Они как бы «предлагают» свои электроны для образования связи.
2. Джон Траволта (Винсент Вега) в центре:
— Что он представляет: Фигура Джона Траволты, находящаяся ровно посередине между двумя Человеками-пауками, символизирует общие электронные пары.
— Его центральное положение: Это ключевой момент. В ковалентной неполярной связи электронные пары распределяются симметрично (равномерно) между двумя одинаковыми атомами. Джон Траволта находится ровно посередине, что визуально демонстрирует это равномерное распределение.
— Его выражение лица (недоумение/наблюдение): Можно интерпретировать как «сущность» или «объект» процесса, который становится общим для обеих сторон.
3. Текстовые надписи:
— «неметалл» под каждым Человеком-пауком: Это прямое указание на тип атомов, участвующих в образовании связи. Ковалентные связи (в отличие от ионных) образуются между неметаллами.
— «общие электронные пары» под Джоном Траволтой: Это прямое указание на то, что именно является «предметом» связи – электроны, которые становятся общими для обоих атомов.
Общий вывод из рисунка:
Мем прекрасно визуализирует, что два одинаковых атома неметалла (два Человека-паука) объединяются, чтобы поровну разделить (Джон Траволта в центре) свои электронные пары, формируя таким образом ковалентную неполярную химическую связь. Отсутствие «перетягивания одеяла» (т.е. неравномерного смещения электронной плотности) подчеркивается одинаковостью «участников» и центральным положением «объекта» обмена.
Это отличный пример того, как популярные культурные явления могут быть использованы для объяснения сложных научных концепций в доступной и запоминающейся форме.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.



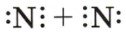

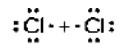
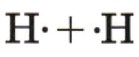
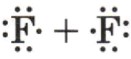
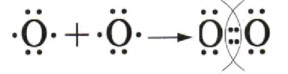
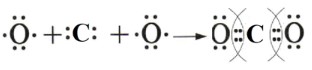



Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!