
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 44-46 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
Часть I
1. Электроотрицательность (ЭО) — это ________________________
2.
3. Если ковалентная химическая связь образуется между атомами разных элементов — _________________ , то общие электронные пары смещены в сторону более _________________ элемента. На нём возникает избыточный _________________ заряд, а на атоме-партнёре — избыточный _________________ заряд. Такая связь называется _________________ .
4. АЛГОРИТМ СОСТАВЛЕНИЯ СХЕМЫ ОБРАЗОВАНИЯ МОЛЕКУЛ СОЕДИНЕНИЯ С КОВАЛЕНТНОЙ ПОЛЯРНОЙ СВЯЗЬЮ (на примере H₂S)
1) Определите число электронов на внешнем уровне у атомов неметаллов и число неподелённых электронов по формуле 8 – N.
2) Запишите электронные схемы атомов неметаллов (элемент, представленный одним атомом, запишите в центре) через знак «•» так, чтобы неподелённые электроны были обращены к соседнему знаку.
3) Запишите электронную формулу образовавшейся молекулы, показав обобществлённые электроны между взаимодействующими атомами.
4) Запишите структурную формулу образовавшейся молекулы, обозначив каждую общую электронную пару чертой.
5) Покажите смещение электронных пар к атому (атомам) с большей ЭО, заменив чёрточки стрелками и обозначив частичные заряды.
5. Дополните таблицу «Ковалентная полярная связь».
Часть II
1. Поиграйте в «крестики-нолики». Покажите выигрышный путь, состоящий из формул веществ с ковалентной полярной связью, и запишите схемы их образования.
| Формулы веществ | Схемы образования ковалентной полярной связи | ||
|---|---|---|---|
| O₃ | H₂O | AlF₃ | |
| HBr | PCl₃ | CH₄ | |
| CaO | NaCl | Br₂ |
§10
Часть I
Вопрос 1
Электроотрицательность (ЭО) – это способность атомов химического элемента притягивать к себе общие электронные пары, которые участвуют в формировании химических связей.
Вопрос 2
Вопрос 3
Если ковалентная химическая связь образуется между атомами разных элементов-НЕМЕТАЛЛОВ, то общие электронные пары смещены в сторону более ЭЛЕКТРООТРИЦАТЕЛЬНОГО элемента. В нем возникает избыточный ОТРИЦАТЕЛЬНЫЙ заряд, а на атоме-партнере – избыточный ПОЛОЖИТЕЛЬНЫЙ заряд. Такая связь называется КОВАЛЕНТНОЙ ПОЛЯРНОЙ.
Вопрос 4
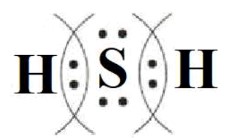
Алгоритм составления схемы образования молекул соединения с ковалентной полярной связью (на примере H2S)
1) Определите число электронов на внешнем уровне (N) у атомов неметаллов и число непарных электронов по формуле 8 – N:
H: 2 – 1 = 1
S: 8 – 6 = 2
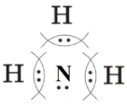
2) Запишите электронные схемы атомов неметаллов (элемент, представленный одним атомом, запишите в центре) через знак «+» так, чтобы непарные электроны были обращены к соседнему знаку:
3) Запишите электронную формулу образовавшейся молекулы, показав обобществленные электроны между взаимодействующими атомами:
4) Запишите структурную формулу образовавшейся молекулы, обозначив каждую общую электронную пару чертой:
H-S-H
5) Покажите смещение электронных пар к атому (атомам) с большей ЭО, заменив черточки стрелками и обозначив частичные заряды:
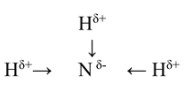
Hδ+→Sδ-←Hδ+
Вопрос 5
Ковалентная полярная связь
Часть II
Вопрос 1
§10
Часть I
Вопрос 1
Электроотрицательность (ЭО) — это фундаментальное свойство атомов химического элемента, которое характеризует их способность притягивать к себе общие электронные пары в ковалентной связи. Иными словами, это мера «жадности» атома к электронам, когда он находится в составе молекулы и образует связь с другим атомом.
Когда два атома образуют ковалентную связь, они делят между собой электроны. Если атомы имеют разную электроотрицательность, то более электроотрицательный атом будет сильнее притягивать общую электронную пару к себе. Это приводит к неравномерному распределению электронной плотности в связи:
— Более электроотрицательный атом приобретает частичный отрицательный заряд, обозначаемый как δ- (дельта минус), поскольку электронная плотность смещается к нему.
— Менее электроотрицательный атом приобретает частичный положительный заряд, обозначаемый как δ+ (дельта плюс), поскольку электронная плотность от него оттягивается.
Такая связь называется полярной ковалентной связью. Чем больше разница в электроотрицательности между двумя связанными атомами, тем более полярной будет связь. Если разница очень велика, связь может стать ионной, где электроны практически полностью переходят от одного атома к другому.
Электроотрицательность не является фиксированной величиной для атома, она зависит от его окружения в молекуле, но существуют общепринятые шкалы (например, шкала Полинга, шкала Малликена), которые позволяют численно оценить это свойство.
На периодической таблице электроотрицательность имеет следующие тенденции:
— Увеличивается по периоду слева направо: Это связано с увеличением заряда ядра и уменьшением радиуса атома, что усиливает притяжение электронов.
— Уменьшается по группе сверху вниз: Это объясняется увеличением числа электронных оболочек и, как следствие, увеличением радиуса атома и экранирования внешних электронов внутренними, что ослабляет притяжение ядра к внешним электронам.
Наиболее электроотрицательным элементом является фтор (F), а наименее электроотрицательными — щелочные и щелочноземельные металлы. Понимание электроотрицательности крайне важно для предсказания полярности химических связей, формы молекул, их физических (например, температуры кипения) и химических свойств (например, реакционной способности).
Вопрос 2
Электроотрицательность — это способность атома химического элемента притягивать общие электроны при образовании химической связи. Эта характеристика изменяется в зависимости от положения элемента в периодической таблице.
1. Изменение электроотрицательности по периоду (слева направо):
— Когда мы движемся по периоду слева направо, электроотрицательность увеличивается.
— Это происходит потому, что атомы, двигаясь вправо по периоду, имеют больше протонов в ядре, что усиливает положительный заряд ядра и делает атом более «затягивающим» для общих электронов.
— Также увеличивается эффективный заряд, что приводит к уменьшению атомного радиуса, а значит, внешние электроны становятся более тесно связанными с ядром, что способствует повышению электроотрицательности.
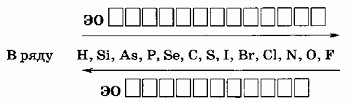
— Например, в ряду элементов \(\text{H, Si, As, P, Se, C, S, I, Br, Cl, N, O, F}\), электроотрицательность увеличивается от водорода (H) к фтору (F), так как фтор имеет больше протонов в ядре и более сильно притягивает электроны.
2. Изменение электроотрицательности по группе (сверху вниз):
— Когда мы движемся по группе сверху вниз, электроотрицательность уменьшается.
— Это происходит, потому что с увеличением числа электронных оболочек (или с увеличением атомного радиуса) электроны на внешней оболочке находятся дальше от ядра, и эффект экранирования (влияние внутренних электронов на внешние) ослабляет притяжение внешних электронов.
— В результате атомы становятся менее способными притягивать электроны в химической связи.
— Например, в группе галогенов (например, от фтора (F) к йоду (I)) электроотрицательность уменьшается, так как атомы с увеличением радиуса становятся менее эффективными в притяжении электронов.
Таким образом, электроотрицательность увеличивается по периоду слева направо и уменьшается по группе сверху вниз.
Вопрос 3
1. «Если ковалентная химическая связь образуется между атомами разных элементов — НЕМЕТАЛЛОВ…»
— «Почему «неметаллов»?» Ковалентная связь (когда атомы делят общие электронные пары) преимущественно образуется между атомами неметаллических элементов. Металлы, как правило, имеют низкую электроотрицательность и склонны отдавать электроны, образуя ионные связи с неметаллами. Если же связь образуется между разными неметаллами, то их электроотрицательности, скорее всего, будут отличаться, что и приведет к полярности.
2. «…то общие электронные пары смещены в сторону более ЭЛЕКТРООТРИЦАТЕЛЬНОГО элемента.»
— «Почему «электроотрицательного»?» Это прямое определение электроотрицательности. Электроотрицательность — это способность атома притягивать к себе общие электронные пары в химической связи. Атом с более высокой электроотрицательностью будет «жаднее» к электронам и сильнее притягивать их к себе, смещая электронную плотность в свою сторону.
3. «На нём возникает избыточный ОТРИЦАТЕЛЬНЫЙ заряд…»
— «Почему «отрицательный»?» Электроны несут отрицательный заряд. Когда общие электронные пары смещаются к более электроотрицательному атому, вокруг него концентрируется больше отрицательного заряда, чем было бы при равномерном распределении. Это приводит к возникновению частичного отрицательного заряда (обозначается δ-), так как электрон не перешел полностью, а лишь сместился.
4. «…а на атоме-партнёре — избыточный ПОЛОЖИТЕЛЬНЫЙ заряд.»
— «Почему «положительный»?» Соответственно, атом, от которого электроны сместились, теряет часть своей электронной плотности. Хотя он не отдал электрон полностью, он становится относительно «беднее» электронами, что приводит к возникновению частичного положительного заряда (обозначается δ+).
5. «Такая связь называется КОВАЛЕНТНОЙ ПОЛЯРНОЙ.»
— «Почему «ковалентной полярной»?»
- Ковалентная: Потому что электроны по-прежнему делятся между атомами, а не полностью передаются от одного к другому (как в ионной связи).
- Полярная: Потому что произошло разделение зарядов (полюсов) внутри связи. Один конец связи стал частично отрицательным, а другой — частично положительным. Это создает диполь (два полюса) в молекуле.
Итог: Полярная ковалентная связь возникает между двумя разными неметаллическими атомами, когда есть существенная разница в их электроотрицательности. Более электроотрицательный атом «перетягивает» электронную плотность на себя, становясь частично отрицательным, а менее электроотрицательный атом становится частично положительным.
Вопрос 4
Данный алгоритм подробно описывает шаги по составлению схемы образования молекул с ковалентной полярной связью, используя в качестве примера молекулу сероводорода (H₂S).
1. Определите число электронов на внешнем уровне (N) у атомов неметаллов и число непарных электронов по формуле 8 – N.
Цель этого шага:
Определить, сколько валентных электронов (электронов на внешнем энергетическом уровне) есть у каждого атома и сколько из них являются «непарными», то есть способными образовывать химические связи.
Как это сделать:
Число валентных электронов (N): Для элементов главных подгрупп (которые обычно образуют ковалентные связи), число электронов на внешнем уровне равно номеру группы в периодической таблице.
Водород (H): Находится в I группе, значит, имеет 1 валентный электрон (N=1).
Сера (S): Находится в VI группе, значит, имеет 6 валентных электронов (N=6).
Число непарных электронов (или электронов, необходимых для завершения октета/дублета):
Формула 8 – N используется для неметаллов (кроме водорода и гелия) для определения, сколько электронов им не хватает до стабильного октета (8 электронов на внешнем уровне). Это число часто соответствует числу непарных электронов, которые могут участвовать в образовании связей.
Для Водорода (H):
Водород стремится к дублету (2 электрона, как у гелия). У него 1 валентный электрон, значит, ему нужен еще 1 электрон для завершения дублета. Он имеет 1 непарный электрон.
Для Серы (S):
У серы 6 валентных электронов. По формуле 8 – N получаем 8 – 6 = 2. Это означает, что сере не хватает 2 электронов для октета, и она имеет 2 непарных электрона, способных образовать связи.
2. Запишите электронные схемы атомов неметаллов (элемент, представленный одним атомом, запишите в центре) через знак «+» так, чтобы непарные электроны были обращены к соседнему знаку.
Цель этого шага:
Визуально представить валентные электроны каждого атома и подготовить их к образованию связей.
Как это сделать:
Используются точечные структуры Льюиса. Символ элемента представляет ядро и внутренние электроны, а точки вокруг символа – валентные электроны.
Центральный атом: Элемент, который образует наибольшее количество связей (или является наименее электроотрицательным из тех, что могут быть центральными), помещается в центр. В H₂S это сера.
H·: Водород имеет 1 валентный электрон, обозначается одной точкой.
·S·: Сера имеет 6 валентных электронов. Два из них будут непарными (по одной точке), а остальные четыре образуют две неподеленные электронные пары (по две точки). Непарные электроны располагаются так, чтобы «смотреть» в сторону атомов, с которыми они будут связываться.
Схема взаимодействия:
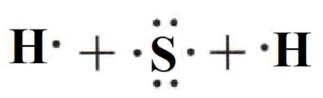
3. Запишите электронную формулу образовавшейся молекулы, показав обобществлённые электроны между взаимодействующими атомами.
Цель этого шага:
Показать, как атомы делят электроны для образования ковалентных связей.
Как это сделать:
Непарные электроны от разных атомов объединяются, образуя общие электронные пары. Эти пары располагаются между символами связанных атомов.
Каждый атом водорода предоставляет 1 электрон, а атом серы предоставляет по 1 электрону каждому атому водорода. Таким образом, между H и S образуется по одной общей электронной паре.
Неподеленные электронные пары: У серы остаются две неподеленные электронные пары (по две точки сверху и снизу от S), которые не участвуют в образовании связей, но являются частью электронной оболочки атома серы.
4. Запишите структурную формулу образовавшейся молекулы, обозначив каждую общую электронную пару чертой.
Цель этого шага:
Упростить электронную формулу, используя общепринятые обозначения для ковалентных связей.
Как это сделать:
Каждая общая электронная пара (две точки между атомами) заменяется на одну черту.
H-S-H: Это показывает, что атом серы связан с двумя атомами водорода одинарными ковалентными связями. Неподеленные электронные пары обычно не показываются в простой структурной формуле, но подразумеваются.
5. Покажите смещение электронных пар к атому (атомам) с большей ЭО, заменив чёрточки стрелками и обозначив частичные заряды.
Цель этого шага:
Продемонстрировать полярность ковалентных связей в молекуле.
Как это сделать:
Электроотрицательность (ЭО): Сравните электроотрицательность атомов, образующих связь. Электроотрицательность серы (приблизительно 2.58 по Полингу) выше, чем электроотрицательность водорода (приблизительно 2.20).
Смещение электронных пар: Поскольку сера более электроотрицательна, она сильнее притягивает общие электронные пары в связях H-S. Это смещение обозначается стрелками, которые начинаются от менее электроотрицательного атома (H) и указывают на более электроотрицательный атом (S).
Частичные заряды:
Атом, к которому смещается электронная плотность (сера), приобретает частичный отрицательный заряд (обозначается δ-).
Атом, от которого смещается электронная плотность (водород), приобретает частичный положительный заряд (обозначается δ+).
Hδ+→Sδ-←Hδ+: Эта запись показывает, что каждый атом водорода несет частичный положительный заряд, а атом серы – частичный отрицательный заряд. Стрелки указывают направление смещения электронной плотности.
Таким образом, этот алгоритм позволяет последовательно построить представление молекулы, начиная от атомного уровня и заканчивая демонстрацией распределения электронной плотности в полярных связях.
Вопрос 5
Для дополнения таблицы «Ковалентная полярная связь» мы подробно рассмотрим каждую молекулу, заполняя все ячейки на основе принципов химической связи.
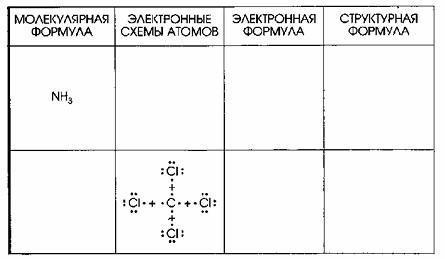
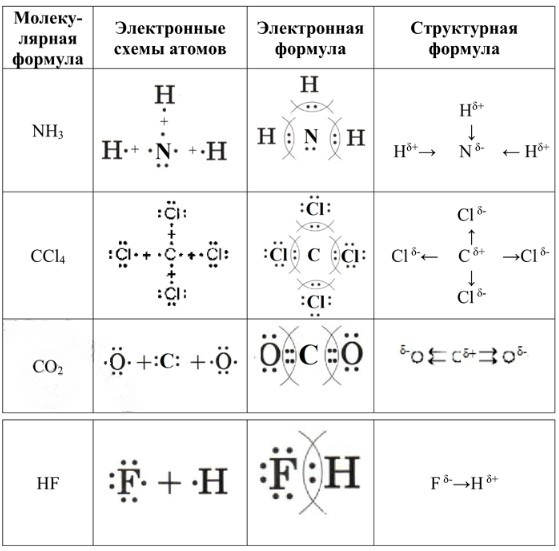
1. Молекула NH₃ (Аммиак)
Молекулярная формула аммиака – NH₃, что указывает на наличие одного атома азота и трех атомов водорода. Электронные схемы атомов показывают, что атом азота (N), находясь в V группе, имеет 5 валентных электронов: 3 непарных электрона, готовых к образованию связей, и 1 неподеленную электронную пару. Каждый атом водорода (H) имеет по 1 валентному электрону, также непарному. Эти схемы демонстрируют готовность атомов к образованию ковалентных связей.
Электронная формула (структура Льюиса) аммиака выглядит как
Здесь три общие электронные пары образуют одинарные ковалентные связи между азотом и каждым из трех атомов водорода, а одна неподеленная электронная пара остается на атоме азота. Таким образом, каждый атом водорода достигает стабильного дублета (2 электрона), а атом азота – стабильного октета (8 электронов) на внешнем энергетическом уровне.
Структурная формула аммиака отражает смещение электронной плотности:
Азот (электроотрицательность ≈ 3.04) более электроотрицателен, чем водород (электроотрицательность ≈ 2.20). Это приводит к смещению электронных пар в связях N-H в сторону атома азота. В результате, атом азота приобретает частичный отрицательный заряд (Nδ-), а каждый атом водорода – частичный положительный заряд (Hδ+). Стрелки на структурной формуле указывают направление этого смещения электронной плотности.
2. Молекула CCl₄ (Тетрахлорметан)
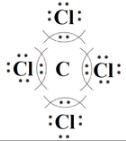
Тетрахлорметан имеет молекулярную формулу CCl₄, состоящую из одного атома углерода и четырех атомов хлора. Электронные схемы атомов показывают, что центральный атом углерода (C) имеет 4 валентных электрона, все из которых непарные и готовы к образованию связей. Каждый атом хлора (Cl), находясь в VII группе, обладает 7 валентными электронами: 1 непарным электроном для связи и 3 неподеленными электронными парами. Эта конфигурация позволяет углероду образовать связи с четырьмя атомами хлора.
Электронная формула CCl₄ изображается как:
Здесь четыре одинарные ковалентные связи C-Cl образованы общими электронными парами, а каждый атом хлора сохраняет три свои неподеленные электронные пары. В результате, как углерод, так и каждый атом хлора достигают стабильного октета.
Структурная формула тетрахлорметана:
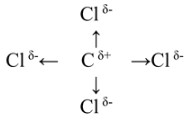
Хлор (электроотрицательность ≈ 3.16) более электроотрицателен, чем углерод (электроотрицательность ≈ 2.55). Это приводит к смещению электронной плотности в каждой связи C-Cl от атома углерода к соответствующему атому хлора. Следовательно, атом углерода приобретает частичный положительный заряд (Cδ+), а каждый атом хлора – частичный отрицательный заряд (Clδ-). Стрелки на формуле указывают направление этого смещения.
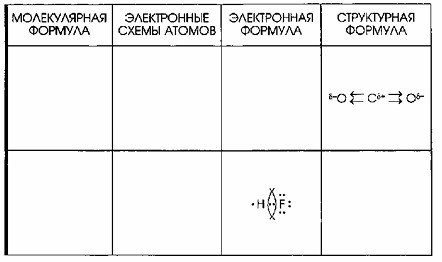
3. Молекула CO₂ (Углекислый газ)
Молекулярная формула углекислого газа – CO₂, что означает один атом углерода, связанный с двумя атомами кислорода. Электронные схемы атомов показывают, что углерод (C) имеет 4 валентных электрона, все непарные, а кислород (O) имеет 6 валентных электронов (2 непарных и 2 неподеленные электронные пары). Это позволяет углероду образовать двойные связи с каждым атомом кислорода.
Электронная формула CO₂ представлена как
Здесь две двойные ковалентные связи, каждая из которых состоит из двух общих электронных пар, образуются между углеродом и каждым атомом кислорода. На каждом атоме кислорода также остаются по две неподеленные электронные пары. Таким образом, и углерод, и кислород достигают стабильного октета.
Структурная формула:
Кислород (электроотрицательность ≈ 3.44) значительно более электроотрицателен, чем углерод (электроотрицательность ≈ 2.55). Это вызывает сильное смещение электронной плотности в обеих двойных связях C=O в сторону атомов кислорода. В результате, атом углерода приобретает частичный положительный заряд (Cδ+), а каждый атом кислорода – частичный отрицательный заряд (Oδ-). Две параллельные стрелки символизируют смещение двух пар электронов в каждой двойной связи.
4. Молекула HF (Фтороводород)
Фтороводород имеет молекулярную формулу HF, состоящую из одного атома водорода и одного атома фтора. Электронные схемы атомов показывают, что фтор (F) имеет 7 валентных электронов (1 непарный и 3 неподеленные электронные пары), а водород (H) имеет 1 непарный валентный электрон. Эта конфигурация позволяет им образовать одну общую электронную пару.
Электронная формула HF изображается как
Здесь одна общая электронная пара формирует одинарную ковалентную связь H-F, а на атоме фтора остаются три неподеленные электронные пары. Водород достигает стабильного дублета, а фтор – октета.
Структурная формула Fδ- → Hδ+. Фтор (электроотрицательность ≈ 3.98) является наиболее электроотрицательным элементом и значительно превосходит водород (электроотрицательность ≈ 2.20) по этому показателю. Это приводит к очень сильному смещению электронной плотности в связи H-F от атома водорода к атому фтора. Вследствие этого, атом водорода приобретает частичный положительный заряд (Hδ+), а атом фтора – частичный отрицательный заряд (Fδ-). Стрелка на формуле четко указывает направление этого смещения.
Часть II
Вопрос 1
Для начала давайте разберемся что такое ковалентная полярная связь.
Ковалентная полярная связь образуется между атомами разных химических элементов, когда они делят общие электронные пары. Однако, из-за различий в электроотрицательности (способности атома притягивать электроны в химической связи), общие электронные пары смещаются к более электроотрицательному атому. Это приводит к частичному отрицательному заряду (δ-) на более электроотрицательном атоме и частичному положительному заряду (δ+) на менее электроотрицательном атоме.
Цель игры «крестики-нолики» — найти ряд (горизонтальный, вертикальный или диагональный) из веществ, которые образуют ковалентную полярную связь.
Давайте рассмотрим каждое вещество в таблице:
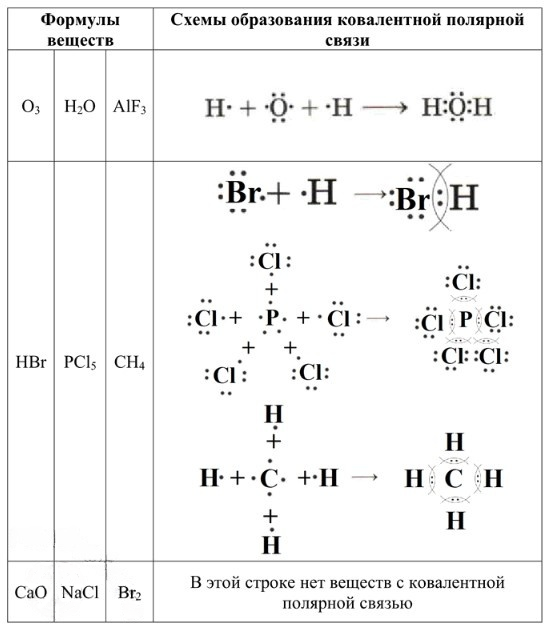
Первая строка:
— O₃ (Озон): Образован тремя атомами кислорода. Поскольку атомы одинаковые, разница в электроотрицательности отсутствует. Связь между одинаковыми атомами — ковалентная неполярная.
— H₂O (Вода): Образована атомами водорода (H) и кислорода (O). Кислород значительно более электроотрицателен, чем водород. Электронные пары смещаются к кислороду. Это ковалентная полярная связь.
— AlF₃ (Фторид алюминия): Образован атомами алюминия (Al) и фтора (F). Фтор — самый электроотрицательный элемент, а алюминий — металл. Разница в электроотрицательности очень велика, что приводит к полному переходу электронов от Al к F. Это ионная связь.
Вторая строка (наш выигрышный путь):
— HBr (Бромоводород): Образован атомами водорода (H) и брома (Br). Бром более электроотрицателен, чем водород. Электронная пара смещается к брому. Это ковалентная полярная связь.
— PCl₅ (Пентахлорид фосфора): Образован атомами фосфора (P) и хлора (Cl). Хлор более электроотрицателен, чем фосфор. Электронные пары смещаются к хлору. Это ковалентная полярная связь.
— CH₄ (Метан): Образован атомами углерода (C) и водорода (H). Углерод немного более электроотрицателен, чем водород (или их электроотрицательности очень близки, но все же есть небольшая разница, достаточная для образования полярной связи). Электронные пары смещаются к углероду. Это ковалентная полярная связь.
Третья строка:
— CaO (Оксид кальция): Образован атомами кальция (Ca) — металла, и кислорода (O) — неметалла. Большая разница в электроотрицательности. Это ионная связь.
— NaCl (Хлорид натрия): Образован атомами натрия (Na) — металла, и хлора (Cl) — неметалла. Большая разница в электроотрицательности. Это ионная связь.
— Br₂ (Бром): Образован двумя атомами брома. Атомы одинаковые, разница в электроотрицательности отсутствует. Связь между одинаковыми атомами — ковалентная неполярная.
Таким образом, единственная строка, полностью состоящая из веществ с ковалентной полярной связью, это вторая строка: HBr, PCl₅, CH₄.
Схемы образования связей показывают, как атомы делят свои внешние (валентные) электроны для достижения стабильной электронной конфигурации (обычно октета, то есть 8 электронов на внешнем уровне, или дублета для водорода — 2 электрона).
1. H₂O (Вода)
— Тип связи: Ковалентная полярная.
— Атомы: Кислород (O) имеет 6 валентных электронов. Каждый атом водорода (H) имеет 1 валентный электрон.
— Образование связи: Атом кислорода образует две ковалентные связи с двумя атомами водорода. Кислород значительно более электроотрицателен, чем водород, поэтому электронные пары смещаются к атому кислорода.
— Схема:
2. HBr (Бромоводород)
— Тип связи: Ковалентная полярная.
— Атомы: Водород (H) имеет 1 валентный электрон. Бром (Br) имеет 7 валентных электронов.
— Образование связи: Атом водорода и атом брома делят одну пару электронов. Бром более электроотрицателен, чем водород, поэтому электронная пара смещается к брому.
— Схема:
3. PCl₅ (Пентахлорид фосфора)
— Тип связи: Ковалентная полярная.
— Атомы: Фосфор (P) имеет 5 валентных электронов. Каждый атом хлора (Cl) имеет 7 валентных электронов.
— Образование связи: Атом фосфора образует пять ковалентных связей с пятью атомами хлора. Хлор более электроотрицателен, чем фосфор, поэтому электронные пары смещаются к хлору. Фосфор расширяет свой октет.
— Схема:
4. CH₄ (Метан)
— Тип связи: Ковалентная полярная.
— Атомы: Углерод (C) имеет 4 валентных электрона (·C·). Каждый атом водорода (H) имеет 1 валентный электрон (H·).
— Образование связи: Атом углерода образует четыре ковалентные связи с четырьмя атомами водорода. Углерод немного более электроотрицателен, чем водород, поэтому электронные пары смещаются к углероду.
— Схема:

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.




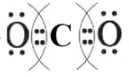
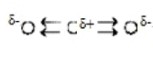

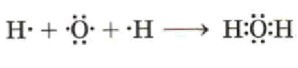
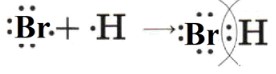
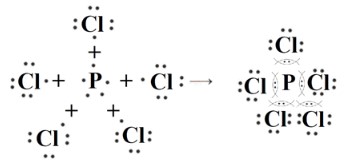
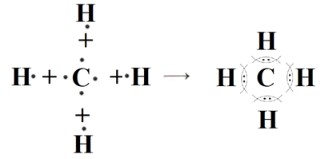



Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!