
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 50-51 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
Часть II
1. Установите соответствие между типом химической связи и формулами веществ. Из букв, соответствующих правильным ответам, вы составите название первого металлического сплава, который использовал человек: ☐☐☐☐☐☐
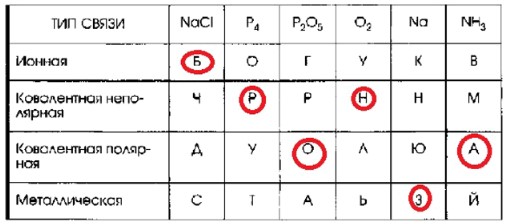
| ТИП СВЯЗИ | NaCl | P₄ | P₂O₅ | O₂ | Na | NH₃ |
|---|---|---|---|---|---|---|
| Ионная | Б | О | Г | У | К | В |
| Ковалентная неполярная | Ч | Р | Р | Н | Н | М |
| Ковалентная полярная | А | У | О | Л | Ю | А |
| Металлическая | С | Т | А | Ь | З | Й |
2. Из ряда формул веществ:
Cl₂, CaCl₂, H₂, CO₂, NH₃, AlCl₃, BaF₂, F₂ —
выберите те, которые соответствуют электронной формуле вещества, представленной в общем виде.
3. Напишите формулы веществ, образованных элементами 2-го периода с помощью всех типов химической связи.
1) ________________
2) ________________
3) ________________
4) ________________
Запишите схемы образования веществ с ионной и ковалентной полярной химической связью.
1) ________________
2) ________________
3)________________
4. Исключите «лишнее».
1) Na, Al, Si, Ca
2) HCl, H₂O, NH₃, H₂
3) SCl₂, CaCl₂, MgCl₂, KCl
5. Верны ли следующие утверждения?
А. Природа любой химической связи электростатическая.
Б. В одном веществе может быть только один вид химической связи.
1) оба суждения верны
2) верно только А
3) верно только Б
4) оба суждения неверны
6. Между атомами элементов с порядковыми номерами 11 и 9 образуется химическая связь:
1) ионная
2) металлическая
3) ковалентная полярная
4) ковалентная неполярная
7. Верны ли следующие суждения?
А. Химический элемент кальций образует вещества, в которых наблюдаются все типы химических связей.
Б. Вещество кальций Са и нитрид кальция Ca₃N₂ образованы соответственно с помощью металлической и ковалентной неполярной связей.
1) оба суждения верны
2) верно только А
3) верно только Б
4) оба суждения неверны
Часть II
Вопрос 1
Название первого металлического сплава, который использовал человек: БРОНЗА.
Вопрос 2
Вопрос 3
1. Ионная: BeO
2. Ковалентная неполярная: O₂
3. Ковалентная полярная: F₂O
4. Металлическая: Li
1. Ионная: 2Be + O₂ → 2Be²⁺ + 2O²⁻
Ковалентная полярная:
Вопрос 4
1) Na, Al, Si, Ca
Кремний является единственным неметаллом.
2) HCl, H₂O, NH₃, H₂
Все представленные вещества с ковалентной связью, а у водорода она неполярная
3) SCl₂, CaCl₂, MgCl₂, KCl
Все соединения с ионной связью, за исключением SCl₂ (которое имеет полярную ковалентную связь).
Вопрос 5
А. Природа любой химической связи электростатическая.
Верно. В ионной связи положительные ионы притягиваются к отрицательным, в ковалентной и металлической связи — положительные ядра атомов притягиваются к общим электронам.
Б. В одном веществе может быть только один вид химической связи.
Неверно. В разных веществах возможно сочетание различных атомов или ионов, поэтому связи могут быть разными.
Верно только А.
Ответ: 2.
Вопрос 6
Элемент №11 – натрий, элемент №9 – фтор. Металл и неметалл образуют ионное соединение фторид натрия Na⁺F⁻.
Ответ: 1.
Вопрос 7
А. Химический элемент кальций образует вещества, в которых наблюдаются все типы химических связей.
Неверно. Кальций не может образовать вещества с ковалентной связью.
Б. Вещество кальций Са и нитрид кальция Ca₃N₂ образованы соответственно с помощью металлической и ковалентной неполярной связей.
Неверно. Нитрид кальция образован ионной связью.
Оба суждения неверны.
Ответ: 4.
Часть II
Вопрос 1
Рассмотрим каждое вещество:
1. NaCl (Хлорид натрия):
— Натрий (Na) — это металл.
— Хлор (Cl) — это неметалл.
— Связь между металлом и неметаллом является ионной.
— В таблице для NaCl в строке «Ионная» находится буква Б.
2. P₄ (Белый фосфор):
— Фосфор (P) — это неметалл.
— Молекула состоит из одинаковых атомов неметалла.
— Связь между одинаковыми атомами неметаллов является ковалентной неполярной.
— В таблице для P₄ в строке «Ковалентная неполярная» находится буква Р.
3. P₂O₅ (Оксид фосфора(V)):
— Фосфор (P) — это неметалл.
— Кислород (O) — это неметалл.
— Связь между разными атомами неметаллов является ковалентной полярной.
— В таблице для P₂O₅ в строке «Ковалентная полярная» находится буква О.
4. O₂ (Кислород):
— Кислород (O) — это неметалл.
— Молекула состоит из одинаковых атомов неметалла.
— Связь между одинаковыми атомами неметаллов является ковалентной неполярной.
— В таблице для O₂ в строке «Ковалентная неполярная» находится буква Н.
5. Na (Натрий):
— Натрий (Na) — это чистый металл.
— Связь в чистых металлах является металлической.
— В таблице для Na в строке «Металлическая» находится буква З.
6. NH₃ (Аммиак):
— Азот (N) — это неметалл.
— Водород (H) — это неметалл.
— Связь между разными атомами неметаллов является ковалентной полярной.
— В таблице для NH₃ в строке «Ковалентная полярная» находится буква А.
Собираем полученные буквы в порядке их появления в таблице (слева направо, сверху вниз по столбцам веществ):
- NaCl → Б
- P₄ → Р
- P₂O₅ → О
- O₂ → Н
- Na → З
- NH₃ → А
Объединив эти буквы, получаем слово: БРОНЗА.
Таким образом, название первого металлического сплава, который использовал человек, БРОНЗА.
Вопрос 2
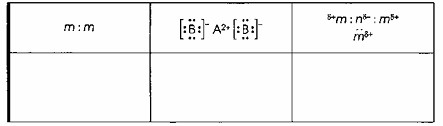
Для классификации представленных веществ необходимо определить тип химической связи, характерный для каждого из них, и соотнести его с общими формулами и примерами, показанными в таблице.
Рассмотрим каждый столбец таблицы и соответствующий ему тип связи:
— Столбец 1: Общая формула m:m (или m-m).
Эта запись символизирует общую пару электронов между двумя одинаковыми атомами. Это характерно для ковалентной неполярной связи, которая образуется между атомами одного и того же неметаллического элемента.
— Столбец 2: Общая формула [:B:]⁻ A²⁺ [:B:]⁻.
Эта запись показывает наличие катиона A²⁺ (положительно заряженного иона) и анионов [:B:]⁻ (отрицательно заряженных ионов). Это указывает на ионную связь, которая образуется в результате электростатического притяжения между противоположно заряженными ионами, обычно между атомами металла и неметалла.
— Столбец 3: Общая формула δ+m : nδ- : mδ+ и mδ+.
Символы δ+ и δ- обозначают частичные положительные и отрицательные заряды на атомах, что является признаком неравномерного распределения электронной плотности в общей электронной паре. Это характерно для ковалентной полярной связи, которая образуется между атомами разных неметаллических элементов с различной электроотрицательностью.
Теперь классифицируем каждое вещество из заданного ряда: Cl₂, CaCl₂, H₂, CO₂, NH₃, AlCl₃, BaF₂, F₂.
1. Cl₂ (Хлор):
— Состоит из двух одинаковых атомов неметалла (Cl).
— Тип связи: ковалентная неполярная.
— Соответствует Столбцу 1.
2. CaCl₂ (Хлорид кальция):
— Состоит из атома металла (Ca) и атомов неметалла (Cl).
— Тип связи: ионная.
— Соответствует Столбцу 2.
3. H₂ (Водород):
— Состоит из двух одинаковых атомов неметалла (H).
— Тип связи: ковалентная неполярная.
— Соответствует Столбцу 1.
4. CO₂ (Углекислый газ):
— Состоит из атомов разных неметаллов (C и O). Кислород более электроотрицателен, чем углерод.
— Тип связи: ковалентная полярная (связи C=O полярны).
— Соответствует Столбцу 3.
5. NH₃ (Аммиак):
— Состоит из атомов разных неметаллов (N и H). Азот более электроотрицателен, чем водород.
— Тип связи: ковалентная полярная.
— Соответствует Столбцу 3.
6. AlCl₃ (Хлорид алюминия):
— Состоит из атома металла (Al) и атомов неметалла (Cl).
— Несмотря на наличие некоторой ковалентной составляющей, в рамках общей классификации соединений металла и неметалла, эта связь считается преимущественно ионной.
— Тип связи: ионная.
— Соответствует Столбцу 2.
7. BaF₂ (Фторид бария):
— Состоит из атома металла (Ba) и атомов неметалла (F).
— Тип связи: ионная.
— Соответствует Столбцу 2.
8. F₂ (Фтор):
— Состоит из двух одинаковых атомов неметалла (F).
— Тип связи: ковалентная неполярная.
— Соответствует Столбцу 1.
Таким образом, заполненная таблица будет выглядеть следующим образом:
Вопрос 3
Формулы веществ, образованных элементами 2-го периода с помощью всех типов химической связи:
Элементы 2-го периода: Li, Be, B, C, N, O, F, Ne.
1. Ионная связь:
— BeO (оксид бериллия)
— Образуется между металлом (Be) и неметаллом (O) с большой разницей в электроотрицательности.
2. Ковалентная неполярная связь:
— O₂ (молекулярный кислород)
— Образуется между атомами одного и того же неметалла (кислорода), где электроотрицательность одинакова, и общие электронные пары не смещаются.
3. Ковалентная полярная связь:
— F₂O (дифторид кислорода)
— Образуется между атомами разных неметаллов (фтора и кислорода) с разной, но не очень большой разницей в электроотрицательности. Общие электронные пары смещаются к более электроотрицательному атому (фтору).
4. Металлическая связь:
— Li (литий)
— Образуется в кристалле металла между атомами металла (лития) за счет обобществленных валентных электронов, свободно перемещающихся по всей кристаллической решетке.
Схемы образования веществ:
1. Ионная связь: Оксид бериллия (BeO)
Принцип: Ионная связь возникает при полном переносе электронов от атома металла к атому неметалла, что приводит к образованию ионов с противоположными зарядами, которые затем притягиваются друг к другу.
Подробное объяснение:
— Атом бериллия (Be): Находится во 2-й группе, имеет 2 валентных электрона (электронная конфигурация \(1s²2s²\)). Для достижения стабильной электронной конфигурации инертного газа (гелия, \(1s²\)) атому бериллия выгодно отдать эти 2 электрона. При этом он превращается в положительно заряженный ион — катион \(Be²⁺\).
— Атом кислорода (O): Находится в 16-й группе, имеет 6 валентных электронов (электронная конфигурация \(1s²2s²2p⁴\)). Для достижения стабильной электронной конфигурации инертного газа (неона, \(1s²2s²2p⁶\)) атому кислорода выгодно принять 2 электрона. При этом он превращается в отрицательно заряженный ион — анион \(O²⁻\).
— Образование BeO: Когда атомы бериллия и кислорода взаимодействуют, каждый атом бериллия отдает 2 электрона, а каждый атом кислорода принимает 2 электрона. Образовавшиеся ионы \(Be²⁺\) и \(O²⁻\) притягиваются друг к другу электростатическими силами, формируя ионное соединение \(BeO\).
Схема реакции:
\(2Be + O₂ → 2Be²⁺ + 2O²⁻\)
(Эта запись показывает, что два атома бериллия отдают в сумме 4 электрона, которые принимаются одной молекулой кислорода (состоящей из двух атомов), образуя два иона \(O²⁻\).)
2. Ковалентная полярная связь: Дифторид кислорода (F₂O)
Принцип: Ковалентная связь образуется путем образования общих электронных пар между атомами неметаллов. Если атомы имеют разную электроотрицательность, общая электронная пара смещается к более электроотрицательному атому, делая связь полярной.
Подробное объяснение:
— Атом кислорода (O): Имеет 6 валентных электронов. Для достижения стабильного октета ему не хватает 2 электронов. У него есть два неспаренных электрона, которые могут образовывать связи.
— Атом фтора (F): Имеет 7 валентных электронов. Для достижения стабильного октета ему не хватает 1 электрона. У него есть один неспаренный электрон. Фтор является самым электроотрицательным элементом.
— Образование F₂O: В молекуле \(F₂O\) атом кислорода является центральным, а два атома фтора присоединяются к нему. Каждый атом фтора делится своим неспаренным электроном с одним из неспаренных электронов атома кислорода, образуя две одинарные ковалентные связи (F-O-F).
— Полярность: Поскольку фтор значительно более электроотрицателен, чем кислород, общие электронные пары в связях \(O-F\) смещаются к атомам фтора. Это приводит к частичному отрицательному заряду (\(\delta-\)) на атомах фтора и частичному положительному заряду (\(\delta+\)) на атоме кислорода, делая связи \(O-F\) ковалентными полярными.
Схема образования:
— Слева показаны атомы с их валентными электронами:
: Атом фтора с тремя неподеленными электронными парами и одним неспаренным электроном (обозначен точкой).
: Атом кислорода с двумя неподеленными электронными парами и двумя неспаренными электронами (обозначены точками).
-
: Второй атом фтора.
— Справа показана образовавшаяся молекула \(F₂O\):
-
: Каждая пара точек между F и O представляет собой общую электронную пару (ковалентную связь). Атомы F и O достигают октета (8 электронов на внешнем уровне, включая общие пары). Круги вокруг общих пар подчеркивают, что эти электроны принадлежат обоим атомам.
3. Ковалентная полярная связь: Углекислый газ (CO₂)
Принцип: Аналогично \(F₂O\), связь ковалентная полярная, но здесь образуются двойные связи.
Подробное объяснение:
— Атом кислорода (O): Имеет 6 валентных электронов. Для достижения октета ему не хватает 2 электронов.
— Атом углерода (C): Имеет 4 валентных электрона. Для достижения октета ему не хватает 4 электронов.
— Образование CO₂: В молекуле \(CO₂\) атом углерода является центральным. Каждый из двух атомов кислорода нуждается в 2 электронах, и атом углерода может предоставить 4 электрона для образования связей (по 2 для каждого кислорода).
— Атом углерода образует две двойные ковалентные связи (\(C=O\)) с двумя атомами кислорода. Каждая двойная связь состоит из двух общих электронных пар.
— В результате, атом углерода получает 8 электронов (по 4 от каждой двойной связи), а каждый атом кислорода также получает 8 электронов (4 от двойной связи и 4 своих неподеленных электрона).
— Полярность: Кислород более электроотрицателен, чем углерод. Поэтому электроны в каждой двойной связи \(C=O\) смещаются к атому кислорода, делая каждую связь \(C=O\) ковалентной полярной (\(O\delta⁻=C\delta⁺=O\delta⁻\)). Однако, поскольку молекула \(CO₂\) имеет линейное строение, дипольные моменты двух связей \(C=O\) направлены в противоположные стороны и компенсируют друг друга, делая молекулу \(CO₂\) в целом неполярной.
Схема образования:
— Слева показаны атомы с их валентными электронами:
: Атом кислорода с двумя неподеленными электронными парами и двумя неспаренными электронами.
: Атом углерода с четырьмя неспаренными электронами.
: Второй атом кислорода.
— Справа показана образовавшаяся молекула \(CO₂\):
: Каждая двойная пара точек между O и C (::) представляет собой двойную ковалентную связь (две общие электронные пары). Атомы O и C достигают октета. Круги вокруг общих пар подчеркивают, что эти электроны принадлежат обоим атомам.
Вопрос 4
Давайте подробно разберем каждую из предложенных групп и объясним, почему в каждой из них выделяется «лишнее» вещество.
1) Na, Al, Si, Ca
— В этой группе представлены элементы: натрий (Na), алюминий (Al), кремний (Si) и кальций (Ca). Все они являются металлами, за исключением кремния, который является неметаллом. Таким образом, кремний выделяется как «лишний» элемент, так как он не относится к группе металлов.
2) HCl, H₂O, NH₃, H₂
— В этой группе представлены различные молекулы: хлороводород (HCl), вода (H₂O), аммиак (NH₃) и водород (H₂). Все указанные вещества имеют ковалентную связь, но у водорода (H₂) связь является неполярной, в то время как у остальных соединений — полярной. Поэтому водород выделяется как «лишний» элемент в этой группе.
3) SCl₂, CaCl₂, MgCl₂, KCl
— В этой группе находятся соединения: дисульфид хлора (SCl₂), хлорид кальция (CaCl₂), хлорид магния (MgCl₂) и хлорид калия (KCl). Все соединения, кроме SCl₂, имеют ионную связь. SCl₂ же имеет полярную ковалентную связь из-за различия в электроотрицательности между серой и хлором. Поэтому SCl₂ является «лишним» в этом списке.
Таким образом, в каждой группе выделяется одно вещество, которое отличается по своим химическим свойствам от остальных.
Вопрос 5
Давайте подробно разберем каждое из утверждений и объясним, почему одно из них верно, а другое — нет.
Утверждение А:
«Природа любой химической связи электростатическая.»
Это утверждение верно. Все химические связи основаны на электростатических взаимодействиях между частицами:
— Ионная связь: В ионной связи происходит притяжение между положительными ионами (катионами) и отрицательными ионами (анионами). Это взаимодействие является электростатическим, так как положительные и отрицательные заряды притягиваются друг к другу.
— Ковалентная связь: В ковалентной связи положительные ядра атомов притягиваются к общим электронам, которые находятся между ними. Здесь также присутствует электростатическое взаимодействие, так как ядра с положительным зарядом притягивают электроны.
— Металлическая связь: В металлической связи положительные ионы металла притягиваются к «электронному газу», что также является результатом электростатических взаимодействий.
Таким образом, утверждение А является верным.
Утверждение Б:
«В одном веществе может быть только один вид химической связи.»
Это утверждение неверно. В одном веществе могут присутствовать разные виды химических связей. Рассмотрим несколько примеров:
— Сложные соединения: Например, в молекуле белка могут быть как ковалентные связи между атомами, так и водородные связи между молекулами.
— Соли: В соли, такой как NaCl, ионные связи присутствуют, но в водном растворе могут образовываться водородные связи между молекулами воды и ионами Na⁺ или Cl⁻.
— Координационные соединения: В координационных соединениях могут быть как ковалентные, так и ионные связи.
Таким образом, утверждение Б неверно, так как в одном веществе может сосуществовать несколько типов связей.
Вывод:
Из вышеизложенного следует, что верно только утверждение А. Поэтому правильный ответ — 2) верно только А.
Вопрос 6
Давайте подробно разберем, почему между атомами элементов с порядковыми номерами 11 и 9 образуется ионная связь.
Элементы:
— Элемент №11: Натрий (Na) — это металл, который находится в первой группе периодической таблицы. У него есть один электрон на внешней оболочке, который он стремится отдать, чтобы достичь стабильной электронной конфигурации, подобной инертному газу.
— Элемент №9: Фтор (F) — это неметалл, который находится в семнадцатой группе периодической таблицы. У него есть семь электронов на внешней оболочке, и он стремится принять один электрон, чтобы достичь стабильной конфигурации.
Образование связи:
Когда натрий и фтор взаимодействуют, происходит следующее:
1. Передача электрона: Натрий отдает свой один валентный электрон, превращаясь в катион Na⁺. Это происходит потому, что натрий хочет стать более стабильным, избавившись от своего единственного валентного электрона.
2. Присоединение электрона: Фтор принимает этот электрон, превращаясь в анион F⁻. Это происходит потому, что фтор хочет заполнить свою внешнюю оболочку до восьми электронов (правило октета).
Ионная связь:
После того как натрий отдал электрон, а фтор его принял, между ними возникает электростатическое притяжение. Na⁺ и F⁻ имеют противоположные заряды, что приводит к образованию ионной связи. Это тип связи характерен для соединений между металлами и неметаллами.
Заключение:
Таким образом, между атомами натрия и фтора образуется ионная связь, что подтверждает правильность ответа: 1) ионная.
Вопрос 7
Давайте подробно разберем каждое из утверждений и объясним, почему оба из них неверны.
Утверждение А:
«Химический элемент кальций образует вещества, в которых наблюдаются все типы химических связей.»
Это утверждение неверно. Кальций (Ca) — это металл, который в основном образует ионные соединения с неметаллами. Он может образовывать:
— Ионные связи: Например, в соединениях с неметаллами, такими как хлор (CaCl₂) или кислород (CaO), кальций образует ионные связи, отдавая свои валентные электроны.
Кальций не образует ковалентных связей в чистом виде, так как он не имеет подходящего количества валентных электронов для формирования таких связей с другими металлами или неметаллами. Таким образом, кальций не может образовать вещества со всеми типами химических связей.
Утверждение Б:
«Вещество кальций Ca и нитрид кальция Ca₃N₂ образованы соответственно с помощью металлической и ковалентной неполярной связей.»
Это утверждение также неверно. Рассмотрим каждую часть:
1. Кальций (Ca): В чистом виде кальций — это металл, который образует металлическую связь между атомами кальция в кристаллической решетке. Это правильно.
2. Нитрид кальция (Ca₃N₂): Это соединение образуется при реакции кальция с азотом. Нитрид кальция на самом деле образован ионной связью, а не ковалентной. Кальций отдает электроны, становясь катионом (Ca²⁺), а азот принимает электроны, становясь анионом (N³⁻). В результате образуются ионные связи между Ca²⁺ и N³⁻.
Таким образом, утверждение Б также неверно, так как нитрид кальция не имеет ковалентной связи.
Итог:
Оба суждения неверны, поэтому правильный ответ — 4.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.


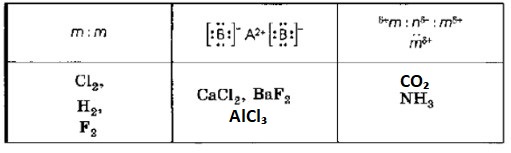
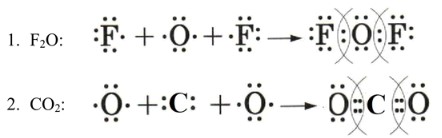
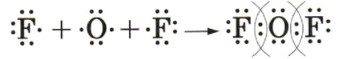
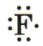 : Атом фтора с тремя неподеленными электронными парами и одним неспаренным электроном (обозначен точкой).
: Атом фтора с тремя неподеленными электронными парами и одним неспаренным электроном (обозначен точкой). : Атом кислорода с двумя неподеленными электронными парами и двумя неспаренными электронами (обозначены точками).
: Атом кислорода с двумя неподеленными электронными парами и двумя неспаренными электронами (обозначены точками).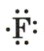 : Второй атом фтора.
: Второй атом фтора. : Каждая пара точек между F и O представляет собой общую электронную пару (ковалентную связь). Атомы F и O достигают октета (8 электронов на внешнем уровне, включая общие пары). Круги вокруг общих пар подчеркивают, что эти электроны принадлежат обоим атомам.
: Каждая пара точек между F и O представляет собой общую электронную пару (ковалентную связь). Атомы F и O достигают октета (8 электронов на внешнем уровне, включая общие пары). Круги вокруг общих пар подчеркивают, что эти электроны принадлежат обоим атомам.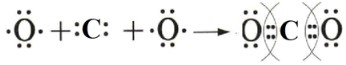
 : Атом кислорода с двумя неподеленными электронными парами и двумя неспаренными электронами.
: Атом кислорода с двумя неподеленными электронными парами и двумя неспаренными электронами.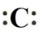 : Атом углерода с четырьмя неспаренными электронами.
: Атом углерода с четырьмя неспаренными электронами. : Второй атом кислорода.
: Второй атом кислорода. : Каждая двойная пара точек между O и C (::) представляет собой двойную ковалентную связь (две общие электронные пары). Атомы O и C достигают октета. Круги вокруг общих пар подчеркивают, что эти электроны принадлежат обоим атомам.
: Каждая двойная пара точек между O и C (::) представляет собой двойную ковалентную связь (две общие электронные пары). Атомы O и C достигают октета. Круги вокруг общих пар подчеркивают, что эти электроны принадлежат обоим атомам.


Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!