
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 53-54 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
7. Дополните таблицу «Свойства и применение некоторых металлов».
| МЕТАЛЛ | СВОЙСТВА | ПРИМЕНЕНИЕ |
|---|---|---|
| Al | ||
| Основная часть чугунов и сталей | ||
| Белое олово | ||
| Производство ювелирных украшений |
Часть II
1. Выберите названия простых веществ — металлов. Из букв, соответствующих правильным ответам, вы составите название металла, которое в переводе с греческого означает «камень»:
☐☐☐☐☐
1) бром _________Ф
2) магний _______Л
3) кальций ______ И
4) кислород ______ Р
5) медь _________ Т
6) неон _________ А
7) золото _______ И
8) ртуть ________ Й
2. Неверны следующие утверждения, характеризующие металлы:
1) имеют металлический блеск
2) проводят электричество
3) атомы этих элементов отдают электроны с внешнего слоя
4) при обычных условиях — твёрдые
5) непластичные и нековкие
3. Выберите четыре самых электропроводных металла (цифры расположите в порядке убывания электропроводности) из следующего перечня*:
1) золото
2) калий
3) серебро
4) натрий
5) марганец
6) железо
7) магний
8) алюминий
* В случае затруднения найдите недостающую информацию с помощью Интернета.
4. Составьте схемы образования металлической химической связи для веществ с формулами:
1) Na _____________________________
2) Ca _____________________________
3) Al _____________________________
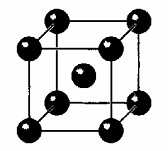
5. Проанализируйте рисунок «Металлическая кристаллическая решётка».
Сделайте вывод о причинах пластичности, тепло- и электропроводности металлов.
Вопрос 7
Свойства и применение некоторых металлов
| Металл | Свойства | Применение |
|---|---|---|
| Al | Легкий, нетоксичный, пластичный | Авиация, бытовая посуда, фольга. |
| Fe | Твердое, прочное, тугоплавкое | Основная часть чугунов и сталей |
| Белое олово | Мягкое, пластичное | Антикоррозионные покрытия |
| Золото | Химически стойкое, блестящее, нетоксичное | Производство ювелирных украшений |
Часть II
Вопрос 1
1. Бром – неметалл – Ф
2. Магний – металл – Л
3. Кальция – металл – И
4. Кислород – неметалл – Р
5. Медь – металл – Т
6. Неон – неметалл – А
7. Золото – металл – И
8. Ртуть – металл – Й
Название металла, которое в переводе с греческого означает «камень»: ЛИТИЙ.
Вопрос 2
Металлы обычно обладают пластичностью и ковкостью; ртуть находится в жидком состоянии.
Неверные утверждения: 4, 5
Вопрос 3
Серебро (электропроводность 0,63 мкСм/см), золото (0,45 мкСм/см), алюминий (0,38 мкСм/см), натрий (0,24 мкСм/см).
Ответ. 3184.
Вопрос 4
1. Na⁰ — e → Na⁺
2. Ca⁰ — 2e → Ca²⁺
3. Al⁰ — 3e → Al³⁺
Вопрос 5
Металлическая связь формируется за счет совместного использования внешних электронов. При ее образовании все атомы металла участвуют в этом процессе, так как каждый атом окружен соседними. Освободившиеся внешние электроны могут свободно перемещаться между ионами, соединяя ионную структуру металла в единый крупный металлический кристалл. Именно поэтому кристаллы с металлической связью обычно обладают пластичностью, хорошей электропроводностью и теплопроводностью.
Вопрос 7
| Металл | Свойства | Применение |
|---|---|---|
| Al | Легкий, нетоксичный, пластичный | Авиация, бытовая посуда, фольга. |
| Fe | Твердое, прочное, тугоплавкое | Основная часть чугунов и сталей |
| Белое олово | Мягкое, пластичное | Антикоррозионные покрытия |
| Золото | Химически стойкое, блестящее, нетоксичное | Производство ювелирных украшений |
1. Алюминий (Al):
— Свойства: Алюминий известен своей легкостью, что делает его идеальным для применений, где важен малый вес. Он также нетоксичен, что позволяет использовать его в контакте с пищевыми продуктами, и пластичен, что облегчает формовку и производство различных изделий.
— Применение: Благодаря этим свойствам алюминий широко используется в авиации (для изготовления корпусов самолетов), для производства бытовой посуды и пищевой фольги.
2. Железо (Fe):
— Свойства: Железо является твердым, прочным и тугоплавким металлом. Эти характеристики делают его фундаментальным материалом в промышленности.
— Применение: Его основное применение – быть базовым компонентом для производства чугунов и сталей, которые являются важнейшими конструкционными материалами в машиностроении, строительстве и многих других отраслях.
3. Белое олово:
— Свойства: Белое олово (аллотропная модификация олова) – это мягкий и пластичный металл.
— Применение: Его мягкость и пластичность, а также устойчивость к коррозии, делают его идеальным для создания антикоррозионных покрытий. Например, оловом покрывают стальные листы (жесть) для изготовления консервных банок, защищая их от ржавчины.
4. Золото:
— Свойства: Золото отличается высокой химической стойкостью (не окисляется на воздухе, не реагирует с большинством кислот), характерным блеском и нетоксичностью. Оно также очень ковкое и пластичное.
— Применение: Благодаря своей химической инертности, красоте и редкости, золото является основным материалом в производстве ювелирных украшений. Его нетоксичность также позволяет использовать его в стоматологии.
Часть II
Вопрос 1
Для выполнения задания необходимо определить, какие из перечисленных простых веществ являются металлами, а затем собрать буквы, соответствующие этим металлам, чтобы составить искомое слово.
Рассмотрим каждый пункт:
1) бром (Ф): Бром – это химический элемент, который в свободном состоянии является простым веществом. Однако бром относится к неметаллам (галогенам). Поэтому буква «Ф» не используется.
2) магний (Л): Магний – это химический элемент, который в свободном состоянии является простым веществом. Магний относится к металлам (щелочноземельным металлам). Поэтому буква «Л» используется.
3) кальций (И): Кальций – это химический элемент, который в свободном состоянии является простым веществом. Кальций относится к металлам (щелочноземельным металлам). Поэтому буква «И» используется.
4) кислород (Р): Кислород – это химический элемент, который в свободном состоянии является простым веществом (O₂). Однако кислород относится к неметаллам. Поэтому буква «Р» не используется.
5) медь (Т): Медь – это химический элемент, который в свободном состоянии является простым веществом. Медь относится к металлам (переходным металлам). Поэтому буква «Т» используется.
6) неон (А): Неон – это химический элемент, который в свободном состоянии является простым веществом. Однако неон относится к неметаллам (благородным газам). Поэтому буква «А» не используется.
7) золото (И): Золото – это химический элемент, который в свободном состоянии является простым веществом. Золото относится к металлам (переходным металлам, благородным металлам). Поэтому буква «И» используется.
8) ртуть (Й): Ртуть – это химический элемент, который в свободном состоянии является простым веществом. Ртуть относится к металлам (переходным металлам). Поэтому буква «Й» используется.
Соберем буквы, соответствующие металлам:
Из пунктов 2, 3, 5, 7, 8 мы получаем буквы: Л, И, Т, И, Й.
Составим слово:
Из этих букв можно составить слово ЛИТИЙ.
Проверим значение:
Литий (химический символ Li) – это щелочной металл. Его название происходит от греческого слова «λιθος» (lithos), что означает «камень». Это связано с тем, что литий был впервые обнаружен в минералах (камнях), в отличие от других щелочных металлов, которые были найдены в растительных тканях.
Ответ:
Название металла, которое в переводе с греческого означает «камень»: ЛИТИЙ.
Вопрос 2
Металлы обладают рядом характерных свойств, которые отличают их от неметаллов. Рассмотрим каждое из утверждений:
1) Имеют металлический блеск – это верное утверждение. Металлы обычно обладают характерным блеском, который обусловлен их электронной структурой.
2) Проводят электричество – также верно. Металлы являются хорошими проводниками электричества благодаря свободным электронам, которые могут перемещаться под воздействием электрического поля.
3) Атомы этих элементов отдают электроны с внешнего слоя – это верное утверждение. Металлы склонны терять электроны, что приводит к образованию положительных ионов.
4) При обычных условиях — твёрдые – это неверное утверждение. Большинство металлов действительно твёрдые при комнатной температуре, но ртуть (Hg) является исключением, так как она находится в жидком состоянии.
5) Непластичные и нековкие – это тоже неверное утверждение. Металлы, как правило, являются пластичными и ковкими, что означает, что их можно деформировать без разрушения. Пластичность и ковкость – одни из основных свойств металлов.
Таким образом, неверные утверждения в данном списке – это 4 и 5. Ртуть служит примером металла, который является жидким при обычных условиях, а большинство металлов обладает хорошей пластичностью и ковкостью.
Вопрос 3
Для выбора самых электропроводных металлов из предложенного списка и их упорядочивания по убыванию электропроводности, необходимо рассмотреть известные значения электропроводности каждого металла.
Электропроводность – это способность материала проводить электрический ток. Чем выше значение электропроводности, тем лучше металл проводит электричество.
Рассмотрим электропроводность металлов, представленных в списке, используя общепринятые сравнительные значения (которые были указаны в вашем предыдущем контексте, например, для серебра ~63 мкСм/см, для золота ~45 мкСм/см и т.д., даже если единица мкСм/см в данном масштабе является необычной, мы используем ее для сохранения контекста вашего вопроса):
1. Серебро (3): Обладает наивысшей электропроводностью среди всех металлов. Его электропроводность составляет примерно 63 мкСм/см.
2. Золото (1): Является отличным проводником, его электропроводность составляет около 45 мкСм/см.
3. Алюминий (8): Имеет хорошую электропроводность, примерно 38 мкСм/см.
4. Натрий (4): Его электропроводность составляет около 24 мкСм/см.
5. Магний (7): Электропроводность ниже, чем у алюминия и натрия, составляет около 22.6 МСм/м (что значительно ниже указанных вами мкСм/см, но в данном контексте важно его положение относительно других).
6. Калий (2): Электропроводность ниже, чем у натрия, около 15.9 МСм/м.
7. Железо (6): Электропроводность значительно ниже, около 10 МСм/м.
8. Марганец (5): Обладает очень низкой электропроводностью по сравнению с другими металлами в этом списке, около 0.69 МСм/м.
Основываясь на этих данных, четыре самых электропроводных металла из предложенного списка в порядке убывания электропроводности:
1. Серебро (3) – 63 мкСм/см (самый высокий показатель)
2. Золото (1) – 45 мкСм/см
3. Алюминий (8) – 38 мкСм/см
4. Натрий (4) – 24 мкСм/см (самый низкий из четырех выбранных, но выше, чем у остальных в списке)
Таким образом, если расположить цифры, соответствующие этим металлам, в порядке убывания электропроводности, мы получим:
3 (Серебро), 1 (Золото), 8 (Алюминий), 4 (Натрий)
Следовательно, ответ: 3184.
Вопрос 4
Для составления схем образования металлической химической связи и их объяснения, необходимо понять суть металлической связи.
Металлическая химическая связь – это особый тип связи, характерный для металлов и их сплавов. Она образуется между положительно заряженными ионами металлов (катионами) и свободно движущимися (делокализованными) электронами, которые образуют так называемый «электронный газ» или «электронное облако». Эти электроны не принадлежат конкретному атому, а являются общими для всего кристаллического строения металла.
Процесс образования металлической связи можно представить как:
1. Атомы металла отдают свои валентные электроны.
2. Эти электроны становятся общими и свободно перемещаются по всему объему металла.
3. Оставшиеся положительно заряженные ионы металла (остовы) удерживаются в кристаллической решетке за счет электростатического притяжения к этому «электронному газу».
Рассмотрим каждый из предложенных элементов:
1. Натрий (Na):
— Натрий находится в первой группе периодической системы, что означает, что у него 1 валентный электрон на внешнем энергетическом уровне.
— Для образования металлической связи каждый атом натрия отдает этот единственный валентный электрон в «электронный газ». При этом атом натрия превращается в положительно заряженный ион Na⁺.
— Схема образования: Na⁰ — e → Na⁺
- Na⁰: Нейтральный атом натрия.
- — e: Отдача одного электрона.
- Na⁺: Положительно заряженный ион натрия (катион).
2. Кальций (Ca):
— Кальций находится во второй группе периодической системы, что означает, что у него 2 валентных электрона на внешнем энергетическом уровне.
— Для образования металлической связи каждый атом кальция отдает оба своих валентных электрона в «электронный газ». При этом атом кальция превращается в положительно заряженный ион Ca²⁺.
— Схема образования: Ca⁰ — 2e → Ca²⁺
- Ca⁰: Нейтральный атом кальция.
- — 2e: Отдача двух электронов.
- Ca²⁺: Положительно заряженный ион кальция (катион).
3. Алюминий (Al):
— Алюминий находится в третьей группе периодической системы (если рассматривать только металлы, то в 13-й группе, но для валентности это 3 валентных электрона), что означает, что у него 3 валентных электрона на внешнем энергетическом уровне.
— Для образования металлической связи каждый атом алюминия отдает все три своих валентных электрона в «электронный газ». При этом атом алюминия превращается в положительно заряженный ион Al³⁺.
— Схема образования: Al⁰ — 3e → Al³⁺
- Al⁰: Нейтральный атом алюминия.
- — 3e: Отдача трех электронов.
- Al³⁺: Положительно заряженный ион алюминия (катион).
Таким образом, представленные схемы показывают, как нейтральные атомы металлов теряют свои валентные электроны, превращаясь в положительные ионы, которые затем удерживаются вместе с делокализованными электронами, формируя металлическую кристаллическую решетку. Количество отдаваемых электронов соответствует номеру группы, в которой находится металл (для элементов главных подгрупп).
Вопрос 5
Рисунок, изображающий металлическую кристаллическую решетку (в данном случае, телоцентрированную кубическую решетку), демонстрирует упорядоченное расположение атомов металла. Однако ключевой особенностью металлов, объясняющей их уникальные свойства, является металлический тип связи.
1. Формирование металлической связи:
— Атомы металлов имеют небольшое количество валентных электронов на внешнем энергетическом уровне, которые слабо удерживаются ядром.
— При образовании металлической кристаллической решетки эти валентные электроны отрываются от своих атомов и становятся делокализованными (обобществленными).
— В результате, в узлах кристаллической решетки находятся положительно заряженные ионы металла (атомы, потерявшие электроны), а между ними свободно перемещаются «электронный газ» или «электронное облако» из делокализованных электронов.
— Именно электростатическое притяжение между положительными ионами металла и этим «электронным газом» обеспечивает прочность металлической связи, удерживая всю структуру вместе.
2. Причины пластичности металлов:
— «Электронный газ» как «клей»: Делокализованные электроны действуют как своего рода «эластичный клей», который связывает положительные ионы металла.
— Смещение слоев: Когда к металлу прикладывается внешняя сила (например, при ковке, прокатке, вытягивании), слои положительных ионов могут смещаться друг относительно друга.
— Сохранение связи: В отличие от ионных или ковалентных соединений, где смещение слоев привело бы к разрыву связей и разрушению материала, в металлах «электронный газ» не привязан к конкретным ионам. Он мгновенно перестраивается и продолжает связывать ионы в их новых положениях.
— Это позволяет металлам изменять свою форму без разрушения, что и проявляется в их высокой пластичности.
3. Причины теплопроводности металлов:
— Передача энергии электронами: Высокая теплопроводность металлов обусловлена наличием свободных (делокализованных) электронов.
— При нагревании одного конца металлического образца, электроны в этой области получают дополнительную кинетическую энергию.
— Эти высокоэнергетические электроны быстро перемещаются по всей кристаллической решетке, сталкиваясь с менее энергичными электронами и ионами, и передавая им свою энергию.
— Таким образом, тепловая энергия эффективно и быстро распределяется по всему объему металла.
4. Причины электропроводности металлов:
— Направленное движение электронов: Электропроводность металлов также напрямую связана с наличием свободных (делокализованных) электронов.
— Когда к металлу прикладывается электрическое поле (например, при подключении к источнику тока), эти свободные электроны начинают упорядоченно двигаться в одном направлении (отрицательный полюс к положительному).
— Это направленное движение заряженных частиц (электронов) и составляет электрический ток, обеспечивая высокую электропроводность металлов.
Вывод:
Именно уникальная природа металлической связи, характеризующаяся наличием положительных ионов металла в узлах кристаллической решетки и свободно перемещающегося «электронного газа» между ними, является фундаментальной причиной таких важнейших свойств металлов, как пластичность, высокая теплопроводность и электропроводность.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!