
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 57-59 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
Часть I
1. Неметаллы (НМ) располагаются в □□□-□□□ группах.
(каждый элемент римской цифры поместите в отдельную клеточку)
Только из НМ состоит □□□ □ группа, или группа □□□□□□□□□
(укажите тип группы — А или Б)
По физическим свойствам к НМ следует отнести также □□□□ □ группу, или группу □□□□□□□□□□□ □□□□□.
2. У атомов неметаллов □ и более электрона во внешнем слое, небольшой радиус атома, например □, у атома которого □ внешних ē. Поэтому атомы НМ стремятся □□□□□□□ недостающие до 8ē. Это свойство атомов характеризуется □□□□□□□□□□□□□□□□□□□□□□□.
В соответствии с ним НМ образуют особый ряд: □ □ □ □ □ □ □ □ □ □ □.
3. Молекулы простых веществ НМ образованы за счёт □□□□□□□□□□□ □□□□□□□□□□ связи.
Двухатомные молекулы имеют, например, следующие
простые вещества: □2, □2, □2, □□□□□□□□ (название группы); трёхатомная молекула □3 — у □□□□□.
4. Аллотропия для неметаллов более характерна, чем для металлов.
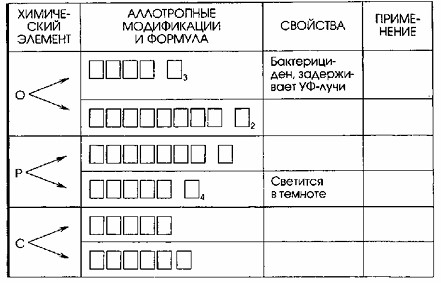
Заполните таблицу «Аллотропные модификации неметаллов». Данные для таблицы найдите с помощью дополнительных источников информации, в том числе Интернета.
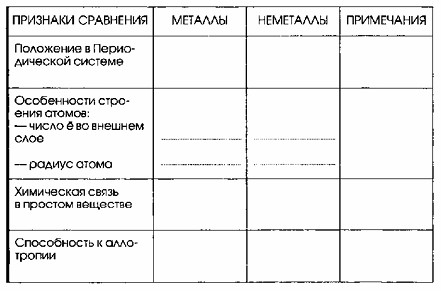
5. Заполните таблицу «Сравнение свойств металлов и неметаллов».
Часть II
1. Выберите названия простых веществ — неметаллов. Из букв, соответствующих правильным ответам, вы составите название неметалла, которое в переводе с греческого означает «гибель, разрушение»: □□□□.
1) бром …….. Ф
2) магний …….. Т
3) кальций …….. Л
4) кислород …….. Т
5) вольфрам …….. Л
6) неон …….. О
7) золото …….. И
8) иод …….. Р
2. Распределите вещества Na, Br₂, Ne, I₂, Li, He, Cl₂ на три группы. Вычислите и запишите относительные молекулярные массы галогенов.
| ЩЕЛОЧНЫЕ МЕТАЛЛЫ | БЛАГОРОДНЫЕ ГАЗЫ | ГАЛОГЕНЫ | Mr ВЕЩЕСТВА |
|---|---|---|---|
§13
Часть I
Вопрос 1
Неметаллы (НМ) располагаются в III-VII группах.
Только из НМ состоит VIIA-группа, или группа ГАЛОГЕНОВ. По физическим свойствам к НМ следует отнести также VIIIA-группу, или группу БЛАГОРОДНЫХ ГАЗОВ.
Вопрос 2
У атомов неметаллов 4 и более электрона во внешнем слое, небольшой радиус атома, например F, у атома которого 7 внешних е. Поэтому атомы НМ стремятся ПРИНЯТЬ недостающие до 8 е. Это свойство атомов характеризуется ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬЮ. В соответствии с ним НМ образуют особый ряд:
Вопрос 3
Молекулы простых веществ НМ образованы за счет КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ связи. Двухатомные молекулы имеют, например, следующие простые вещества: H₂, O₂, N₂, ГАЛОГЕНЫ; трехатомная молекула O₃ — у ОЗОНА.
Вопрос 4
Аллотропные модификации неметаллов
| Химический элемент | Аллотропные модификации и формула | Свойства | Применение |
|---|---|---|---|
 | ОЗОН O₃ | Бактерициден, задерживает УФ-лучи | При дезинфекции помещений |
| КИСЛОРОД O₂ | Поддерживает дыхание и горение | В медицине, в электросварке, в топливной промышленности | |
 | КРАСНЫЙ Р | Неядовит, не имеет запаха, не светится | Спичечное производство |
| БЕЛЫЙ Р₄ | Светится в темноте | В промышленности, при изготовлении зажигательных смесей, в составе зооцидов | |
 | АЛМАЗ | Твердый, тугоплавкий | В ювелирном деле, при производстве сверел |
| ГРАФИТ | Мягкий, блестящий, проводник | При производстве карандашей, в металлургии и в машиностроении |
Вопрос 5
Сравнение свойств металлов и неметаллов
| Признаки сравнения | Металлы | Неметаллы | Примечания |
|---|---|---|---|
| Положение в Периодической системе | I-III группы, или в нижней части IV-VI групп. Только из металлов состоят Б-группы. | I (водород), IV-VIIIA-группы, выше диагонали бор-астат | Элементы VIIIA-группы (благородные газы) относятся к неметаллам только по физическим свойствам. |
| Особенности строения атомов: — число е во внешнем слое | 1-3 | 4-8 | Слева направо по периоду радиус уменьшается, а сверху вниз по подгруппе — растет. |
| — радиус атома | Сравнительно большой | Сравнительно небольшой | Слева направо по периоду радиус уменьшается, а сверху вниз по подгруппе — растет. |
| Химическая связь в простом веществе | Металлическая | Ковалентная неполярная | Некоторые металлы при высокой температуре могут образовывать ковалентные связи, например, Li₂ |
| Способность к аллотропии | Белое и серое олово | Алмаз и графит, кислород и озон, белый и красный фосфор, модификации серы и т.д. | Для неметаллов аллотропия более характерна, чем для металлов |
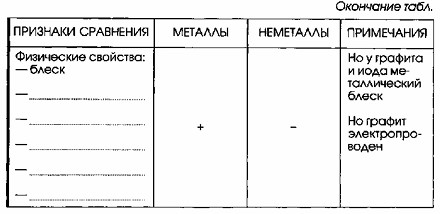
| Физические свойства: — блеск — твердость — электропроводность — теплопроводность — ковкость | + | — | Но у графита и иода металлический блеск. Но ртуть – жидкость. Но алмаз – одно из самых твердых веществ. Но графит электропроводен. |
Часть II
Вопрос 1
| 1. Бром | Неметалл | Ф |
| 2. Магний | Металл | Т |
| 3. Кальций | Металл | Л |
| 4. Кислород | Неметалл | Т |
| 5. Вольфрам | Металл | Л |
| 6. Неон | Неметалл | О |
| 7. Золото | Металл | И |
| 8. Иод | Неметалл | Р |
Название неметалла, которое в переводе с греческого означает «гибель, разрушение»: ФТОР.
Вопрос 2
| ЩЕЛОЧНЫЕ МЕТАЛЛЫ | БЛАГОРОДНЫЕ ГАЗЫ | ГАЛОГЕНЫ | Mr ВЕЩЕСТВА |
|---|---|---|---|
| Na | Ne | Cl2 | 71 |
| Li | He | Br2 | 160 |
| I2 | 254 |
§13
Часть I
Вопрос 1
В периодической таблице элементов неметаллы (НМ) действительно располагаются в группах III-VII. Это связано с тем, что в этих группах находятся элементы, обладающие неметаллическими свойствами, такими как высокая электроотрицательность, способность к образованию молекул и различные формы химической активности.
1. Группы III-VII:
— Группа III включает такие элементы, как бор (B), который обладает некоторыми неметаллическими свойствами.
— Группы IV и V содержат углерод (C) и азот (N), которые также проявляют неметаллические характеристики.
— Группы VI и VII включают кислород (O), серу (S), фосфор (P) и галогены, такие как фтор (F) и хлор (Cl), которые являются классическими неметаллами.
2. VIIA-группа или группа ГАЛОГЕНОВ:
— Эта группа состоит исключительно из неметаллов, включая фтор, хлор, бром и йод. Все они обладают высокой реакционной способностью и формируют различные соединения с металлами и другими неметаллами.
3. VIIIA-группа или группа БЛАГОРОДНЫХ ГАЗОВ:
— Хотя благородные газы, такие как гелий (He), неон (Ne) и аргон (Ar), традиционно не рассматриваются как неметаллы из-за их инертности, их можно отнести к неметаллам по физическим свойствам. Они не образуют ионов и имеют полный внешний уровень электронов, что делает их стабильными и неактивными.
Вопрос 2
1. «У атомов неметаллов 4 и более электрона во внешнем слое»:
— Почему это важно? Электроны на внешнем (валентном) слое определяют химические свойства элемента. Атомы стремятся достичь стабильной электронной конфигурации, обычно имея 8 электронов на внешнем слое (правило октета), как у благородных газов.
— Для неметаллов: Если у атома 4, 5, 6 или 7 валентных электронов, ему легче «добрать» недостающие электроны до восьми, чем отдать все имеющиеся. Например, атому с 7 электронами нужно получить всего 1 электрон, тогда как отдать нужно 7.
2. «небольшой радиус атома»:
— Почему это важно? Радиус атома влияет на силу притяжения внешних электронов к ядру. Чем меньше радиус, тем ближе внешние электроны к положительно заряженному ядру, и тем сильнее они притягиваются.
— Для неметаллов: Неметаллы расположены в правой части периодической таблицы (за исключением водорода). При движении по периоду слева направо увеличивается заряд ядра, и электроны притягиваются сильнее, что приводит к уменьшению радиуса атома. Это усиливает способность атома притягивать дополнительные электроны.
3. «например F, у атома которого 7 внешних ē»:
— Пример: Фтор (F) является типичным неметаллом. Он находится в VIIA группе (группа галогенов) и имеет 7 электронов на внешнем энергетическом уровне.
— Стремление к стабильности: Фтору не хватает всего одного электрона для завершения внешнего слоя до стабильного октета, что делает его чрезвычайно химически активным и склонным к притяжению электронов.
4. «Поэтому атомы НМ стремятся ПРИНЯТЬ недостающие до 8 ē»:
— Суть химического поведения: Из-за большого числа валентных электронов и небольшого атомного радиуса, неметаллы имеют сильное притяжение к электронам. Они достигают стабильности, принимая электроны от других атомов (образуя отрицательные ионы — анионы) или образуя ковалентные связи, где они делят электроны с другими атомами, но при этом сильно притягивают их к себе.
5. «Это свойство атомов характеризуется ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬЮ»:
— Определение: Электроотрицательность — это мера способности атома притягивать к себе электроны в химической связи.
— Для неметаллов: Неметаллы обладают высокой электроотрицательностью, что является прямым следствием их стремления принимать электроны. Фтор является самым электроотрицательным элементом.
6. «В соответствии с ним НМ образуют особый ряд»:
— Ряд электроотрицательности: Этот ряд представляет собой последовательность неметаллов, расположенных в порядке убывания их электроотрицательности.
— Интерпретация ряда:
- F (Фтор): Самый электроотрицательный элемент, его способность притягивать электроны максимальна.
- Далее следуют O (Кислород), N (Азот), Cl (Хлор), Br (Бром), I (Йод), S (Сера), C (Углерод), Si (Кремний), P (Фосфор), H (Водород).
- Хотя точные значения электроотрицательности могут немного варьироваться между соседними элементами в этом списке (например, хлор немного электроотрицательнее азота по шкале Полинга), общий тренд, который демонстрирует этот ряд, заключается в постепенном уменьшении способности атомов притягивать электроны от фтора к водороду. Это означает, что элементы в начале ряда (F, O, N) являются более сильными окислителями и активнее участвуют в образовании ионных или сильно полярных ковалентных связей, тогда как элементы в конце ряда (P, H) менее электроотрицательны.
Вопрос 3
Молекулы простых веществ НМ образованы за счет КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ связи. Двухатомные молекулы имеют, например, следующие простые вещества: H₂, O₂, N₂, ГАЛОГЕНЫ; трехатомная молекула O₃ — у ОЗОНА.
1. Ковалентная неполярная связь: Это тип химической связи, при которой два атома делят электронные пары. В случае неполярной ковалентной связи электроны распределены равномерно между атомами, что происходит, когда атомы имеют одинаковую или очень близкую электроотрицательность. Это приводит к тому, что молекула не имеет полюсов, и электрический заряд равномерно распределен.
2. Двухатомные молекулы: Это молекулы, состоящие из двух атомов. Примеры двухатомных молекул:
- H₂ (водород) — состоит из двух атомов водорода, соединенных ковалентной неполярной связью.
- O₂ (кислород) — две атома кислорода соединены между собой.
- N₂ (азот) — две атома азота образуют молекулу.
- Галогены — это группа элементов (F₂, Cl₂, Br₂, I₂), состоящая из двух атомов одного элемента, которые также образуют ковалентные неполярные связи.
3. Трехатомная молекула O₃ — озон: Озон состоит из трех атомов кислорода. В отличие от двухатомных молекул, где связь неполярная, в озоне присутствует более сложная структура связи, но в контексте обсуждения о молекулах простых веществ НМ (неметаллов) он также рассматривается как пример.
Вопрос 4
| Химический элемент | Аллотропные модификации и формула | Свойства | Применение |
|---|---|---|---|
 | ОЗОН O₃ | Бактерициден, задерживает УФ-лучи | При дезинфекции помещений |
| КИСЛОРОД O₂ | Поддерживает дыхание и горение | В медицине, в электросварке, в топливной промышленности | |
 | КРАСНЫЙ Р | Неядовит, не имеет запаха, не светится | Спичечное производство |
| БЕЛЫЙ Р₄ | Светится в темноте | В промышленности, при изготовлении зажигательных смесей, в составе зооцидов | |
 | АЛМАЗ | Твердый, тугоплавкий | В ювелирном деле, при производстве сверел |
| ГРАФИТ | Мягкий, блестящий, проводник | При производстве карандашей, в металлургии и в машиностроении |
Аллотропия — это способность химического элемента существовать в двух или более различных формах (аллотропных модификациях), которые отличаются по строению, а следовательно, и по физическим и химическим свойствам. Это явление более характерно для неметаллов, поскольку их атомы могут образовывать разнообразные ковалентные связи, приводящие к различным кристаллическим или молекулярным структурам.
Рассмотрим подробнее аллотропные модификации для каждого элемента, представленного в таблице:
1. Кислород (O)
ОЗОН (O₃)
— Свойства: Озон — это газ с характерным запахом «свежести» после грозы. Он является сильным окислителем, что объясняет его бактерицидные свойства. Одно из важнейших свойств озона — его способность поглощать ультрафиолетовое (УФ) излучение Солнца, защищая Землю от вредного воздействия.
— Применение:
- Дезинфекция помещений и воды: Благодаря своим бактерицидным свойствам, озон используется для обеззараживания воздуха и воды, например, на водоочистных станциях или в медицинских учреждениях.
- Медицина: В озонотерапии для лечения различных заболеваний.
- Промышленность: Для отбеливания тканей, бумаги, масел, а также для дезодорации.
КИСЛОРОД (O₂)
— Свойства: Кислород — это бесцветный газ без запаха, который составляет около 21% объема воздуха. Он жизненно важен для большинства живых организмов, так как поддерживает дыхание. Кислород также активно поддерживает горение большинства веществ.
— Применение:
- Медицина: Используется для поддержания дыхания у пациентов с респираторными проблемами, в анестезиологии.
- Электросварка: В газовой сварке и резке металлов для создания высокотемпературного пламени (например, кислородно-ацетиленовое пламя).
- Топливная промышленность: В качестве окислителя в ракетном топливе и для повышения эффективности сгорания топлива в промышленных печах.
- Металлургия: Для производства стали и других металлов (удаление примесей).
2. Фосфор (P)
КРАСНЫЙ ФОСФОР (КРАСНЫЙ Р)
— Свойства: Красный фосфор представляет собой аморфное или кристаллическое вещество красного цвета. Он значительно менее реактивен и токсичен по сравнению с белым фосфором. Не имеет запаха и не светится в темноте. Загорается при более высокой температуре (около 240°C).
— Применение:
- Спичечное производство: Основной компонент намазки на коробке безопасных спичек. При трении спички о намазку происходит реакция, приводящая к воспламенению.
- Пиротехника: Используется в производстве фейерверков и сигнальных ракет.
- Полупроводниковые материалы: В некоторых полупроводниковых сплавах.
БЕЛЫЙ ФОСФОР (БЕЛЫЙ P₄)
— Свойства: Белый фосфор — это воскообразное, полупрозрачное вещество, которое очень ядовито и чрезвычайно реактивно. Он светится в темноте (явление фосфоресценции) из-за медленного окисления на воздухе. Самовоспламеняется на воздухе при комнатной температуре (около 40°C), поэтому хранится под водой.
— Применение:
- Промышленность: В химической промышленности для синтеза различных фосфорсодержащих соединений (например, фосфорной кислоты, фосфорных удобрений).
- Зажигательные смеси и дымовые завесы: Из-за его высокой воспламеняемости и способности образовывать густой белый дым, белый фосфор используется в военном деле для производства зажигательных боеприпасов и дымовых шашек.
- Зооциды: Ранее применялся в составе некоторых ядов для грызунов (зооцидов), но его использование сильно ограничено из-за высокой токсичности и опасности.
3. Углерод (C)
АЛМАЗ
— Свойства: Алмаз — это самая твердая из известных природных минералов. Он обладает высокой теплопроводностью, является электрическим изолятором и имеет высокую температуру плавления. Его атомы углерода соединены в прочную тетраэдрическую структуру.
— Применение:
- Ювелирное дело: Из-за своей исключительной твердости и блеска, алмазы используются как драгоценные камни.
- Производство сверл и абразивов: Благодаря своей твердости, алмазы и синтетические алмазы применяются для изготовления режущих инструментов, сверл, абразивов для обработки сверхтвердых материалов.
- Промышленные резцы: В промышленности для резки и шлифовки твердых материалов.
ГРАФИТ
— Свойства: Графит — это мягкое, скользкое на ощупь вещество с металлическим блеском. В отличие от алмаза, он является хорошим проводником электричества и тепла. Его структура состоит из слоев атомов углерода, расположенных в гексагональной решетке, которые слабо связаны между собой, что объясняет его мягкость и способность расслаиваться.
— Применение:
- Производство карандашей: Основной компонент грифелей карандашей, смешанный с глиной.
- Металлургия: Используется в качестве смазки при высоких температурах, а также для изготовления электродов в электродуговых печах.
- Машиностроение: В качестве сухого смазочного материала, особенно в условиях высоких температур, где жидкие смазки неэффективны.
- Электроника: В производстве батареек, электродов, щеток электродвигателей.
- Ядерная энергетика: В качестве замедлителя нейтронов в ядерных реакторах.
Вопрос 5
Сравнение свойств металлов и неметаллов
| Признаки сравнения | Металлы | Неметаллы | Примечания |
|---|---|---|---|
| Положение в Периодической системе | I-III группы, или в нижней части IV-VI групп. Только из металлов состоят Б-группы. | I (водород), IV-VIIIA-группы, выше диагонали бор-астат | Элементы VIIIA-группы (благородные газы) относятся к неметаллам только по физическим свойствам. |
| Особенности строения атомов: — число е во внешнем слое | 1-3 | 4-8 | Слева направо по периоду радиус уменьшается, а сверху вниз по подгруппе — растет. |
| — радиус атома | Сравнительно большой | Сравнительно небольшой | Слева направо по периоду радиус уменьшается, а сверху вниз по подгруппе — растет. |
| Химическая связь в простом веществе | Металлическая | Ковалентная неполярная | Некоторые металлы при высокой температуре могут образовывать ковалентные связи, например, Li₂ |
| Способность к аллотропии | Белое и серое олово | Алмаз и графит, кислород и озон, белый и красный фосфор, модификации серы и т.д. | Для неметаллов аллотропия более характерна, чем для металлов |
| Физические свойства: — блеск — твердость — электропроводность — теплопроводность — ковкость | + | — | Но у графита и иода металлический блеск. Но ртуть – жидкость. Но алмаз – одно из самых твердых веществ. Но графит электропроводен. |
Для сравнения свойств металлов и неметаллов рассмотрим несколько ключевых признаков:
1. Положение в Периодической системе:
— Металлы преимущественно располагаются в I-III группах главной подгруппы, а также в нижней части IV-VI групп. Все элементы побочных подгрупп (Б-группы) являются металлами. Это объясняется тем, что для металлов характерно небольшое число электронов на внешнем энергетическом уровне, которые они легко отдают.
— Неметаллы занимают верхний правый угол Периодической системы. К ним относится водород (I группа), а также элементы IV-VIIIA групп, расположенные выше условной диагонали от бора до астата.
— Примечание: Элементы VIIIA группы, или благородные газы, относятся к неметаллам, но их химические свойства (крайне низкая реакционная способность) сильно отличаются от других неметаллов. В контексте физических свойств они рассматриваются как неметаллы.
2. Особенности строения атомов:
— Число электронов на внешнем слое:
- У Металлов на внешнем энергетическом уровне обычно находится 1-3 электрона. Это способствует их склонности к отдаче электронов и образованию положительных ионов.
- У Неметаллов на внешнем слое, как правило, 4-8 электронов (за исключением водорода и гелия). Это обуславливает их способность принимать электроны или образовывать общие электронные пары.
— Радиус атома:
- Металлы имеют сравнительно большие атомные радиусы, что связано с меньшим притяжением внешних электронов к ядру и их легкой отдаваемостью.
- Неметаллы обладают сравнительно небольшими атомными радиусами, так как электроны внешнего слоя сильнее притягиваются к ядру.
— Примечание: Важно помнить об общих закономерностях изменения атомного радиуса в Периодической системе: он уменьшается слева направо по периоду (из-за увеличения заряда ядра и числа электронов на одном уровне) и увеличивается сверху вниз по подгруппе — растет (из-за добавления новых электронных слоев).
3. Химическая связь в простом веществе:
— В простых веществах Металлы образуют металлическую связь. Это особый тип связи, при котором атомы металла находятся в узлах кристаллической решетки, а внешние электроны свободно перемещаются по всему объему кристалла, образуя «электронный газ».
— Неметаллы в простых веществах обычно образуют ковалентную неполярную связь. Это происходит за счет образования общих электронных пар между одинаковыми атомами неметалла (например, O2, N2, Cl2, S8).
— Примечание: Некоторые металлы, особенно при высоких температурах или в газообразном состоянии, могут образовывать ковалентные связи, например, димер лития (Li2).
4. Способность к аллотропии:
— Аллотропия – это существование одного и того же химического элемента в виде нескольких простых веществ, различающихся по строению и свойствам.
— У Металлов аллотропия встречается реже и проявляется, например, у олова (белое и серое олово, различающиеся кристаллической структурой и температурой перехода).
— У Неметаллов аллотропия гораздо более характерна и распространена. Примеры включают: алмаз и графит (для углерода), кислород и озон (для кислорода), белый и красный фосфор (для фосфора), различные модификации серы и т.д.
— Примечание: Большая распространенность аллотропии у неметаллов объясняется разнообразием способов образования ковалентных связей и возможностью формирования различных кристаллических или молекулярных структур.
5. Физические свойства:
— Блеск:
- Металлы обладают характерным металлическим блеском, обусловленным отражением света свободными электронами.
- Неметаллы в большинстве своем не имеют металлического блеска, они могут быть тусклыми, прозрачными или окрашенными.
- Исключения: Но у графита и иода металлический блеск.
— Твердость:
- Металлы обычно твердые (хотя есть исключения, например, щелочные металлы мягкие).
- Неметаллы могут быть как очень твердыми (например, алмаз – самое твердое природное вещество), так и мягкими.
- Исключения: Но алмаз — одно из самых твердых веществ.
— Электропроводность:
- Металлы являются хорошими проводниками электричества благодаря наличию свободных электронов.
- Неметаллы в большинстве своем являются диэлектриками или полупроводниками, плохо проводящими электрический ток.
- Исключения: Но графит электропроводен.
— Теплопроводность:
- Металлы обладают высокой теплопроводностью, что также связано со свободными электронами.
- Неметаллы обычно являются плохими проводниками тепла (теплоизоляторами).
— Ковкость:
- Металлы ковки и пластичны, что позволяет им изменять форму под давлением без разрушения. Это свойство используется для изготовления проволоки, листов и других изделий.
- Неметаллы обычно хрупкие и нековкие; они разрушаются при механическом воздействии.
— Исключения: Но ртуть — жидкость.
Часть II
Вопрос 1
1. Бром (Br)
— Тип: Неметалл.
— Объяснение: Бром находится в VII группе, главной подгруппе (галогены) Периодической системы, в правом верхнем углу. Для него характерны свойства неметаллов: он является жидкостью при комнатной температуре, имеет резкий запах, является сильным окислителем.
— Соответствующая буква: Ф
2. Магний (Mg)
— Тип: Металл.
— Объяснение: Магний находится во II группе, главной подгруппе Периодической системы. Это щелочноземельный металл, обладающий характерным металлическим блеском, хорошей электро- и теплопроводностью, ковкостью.
— Соответствующая буква: Т
3. Кальций (Ca)
— Тип: Металл.
— Объяснение: Кальций, как и магний, находится во II группе, главной подгруппе. Это типичный щелочноземельный металл с выраженными металлическими свойствами.
— Соответствующая буква: Л
4. Кислород (O)
— Тип: Неметалл.
— Объяснение: Кислород находится в VI группе, главной подгруппе Периодической системы, в правом верхнем углу. Это газ при комнатной температуре, не имеет металлического блеска, является сильным окислителем.
— Соответствующая буква: Т
5. Вольфрам (W)
— Тип: Металл.
— Объяснение: Вольфрам находится в VI группе, побочной подгруппе (переходные металлы). Это тугоплавкий, очень твердый металл, используемый, например, в нитях накаливания ламп.
— Соответствующая буква: Л
6. Неон (Ne)
— Тип: Неметалл.
— Объяснение: Неон находится в VIII группе, главной подгруппе (благородные газы) Периодической системы. Это инертный газ, не имеющий металлических свойств и крайне малоактивный химически.
— Соответствующая буква: О
7. Золото (Au)
— Тип: Металл.
— Объяснение: Золото находится в I группе, побочной подгруппе. Это благородный металл, известный своим блеском, высокой плотностью, ковкостью и электропроводностью.
— Соответствующая буква: И
8. Иод (I)
— Тип: Неметалл.
— Объяснение: Иод находится в VII группе, главной подгруппе (галогены) Периодической системы, как и бром. При комнатной температуре это твердое вещество с фиолетовым металлическим блеском (одно из исключений), но по химическим свойствам является типичным неметаллом.
— Соответствующая буква: Р
Теперь выберем буквы, соответствующие простым веществам — неметаллам:
— Бром (неметалл) -> Ф
— Кислород (неметалл) -> Т
— Неон (неметалл) -> О
— Иод (неметалл) -> Р
Составляем слово из этих букв: ФТОР.
Проверка:
Слово «Фтор» (Fluorine) происходит от греческого слова «φθόρος» (phthoros), что означает «гибель», «разрушение», «разложение». Это название было дано из-за его чрезвычайно высокой химической активности и способности разрушать многие вещества.
Вопрос 2
Для выполнения задания необходимо распределить предоставленные вещества по группам, основываясь на их химической природе, и определить относительные молекулярные массы для галогенов.
1. Распределение веществ по группам:
Вещества можно разделить на три основные группы, исходя из их положения в Периодической системе химических элементов и характерных свойств: щелочные металлы, благородные газы и галогены.
— Щелочные металлы:
- Na (Натрий): Находится в I группе, главной подгруппе. Это типичный щелочной металл, высокоактивный, с одним электроном на внешнем энергетическом уровне, который легко отдает.
- Li (Литий): Также находится в I группе, главной подгруппе. Является самым легким щелочным металлом, обладает всеми характерными свойствами этой группы.
— Благородные газы:
- Ne (Неон): Находится в VIII группе, главной подгруппе. Это инертный газ, обладающий полностью заполненной внешней электронной оболочкой, что делает его химически малоактивным.
- He (Гелий): Также находится в VIII группе, главной подгруппе. Является вторым по легкости элементом и самым инертным из всех химических элементов.
— Галогены:
- Cl₂ (Хлор): Находится в VII группе, главной подгруппе. Это типичный неметалл, сильный окислитель, образующий двухатомные молекулы.
- Br₂ (Бром): Находится в VII группе, главной подгруппе. Это жидкий неметалл, также сильный окислитель, образующий двухатомные молекулы.
- I₂ (Иод): Находится в VII группе, главной подгруппе. Это твердый неметалл, образующий двухатомные молекулы, проявляет окислительные свойства.
2. Относительные молекулярные массы галогенов:
Относительная молекулярная масса (Mr)– это сумма относительных атомных масс всех атомов, входящих в состав молекулы. Для двухатомных молекул галогенов (Cl₂, Br₂, I₂) она рассчитывается как удвоенная относительная атомная масса соответствующего элемента.
— Для Cl₂:
- Относительная атомная масса хлора (Cl) приблизительно равна 35,5.
- Mr(Cl₂) = 2 * 35,5 = 71.
— Для Br₂:
- Относительная атомная масса брома (Br) приблизительно равна 80.
- Mr(Br₂) = 2 * 80 = 160.
— Для I₂:
- Относительная атомная масса иода (I) приблизительно равна 127.
- Mr(I₂) = 2 * 127 = 254.
Итоговое распределение и массы:
— Щелочные металлы: Na, Li
— Благородные газы: Ne, He
— Галогены: Cl₂, Br₂, I₂
— Относительная молекулярная масса Cl₂: 71
— Относительная молекулярная масса Br₂: 160
— Относительная молекулярная масса I₂: 254

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.






Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!