
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 60-61 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
3. Неверны следующие утверждения, характеризующие неметаллы:
1) образуют ряд электроотрицательности
2) при обычных условиях фтор, хлор и бром — газы
3) иод и сера при обычных условиях — твёрдые вещества
4) атомы этих элементов стремятся отдать электроны с внешнего энергетического слоя
5) молекулы простых веществ образованы за счёт ковалентной неполярной химической связи
4. Установите соответствие между названием вещества и его свойствами.
НАЗВАНИЕ ВЕЩЕСТВА
А) алмаз
Б) графит
СВОЙСТВА ВЕЩЕСТВА
1) твёрдый (царапает стекло)
2) мягкий (оставляет следы на бумаге)
3) бесцветный
4) серый
5) имеет слабый металлический блеск
6) преломляет лучи света
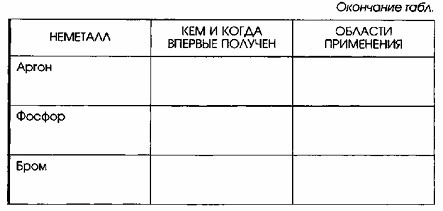
5. Заполните таблицу «Неметаллы». Данные для таблицы найдите с помощью дополнительных источников информации, в том числе Интернета.
6. Расположите следующие простые вещества — неметаллы в порядке возрастания их плотности.
1) иод
2) бром
3) азот
4) хлор
5) водород
6) кремний
7) красный фосфор
7. Расположите следующие простые вещества — неметаллы в порядке возрастания интенсивности их окраски.
1) хлор
2) кислород
3) озон
4) бром
5) азот
6) иод
КОЛИЧЕСТВО ВЕЩЕСТВА. МОЛЯРНАЯ МАССА
Часть I
1. Единицей количества вещества является ☐☐☐☐. Обозначается ☐ или ☐.
Вопрос 3
При обычных условиях бром — жидкость.
Атомы неметаллов стремятся принять на внешний слой электроны.
Ответ: 2, 4.
Вопрос 4
| А | Б |
|---|---|
| 136 | 245 |
Вопрос 5
Неметаллы
| Неметалл | Кем и когда впервые получен | Области применения |
|---|---|---|
| Иод | 1811 г., Б. Куртуа | Металлургия, пищевая промышленность, лекарственные препараты |
| Аргон | 1894 г., Д. Рэлей, У. Рамзай (Англия) | Металлургия, производство люминесцентных ламп |
| Фосфор | 1669 г., Х. Брандт (Германия) | Производство спичек, горючих смесей, химическая промышленность |
| Бром | 1826 г., А. Балар (Франция) | Химический синтез, лекарственные препараты |
Вопрос 6
Водород (0,00009 г/мл), азот (0,00125 г/мл), хлор (0,00321 г/мл), красный фосфор (2,0-2,4 г/мл), кремний (2,33 г/мл), бром (3,11 г/мл), иод (4,93 г/мл).
Ответ: 5347621.
Вопрос 7
Кислород (бесцветный), азот (бесцветный), озон (голубоватый), хлор (желто-зеленоватый), бром (бурый), иод (коричневый).
Ответ: 253146.
§14
Часть 1
Вопрос 1
Единицей количества вещества является МОЛЬ. Обозначается n или v.
Вопрос 3
1) Образуют ряд электроотрицательности.
Это утверждение верно. Неметаллы действительно образуют ряд электроотрицательности, где они располагаются по сравнению с металлами. Электроотрицательность — это способность атома притягивать электроны в химической связи.
2) При обычных условиях фтор, хлор и бром — газы.
Это утверждение неверно. При обычных условиях (температура 0°C и давление 1 атм) фтор (F) и хлор (Cl) действительно являются газами, но бром (Br) находится в жидком состоянии. Это важное отличие, которое делает это утверждение ложным.
3) Иод и сера при обычных условиях — твёрдые вещества.
Это утверждение верно. Иод (I) и сера (S) действительно являются твердыми веществами при обычных условиях.
4) Атомы этих элементов стремятся отдать электроны с внешнего энергетического слоя.
Это утверждение неверно. Неметаллы, как правило, имеют высокую электроотрицательность и стремятся принять электроны, а не отдавать их. Это связано с тем, что они находятся в правой части периодической таблицы, где атомы имеют почти полные внешние электронные оболочки.
5) Молекулы простых веществ образованы за счёт ковалентной неполярной химической связи.
Это утверждение верно, но требует уточнения. Простые молекулы неметаллов, такие как H₂, O₂, N₂ и т.д., действительно образованы ковалентными связями, которые могут быть как полярными, так и неполярными в зависимости от элементов, участвующих в связи. Например, молекула O₂ является неполярной, тогда как HCl — полярной.
Таким образом, неверные утверждения — это 2 и 4.
Вопрос 4
А) Алмаз
1) твёрдый (царапает стекло): Алмаз является самым твёрдым природным минералом, что обусловлено его кристаллической решеткой, где каждый атом углерода ковалентно связан с четырьмя другими атомами углерода в тетраэдрической конфигурации. Эта прочная структура позволяет ему царапать большинство других материалов, включая стекло.
3) бесцветный: Чистый алмаз бесцветен и прозрачен. Его цвет может варьироваться из-за примесей, но в идеальном состоянии он не имеет цвета.
6) преломляет лучи света: Алмаз обладает высоким показателем преломления (около 2,42), что приводит к сильному преломлению и дисперсии света, создавая его характерный блеск и «игру света» (дисперсию).
Б) Графит
2) мягкий (оставляет следы на бумаге): Графит очень мягкий. Его структура состоит из слоев атомов углерода, расположенных в гексагональные кольца. Эти слои слабо связаны между собой (ван-дер-ваальсовы силы), что позволяет им легко скользить друг относительно друга. Именно поэтому графит используется в карандашах — он легко оставляет следы на бумаге.
4) серый: Графит обычно имеет тёмно-серый или чёрный цвет.
5) имеет слабый металлический блеск: Графит обладает тусклым, слабым металлическим блеском, что отличает его от полностью матовых веществ. Это связано с наличием делокализованных электронов в его структуре, которые могут поглощать и отражать свет.
Соответствие:
А) Алмаз — 1, 3, 6
Б) Графит — 2, 4, 5
Вопрос 5
Неметаллы
| Неметалл | Кем и когда впервые получен | Области применения |
|---|---|---|
| Иод | 1811 г., Б. Куртуа | Металлургия, пищевая промышленность, лекарственные препараты |
| Аргон | 1894 г., Д. Рэлей, У. Рамзай (Англия) | Металлургия, производство люминесцентных ламп |
| Фосфор | 1669 г., Х. Брандт (Германия) | Производство спичек, горючих смесей, химическая промышленность |
| Бром | 1826 г., А. Балар (Франция) | Химический синтез, лекарственные препараты |
1. Иод
Открытие:
— Иод был открыт в 1811 году французским химиком Бернаром Куртуа.
— Открытие произошло случайно, когда Куртуа обрабатывал золу морских водорослей (используемую для производства селитры) серной кислотой. Он заметил выделение фиолетового пара, который при охлаждении конденсировался в блестящие черные кристаллы. Это был новый элемент, названный «иодом» (от греческого «iodes» — фиолетовый).
Области применения:
— Металлургия: Иод используется в процессах очистки некоторых металлов, таких как титан, цирконий и гафний, с помощью так называемого иодидного рафинирования (процесс ван Аркеля). Он также может быть компонентом некоторых сплавов.
— Пищевая промышленность: Самое известное применение — йодирование поваренной соли для профилактики заболеваний щитовидной железы (например, эндемического зоба). Иод также может использоваться как дезинфицирующее средство для оборудования.
— Лекарственные препараты: Иод и его соединения широко применяются в медицине как антисептики (например, спиртовой раствор йода, повидон-йод для дезинфекции ран и кожи перед операциями). Он также является важным компонентом гормонов щитовидной железы, поэтому его соединения используются для лечения и диагностики заболеваний щитовидной железы. Радиоактивные изотопы йода применяются в ядерной медицине для диагностики и лечения рака щитовидной железы.
2. Аргон
Открытие:
— Аргон был открыт в 1894 году британскими учеными Лордом Рэлеем и Уильямом Рамзаем.
— Их открытие стало результатом тщательных исследований плотности азота, полученного из воздуха и из химических соединений. Они обнаружили, что азот, выделенный из воздуха, был немного плотнее. Это привело к предположению о наличии в воздухе неизвестного, более тяжелого газа. После удаления всех известных компонентов воздуха (кислорода, азота, углекислого газа) остался инертный газ, который они назвали «аргоном» (от греческого «argos» — инертный, ленивый) из-за его химической неактивности. Это открытие привело к выделению целой группы химических элементов — благородных газов.
Области применения:
— Металлургия: Аргон широко используется в качестве инертной защитной атмосферы при сварке (особенно TIG- и MIG-сварка), резке и плавке металлов, чувствительных к окислению (например, алюминий, титан, нержавеющая сталь). Он предотвращает взаимодействие расплавленного металла с кислородом и азотом воздуха, обеспечивая прочное и чистое соединение. Также применяется в производстве полупроводников для создания инертной среды.
— Производство люминесцентных ламп: Аргон используется для заполнения обычных ламп накаливания (предотвращает испарение нити накала и увеличивает срок службы), а также в люминесцентных и газоразрядных лампах (например, неоновые вывески, плазменные панели) для создания свечения.
— Другие области: Используется в стеклопакетах для улучшения теплоизоляции, в лазерной технике (аргоновые лазеры), для консервации исторических документов и произведений искусства, а также в дайвинге как часть дыхательных смесей.
3. Фосфор
Открытие:
— Фосфор был первым элементом, открытым после античных времен, в 1669 году немецким алхимиком Хеннигом Брандтом.
— Брандт пытался получить философский камень из мочи. В процессе дистилляции и нагревания он получил светящееся в темноте вещество, которое назвал «холодным огнем» (от греческого «phosphoros» — несущий свет). Это был белый фосфор.
Области применения:
— Производство спичек: Красный фосфор является ключевым компонентом в производстве безопасных спичек. Он наносится на боковую поверхность коробка, а также входит в состав головки спички. При трении о шершавую поверхность красный фосфор воспламеняется, поджигая остальные компоненты головки.
— Горючие смеси: Белый фосфор очень легко воспламеняется на воздухе и горит ярким пламенем, выделяя много дыма. Это свойство используется в военных целях для производства дымовых шашек, трассирующих пуль, зажигательных бомб и других пиротехнических средств.
— Химическая промышленность: Фосфор и его соединения являются основой для производства фосфорной кислоты, которая широко используется в производстве удобрений (суперфосфаты), моющих средств, пищевых добавок (например, в газированных напитках). Также фосфор применяется для синтеза различных органических соединений (например, пластификаторов, инсектицидов, огнезащитных материалов).
4. Бром
Открытие:
— Бром был открыт в 1826 году французским химиком Антуаном Баларом.
— Балар выделил его из рассолов соляных болот Монпелье. Он заметил, что при пропускании хлора через рассол образуется красновато-коричневая жидкость с резким запахом. Независимо от него, немецкий химик Карл Якоб Лёвиг также выделил бром в 1825 году, но Балар опубликовал свои результаты первым. Элемент получил название «бром» (от греческого «bromos» — зловоние, резкий запах) из-за его сильного и неприятного запаха.
Области применения:
— Химический синтез: Бром является важным реагентом в органическом и неорганическом синтезе. Он используется для производства широкого спектра химических соединений, включая бромиды, красители, инсектициды, гербициды, антипирены (огнезащитные вещества).
— Лекарственные препараты: Исторически бромиды использовались как седативные средства и противосудорожные препараты (например, бромид калия). В современной медицине их применение ограничено, но бромсодержащие соединения входят в состав некоторых фармацевтических препаратов.
— Другие области: Бромид серебра является ключевым компонентом в традиционной фотографии (фотопленки и фотобумага). Бром также используется в буровых растворах в нефтегазовой промышленности, для очистки воды и в производстве некоторых видов пластмасс.
Таким образом, каждый из этих неметаллов имеет уникальную историю открытия и широкий спектр применений, обусловленных их физическими и химическими свойствами.
Вопрос 6
Для того чтобы расположить вещества в порядке возрастания их плотности, необходимо знать их агрегатное состояние при стандартных условиях (обычно 0°C и 1 атмосфера) и относительную атомную или молекулярную массу, а также особенности строения. Плотность (ρ) определяется как масса вещества на единицу объема (ρ = m/V).
Основные факторы, влияющие на плотность простых веществ-неметаллов:
1. Агрегатное состояние: Газы имеют значительно меньшую плотность, чем жидкости и твердые вещества, поскольку молекулы в газах находятся на больших расстояниях друг от друга.
2. Молекулярная/Атомная масса: Чем тяжелее атомы или молекулы, из которых состоит вещество, тем, как правило, выше его плотность (при прочих равных условиях).
3. Тип кристаллической решетки/упаковка: Для твердых веществ плотность также сильно зависит от того, насколько плотно упакованы атомы или молекулы в кристаллической или аморфной структуре.
Рассмотрим каждое из предложенных веществ:
1. Водород (H₂)
— Агрегатное состояние: Газ.
— Молекулярная масса: H₂ ≈ 2 г/моль. Это наименьшая молекулярная масса среди всех веществ.
— Плотность: 0,00009 г/мл (или 0,09 г/л).
— Обоснование: Водород является самым легким газом, что обусловливает его крайне низкую плотность.
2. Азот (N₂)
— Агрегатное состояние: Газ.
— Молекулярная масса: N₂ ≈ 28 г/моль.
— Плотность: 0,00125 г/мл (или 1,25 г/л).
— Обоснование: Азот также является газом, но его молекулы значительно тяжелее молекул водорода, поэтому его плотность выше.
3. Хлор (Cl₂)
— Агрегатное состояние: Газ.
— Молекулярная масса: Cl₂ ≈ 71 г/моль.
— Плотность: 0,00321 г/мл (или 3,21 г/л).
— Обоснование: Хлор — самый тяжелый из перечисленных газов. Его молекулы значительно тяжелее молекул азота и водорода, что приводит к самой высокой плотности среди газов в этом списке.
4. Красный фосфор (P)
— Агрегатное состояние: Твердое вещество.
— Структура: Представляет собой полимерную структуру, которая значительно плотнее белого фосфора.
— Плотность: 2,0-2,4 г/мл.
— Обоснование: Как твердое вещество, красный фосфор имеет плотность на несколько порядков выше, чем газы. Его плотность зависит от конкретной аллотропной модификации, но всегда находится в этом диапазоне.
5. Кремний (Si)
— Агрегатное состояние: Твердое вещество.
— Структура: Имеет атомную кристаллическую решетку типа алмаза, где атомы кремния прочно связаны друг с другом.
— Плотность: 2,33 г/мл.
— Обоснование: Кремний — твердое вещество с плотной атомной решеткой. Его плотность немного выше, чем у красного фосфора.
6. Бром (Br₂)
— Агрегатное состояние: Жидкость. (Это один из двух элементов, являющихся жидкостями при комнатной температуре, второй — ртуть).
— Молекулярная масса: Br₂ ≈ 160 г/моль.
— Плотность: 3,11 г/мл.
— Обоснование: Бром является жидкостью, что означает гораздо более плотную упаковку молекул по сравнению с газами. Его молекулы значительно тяжелее, чем атомы фосфора или кремния, что приводит к высокой плотности.
7. Иод (I₂)
— Агрегатное состояние: Твердое вещество.
— Молекулярная масса: I₂ ≈ 254 г/моль. Это самая высокая молекулярная масса среди всех перечисленных веществ.
— Плотность: 4,93 г/мл.
— Обоснование: Иод — твердое вещество с молекулярной кристаллической решеткой. Несмотря на то, что это молекулярный кристалл, его очень тяжелые молекулы I₂ обеспечивают самую высокую плотность в данном списке.
Расположение в порядке возрастания плотности:
1. Водород (5) — 0,00009 г/мл
2. Азот (3) — 0,00125 г/мл
3. Хлор (4) — 0,00321 г/мл
4. Красный фосфор (7) — 2,0-2,4 г/мл
5. Кремний (6) — 2,33 г/мл
6. Бром (2) — 3,11 г/мл
7. Иод (1) — 4,93 г/мл
Итоговый ответ: 5347621
Вопрос 7
Для выполнения этого задания необходимо знать характерную окраску каждого из перечисленных простых веществ при стандартных условиях:
1. Хлор (Cl₂): Газ желтовато-зеленого цвета.
2. Кислород (O₂): Бесцветный газ.
3. Озон (O₃): Газ бледно-голубого цвета.
4. Бром (Br₂): Тяжелая жидкость красно-бурого цвета, образующая пары такого же цвета.
5. Азот (N₂): Бесцветный газ.
6. Иод (I₂): Твердое вещество темно-серого цвета с металлическим блеском, при нагревании образует фиолетовые пары.
Теперь расположим их в порядке возрастания интенсивности окраски:
1. Кислород (2): Бесцветный. Это наименее интенсивная окраска (отсутствие цвета).
2. Азот (5): Бесцветный. Также наименее интенсивная окраска. (Порядок кислорода и азота между собой не имеет значения, так как они оба бесцветны).
3. Озон (3): Бледно-голубой газ. Имеет слабую, но различимую окраску.
4. Хлор (1): Желтовато-зеленый газ. Окраска более интенсивная, чем у озона.
5. Бром (4): Красно-бурая жидкость/пары. Окраска значительно более интенсивная, чем у газообразных веществ.
6. Иод (6): Темно-серый твердый/фиолетовые пары. Имеет самую интенсивную окраску в этом списке.
Расположение в порядке возрастания интенсивности окраски:
1. Кислород (2)
2. Азот (5)
3. Озон (3)
4. Хлор (1)
5. Бром (4)
6. Иод (6)
Ответ: 253146
§14
Часть 1
Вопрос 1
1. Единица количества вещества: Моль
Что такое «количество вещества»?
«Количество вещества» (обозначается как \(n\) или \(v\)) — это одна из семи основных физических величин в Международной системе единиц (СИ). Она измеряет число структурных единиц (таких как атомы, молекулы, ионы, электроны или любые другие частицы), содержащихся в образце вещества. Это не масса и не объем, а именно число частиц.
Почему «моль»?
— Определение: Моль (от лат. moles — количество, масса) — это единица измерения количества вещества. Один моль определяется как количество вещества, содержащее столько же структурных единиц, сколько атомов содержится в 0,012 килограмма (или 12 граммах) изотопа углерода-12 (\(^{12}\)C).
— Число Авогадро: Это число структурных единиц известно как постоянная Авогадро (\(N_A\)) и приблизительно равно \(6,022 \times 10^{23}\) моль⁻¹. То есть, 1 моль любого вещества содержит \(6,022 \times 10^{23}\) его структурных единиц.
— Практическое значение: Использование моля позволяет химикам работать с макроскопическими количествами веществ, зная при этом, сколько атомов или молекул они имеют дело. Например, 1 моль воды (\(H_2O\)) весит примерно 18 граммов и содержит \(6,022 \times 10^{23}\) молекул воды. Это намного удобнее, чем оперировать огромными числами отдельных молекул.
2. Обозначения: n или v
— Символы: В химических расчетах и формулах количество вещества традиционно обозначается строчной латинской буквой \(n\) или греческой буквой \(v\) (ню).
— \(n\): Это наиболее распространенное обозначение в международной практике и в большинстве учебников химии.
— \(v\): Также используется, особенно в некоторых русскоязычных источниках и учебниках, как альтернативное обозначение для количества вещества.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.






Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!