
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 77-78 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
4. Составьте формулы веществ по названию.
1) фосфид кальция
2) карбид кремния (IV)
3) хлорид кремния (IV)
4) сульфид цинка
5) оксид фосфора (V)
6) оксид хрома (III)
7) оксид натрия
8) оксид железа (II)
5. Сколько молекул содержится в 48 г оксида серы (IV)?
6. С помощью Интернета и других источников информации (укажите) подготовьте сообщение о применении какого-либо бинарного соединения по следующему плану:
1) формула;
2) название;
3) свойства;
4) применение.
7. Степень окисления марганца в соединении K₂MnO₄ равна:
1) +4
2) +7
3) +6
4) +2
8. Наименьшую степень окисления хром имеет в соединении, формула которого:
1) Cr₂O₃
2) CrO₃
3) K₂CrO₄
4) K₂Cr₂O₇
9. Максимальную степень окисления хлор проявляет в соединении, формула которого:
1) NaCl
2) KClO₃
3) Cl₂O₇
4) KClO
Вопрос 4
1) фосфид кальция Ca₃P₂
2) карбид кремния (IV) SiC
3) хлорид кремния (IV) SiCl₄
4) сульфид цинка ZnS
5) оксид фосфора (V) P₂O₅
6) оксид хрома (III) Cr₂O₃
7) оксид натрия Na₂O
8) оксид железа (II) FeO
Вопрос 5
Дано:
m(SO₂)=48 г
M(SO₂)= 64 г/моль
\(N_A\)=6·10²³ молекул/моль
N(SO₂)=?
n(SO₂)=m/M=48/64= 0,75 (моль)
N(SO₂)= n · \(N_A\) =0,75 · 6·10²³ = 4,5·10²³ (молекул)
Ответ: 4,5·10²³ молекул.
Вопрос 6
Формула: SO₃
Название: Триоксид серы, оксид серы (VI), серный ангидрид.
Свойства: легколетучая бесцветная жидкость с удушливым запахом.
Применение: используется в химической промышленности для получения серной кислоты и в металлургии при обработке руды.
Вопрос 7
K₂⁺Mn⁺⁶O₂⁻⁴
Ответ: 3.
Вопрос 8
1. Cr⁺³₂O⁻²₃
2. Cr⁺⁶O⁻²₃
3. K⁺₂Cr⁺⁶O⁻²₄
4. K⁺₂Cr⁺⁶₂O⁻²₇
Ответ: 1.
Вопрос 9
1. Na⁺Cl⁻
2. K⁺Cl⁺⁵O⁻²₃
3. Cl⁺⁷₂O⁻²₇
4. K⁺Cl⁺O⁻²
Ответ: 3.
Вопрос 4
Составьте формулы веществ по названию
Для составления формул веществ по названию необходимо знать валентности (или степени окисления) элементов, входящих в состав соединения. Общий принцип – сумма зарядов всех атомов в нейтральной молекуле должна быть равна нулю.
1. Фосфид кальция (Ca₃P₂)
Кальций (Ca): Металл из II группы, всегда проявляет валентность II (или степень окисления +2).
Фосфор (P) в фосфидах: Неметалл, в соединениях с металлами проявляет валентность III (или степень окисления -3).
Для нейтральности: \((Ca^{2+})_3(P^{3-})_2\). Общий заряд кальция \(3 \cdot (+2) = +6\). Общий заряд фосфора \(2 \cdot (-3) = -6\). Сумма зарядов \(+6 — 6 = 0\).
Формула: Ca₃P₂
2. Карбид кремния (IV) (SiC)
Кремний (Si): Указана валентность IV (или степень окисления +4).
Углерод (C) в карбидах: В соединениях с менее электроотрицательными элементами (как кремний) проявляет валентность IV (или степень окисления -4).
Для нейтральности: \((Si^{4+})_1(C^{4-})_1\). Общий заряд кремния \(1 \cdot (+4) = +4\). Общий заряд углерода \(1 \cdot (-4) = -4\). Сумма зарядов \(+4 — 4 = 0\).
Формула: SiC
3. Хлорид кремния (IV) (SiCl₄)
Кремний (Si): Указана валентность IV (или степень окисления +4).
Хлор (Cl) в хлоридах: Галоген, в соединениях с менее электроотрицательными элементами (как кремний) проявляет валентность I (или степень окисления -1).
Для нейтральности: \((Si^{4+})_1(Cl^{1-})_4\). Общий заряд кремния \(1 \cdot (+4) = +4\). Общий заряд хлора \(4 \cdot (-1) = -4\). Сумма зарядов \(+4 — 4 = 0\).
Формула: SiCl₄
4. Сульфид цинка (ZnS)
Цинк (Zn): Металл, всегда проявляет валентность II (или степень окисления +2).
Сера (S) в сульфидах: Неметалл, в соединениях с металлами проявляет валентность II (или степень окисления -2).
Для нейтральности: \((Zn^{2+})_1(S^{2-})_1\). Общий заряд цинка \(1 \cdot (+2) = +2\). Общий заряд серы \(1 \cdot (-2) = -2\). Сумма зарядов \(+2 — 2 = 0\).
Формула: ZnS
5. Оксид фосфора (V) (P₂O₅)
Фосфор (P): Указана валентность V (или степень окисления +5).
Кислород (O) в оксидах: Всегда проявляет валентность II (или степень окисления -2).
Для нейтральности: \((P^{5+})_2(O^{2-})_5\). Общий заряд фосфора \(2 \cdot (+5) = +10\). Общий заряд кислорода \(5 \cdot (-2) = -10\). Сумма зарядов \(+10 — 10 = 0\).
Формула: P₂O₅
6. Оксид хрома (III) (Cr₂O₃)
Хром (Cr): Указана валентность III (или степень окисления +3).
Кислород (O) в оксидах: Всегда проявляет валентность II (или степень окисления -2).
Для нейтральности: \((Cr^{3+})_2(O^{2-})_3\). Общий заряд хрома \(2 \cdot (+3) = +6\). Общий заряд кислорода \(3 \cdot (-2) = -6\). Сумма зарядов \(+6 — 6 = 0\).
Формула: Cr₂O₃
7. Оксид натрия (Na₂O)
Натрий (Na): Металл из I группы, всегда проявляет валентность I (или степень окисления +1).
Кислород (O) в оксидах: Всегда проявляет валентность II (или степень окисления -2).
Для нейтральности: \((Na^{1+})_2(O^{2-})_1\). Общий заряд натрия \(2 \cdot (+1) = +2\). Общий заряд кислорода \(1 \cdot (-2) = -2\). Сумма зарядов \(+2 — 2 = 0\).
Формула: Na₂O
8. Оксид железа (II) (FeO)
Железо (Fe): Указана валентность II (или степень окисления +2).
Кислород (O) в оксидах: Всегда проявляет валентность II (или степень окисления -2).
Для нейтральности: \((Fe^{2+})_1(O^{2-})_1\). Общий заряд железа \(1 \cdot (+2) = +2\). Общий заряд кислорода \(1 \cdot (-2) = -2\). Сумма зарядов \(+2 — 2 = 0\).
Формула: FeO
Вопрос 5
Сколько молекул содержится в 48 г оксида серы (IV)?
Для решения этой задачи нам потребуются следующие понятия и константы:
— Молярная масса (M): Масса одного моля вещества, выраженная в г/моль.
— Количество вещества (n): Измеряется в молях.
— Число Авогадро (\(N_A\)): Количество структурных единиц (атомов, молекул, ионов) в одном моле любого вещества. Его значение приблизительно равно \(6,022 \cdot 10^{23}\) молекул/моль (в данном решении используется округленное значение \(6 \cdot 10^{23}\)).
Дано:
Масса оксида серы (IV) \(m(SO_2) = 48 \, \text{г}\)
Число Авогадро \(N_A = 6 \cdot 10^{23} \, \text{молекул/моль}\)
Найти:
Количество молекул оксида серы (IV) \(N(SO_2)\)
Ход решения:
Шаг 1: Вычисляем молярную массу оксида серы (IV) (\(SO_2\)).
Оксид серы (IV) имеет формулу \(SO_2\).
Атомная масса серы (\(S\)) ≈ \(32 \, \text{г/моль}\)
Атомная масса кислорода (\(O\)) ≈ \(16 \, \text{г/моль}\)
\(M(SO_2) = (1 \cdot \text{Атомная масса } S) + (2 \cdot \text{Атомная масса } O)\)
\(M(SO_2) = 32 \, \text{г/моль} + (2 \cdot 16 \, \text{г/моль}) = 32 \, \text{г/моль} + 32 \, \text{г/моль} =\)
\(= 64 \, \text{г/моль}\)
Шаг 2: Вычисляем количество вещества (число молей) оксида серы (IV).
Используем формулу:
\(n = \frac{m}{M}\)
где:
\(n\) – количество вещества (моли)
\(m\) – масса вещества (граммы)
\(M\) – молярная масса вещества (граммы/моль)
\(n(SO_2) = \frac{48 \, \text{г}}{64 \, \text{г/моль}} = 0,75 \, \text{моль}\)
Это означает, что в \(48 \, \text{г}\) оксида серы (IV) содержится \(0,75 \, \text{моль}\) этого вещества.
Шаг 3: Вычисляем количество молекул оксида серы (IV).
Используем формулу:
\(N = n \cdot N_A\)
где:
\(N\) – количество молекул
\(n\) – количество вещества (моли)
\(N_A\) – число Авогадро
\(N(SO_2) = 0,75 \, \text{моль} \cdot 6 \cdot 10^{23} \, \text{молекул/моль} = 4,5 \cdot 10^{23} \, \text{молекул}\)
Ответ: В \(48 \, \text{г}\) оксида серы (IV) содержится \(4,5 \cdot 10^{23}\) молекул.
Вопрос 6
Сообщение о применении бинарного соединения (SO₃)
Источник информации: Учебники по химии, специализированные химические энциклопедии и справочники, научные статьи, информация с надежных образовательных и промышленных веб-сайтов (например, химические порталы, сайты производителей серной кислоты).
Сообщение о триоксиде серы (серном ангидриде)
1. Формула: \(SO_3\)
2. Название: Триоксид серы, оксид серы (VI), серный ангидрид.
Примечание: Название «серный газ» обычно относится к \(SO_2\) (оксиду серы (IV), сернистому ангидриду). \(SO_3\) является основным компонентом «олеума» (дымящей серной кислоты) и ключевым промежуточным продуктом в производстве серной кислоты.
3. Свойства:
Физические свойства:
В стандартных условиях \(SO_3\) существует в нескольких полиморфных модификациях (альфа-, бета-, гамма-). Гамма-\(SO_3\) (наиболее распространенная форма) представляет собой бесцветную легколетучую жидкость с температурой плавления около 16,9 °C и температурой кипения около 44,8 °C. Имеет резкий, удушливый запах. Очень гигроскопичен, то есть активно поглощает влагу из воздуха, образуя мельчайшие капельки серной кислоты, что выглядит как «дым».
Химические свойства:
Является типичным кислотным оксидом.
Чрезвычайно активно реагирует с водой с выделением большого количества теплоты, образуя серную кислоту:
\((SO_3 (г) + H_2O (ж) \rightarrow H_2SO_4 (ж) + тепло)\)
Реагирует с основными оксидами и щелочами, образуя сульфаты:
\((SO_3 + CaO \rightarrow CaSO_4)\)
\((SO_3 + 2NaOH \rightarrow Na_2SO_4 + H_2O)\)
Является сильным окислителем при высоких температурах.
4. Применение:
Основное и наиболее важное применение триоксида серы – это производство серной кислоты (\(H_2SO_4\)) контактным способом. Этот процесс включает следующие стадии:
Получение \(SO_2\) (сжигание серы или обжиг сульфидных руд).
Окисление \(SO_2\) до \(SO_3\) в присутствии катализатора (\(V_2O_5\)) при повышенной температуре:
Поглощение \(SO_3\) концентрированной серной кислотой для получения олеума (\(H_2S_2O_7\)), который затем разбавляют водой до нужной концентрации серной кислоты. Это делается для предотвращения образования тумана серной кислоты, который трудно улавливать.
\((SO_3 (г) + H_2SO_4 (ж) \rightarrow H_2S_2O_7 (ж))\)
\((H_2S_2O_7 (ж) + H_2O (ж) \rightarrow 2H_2SO_4 (ж))\)
Серная кислота, в свою очередь, является одним из важнейших продуктов химической промышленности и используется:
- В производстве удобрений (например, суперфосфата, сульфата аммония).
- В нефтепереработке.
- В металлургии (травление металлов, производство цветных металлов).
- В производстве химических волокон, пластмасс, красителей, взрывчатых веществ.
- В аккумуляторной промышленности (электролит).
- В органическом синтезе.
Таким образом, \(SO_3\) является ключевым промежуточным продуктом для одной из самых массовых и важных отраслей химической промышленности.
Вопрос 7
Степень окисления марганца в соединении \(K_2MnO_4\)
Для определения степени окисления марганца (Mn) в соединении \(K_2MnO_4\), мы используем правило, что сумма степеней окисления всех атомов в нейтральной молекуле равна нулю.
Известные степени окисления:
Калий (K) – элемент первой группы, всегда имеет степень окисления \(+1\).
Кислород (O) – в большинстве соединений имеет степень окисления \(-2\).
Пусть степень окисления марганца будет \(x\).
Соединение: \(K_2MnO_4\)
Уравнение для суммы степеней окисления:
\((2 \cdot (+1)) + (1 \cdot x) + (4 \cdot (-2)) = 0\)
\((+2) + x + (-8) = 0\)
\((x — 6 = 0)\)
\((x = +6)\)
Следовательно, степень окисления марганца в \(K_2MnO_4\) равна \(+6\).
Ответ: 3) +6
Вопрос 8
Наименьшая степень окисления хрома
Чтобы найти наименьшую степень окисления хрома, необходимо рассчитать ее для каждого из предложенных соединений.
1. \(Cr_2O_3\)
Кислород (O) имеет степень окисления \(-2\).
Пусть степень окисления хрома (Cr) будет \(x\).
\((2 \cdot x) + (3 \cdot (-2)) = 0\)
\((2x — 6 = 0)\)
\((2x = 6)\)
\((x = +3)\)
Степень окисления хрома в \(Cr_2O_3\) равна \(+3\).
2. \(CrO_3\)
Кислород (O) имеет степень окисления \(-2\).
Пусть степень окисления хрома (Cr) будет \(x\).
\((1 \cdot x) + (3 \cdot (-2)) = 0\)
\((x — 6 = 0)\)
\((x = +6)\)
Степень окисления хрома в \(CrO_3\) равна \(+6\).
3. \(K_2CrO_4\)
Калий (K) имеет степень окисления \(+1\).
Кислород (O) имеет степень окисления \(-2\).
Пусть степень окисления хрома (Cr) будет \(x\).
\((2 \cdot (+1)) + (1 \cdot x) + (4 \cdot (-2)) = 0\)
\((+2 + x — 8 = 0)\)
\((x — 6 = 0)\)
\((x = +6)\)
Степень окисления хрома в \(K_2CrO_4\) равна \(+6\).
4. \(K_2Cr_2O_7\)
Калий (K) имеет степень окисления \(+1\).
Кислород (O) имеет степень окисления \(-2\).
Пусть степень окисления хрома (Cr) будет \(x\).
\((2 \cdot (+1)) + (2 \cdot x) + (7 \cdot (-2)) = 0\)
\((+2 + 2x — 14 = 0)\)
\((2x — 12 = 0)\)
\((2x = 12)\)
\((x = +6)\)
Степень окисления хрома в \(K_2Cr_2O_7\) равна \(+6\).
Сравнивая полученные значения: \(+3\), \(+6\), \(+6\), \(+6\).
Наименьшая степень окисления хрома наблюдается в соединении \(Cr_2O_3\).
Ответ: 1) \(Cr_2O_3\)
Вопрос 9
Максимальная степень окисления хлора
Чтобы найти максимальную степень окисления хлора, необходимо рассчитать ее для каждого из предложенных соединений.
1. \(NaCl\)
Натрий (Na) имеет степень окисления \(+1\).
Пусть степень окисления хлора (Cl) будет \(x\).
\((1 \cdot (+1)) + (1 \cdot x) = 0\)
\((+1 + x = 0)\)
\((x = -1)\)
Степень окисления хлора в \(NaCl\) равна \(-1\).
2. \(KClO_3\)
Калий (K) имеет степень окисления \(+1\).
Кислород (O) имеет степень окисления \(-2\).
Пусть степень окисления хлора (Cl) будет \(x\).
\((1 \cdot (+1)) + (1 \cdot x) + (3 \cdot (-2)) = 0\)
\((+1 + x — 6 = 0)\)
\((x — 5 = 0)\)
\((x = +5)\)
Степень окисления хлора в \(KClO_3\) равна \(+5\).
3. \(Cl_2O_7\)
Кислород (O) имеет степень окисления \(-2\).
Пусть степень окисления хлора (Cl) будет \(x\).
\((2 \cdot x) + (7 \cdot (-2)) = 0\)
\((2x — 14 = 0)\)
\((2x = 14)\)
\((x = +7)\)
Степень окисления хлора в \(Cl_2O_7\) равна \(+7\).
4. \(KClO\)
Калий (K) имеет степень окисления \(+1\).
Кислород (O) имеет степень окисления \(-2\).
Пусть степень окисления хлора (Cl) будет \(x\).
\((1 \cdot (+1)) + (1 \cdot x) + (1 \cdot (-2)) = 0\)
\((+1 + x — 2 = 0)\)
\((x — 1 = 0)\)
\((x = +1)\)
Степень окисления хлора в \(KClO\) равна \(+1\).
Сравнивая полученные значения: \(-1\), \(+5\), \(+7\), \(+1\).
Максимальная степень окисления хлора наблюдается в соединении \(Cl_2O_7\). Это соответствует высшей степени окисления хлора, так как он находится в VII группе периодической системы.
Ответ: 3) \(Cl_2O_7\)

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.


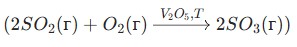



Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!