
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 81-82 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
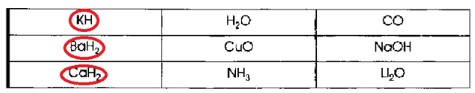
3. Поиграйте в «крестики-нолики». Покажите выигрышный путь, который составляют формулы гидридов.
| KH | H₂O | CO |
| BaH₂ | CuO | NaOH |
| CaH₂ | NH₃ | Li₂O |
4. Напишите формулы оксидов и летучих водородных соединений следующих химических элементов:
1) углерода (IV)
2) азота (III)
3) серы (VI)
5. Дополните таблицу.
| НАЗВАНИЕ ОКСИДА | ФОРМУЛА | НАХОЖДЕНИЕ В ПРИРОДЕ |
|---|---|---|
| Оксид водорода | ||
| CO2 | ||
| Al2O3, SiO2 |
6. Назовите оксиды азота и рассчитайте массовую долю азота в них.
- N2O _______________ w(N) =
- NO _______________w(N) =
- N2O3_______________ w(N) =
- NO2 _______________w(N) =
- N2O5_______________ w(N) =
Сделайте вывод: с увеличением с. о. азота в оксиде массовая доля данного химического элемента ________ Постройте схематический график данной зависимости.
7. Сколько м³ содержится в 45,75 кг оксида хлора (VII)?
8. Найдите количество вещества атомов кислорода и атомов фос-
фора, которое содержится в оксиде фосфора (III) массой 220 г.
1) n( )=
2) Анализ формулы оксида фосфора (III)
показывает, что n(P) = 2 · n( ), а n(O) = 3 · n( )
3) N(P) =
4) N(O) =
Вопрос 3
Вопрос 4
CO₂, CH₄
N₂O₃, NH₃
SO₃, сера в с.о. +6 не имеет водородного соединения
Вопрос 5
| Название оксида | Формула | Нахождение в природе |
|---|---|---|
| Оксид водорода | H₂O | Гидросфера |
| Оксид углерода (IV) | CO₂ | Атмосфера |
| Оксид алюминия, оксид кремния (IV) | Al₂O₃, SiO₂ | Литосфера |
Вопрос 6
N₂O – оксид азота (I)
ω(N) = (2 · Ar(N) / Mr(N₂O)) · 100% = (2 · 14 / (2 · 14 + 16)) · 100% = (28 / 44) · 100% = 63,6%
NO – оксид азота (II)
ω(N) = (Ar(N) / Mr(NO)) · 100% = (14 / (14 + 16)) · 100% = (14 / 30) · 100% = 46,7%
N₂O₃ – оксид азота (III)
ω(N) = (2 · Ar(N) / Mr(N₂O₃)) · 100% = (2 · 14 / (2 · 14 + 3 · 16)) · 100% = (28 / 76) · 100% = 36,8%
NO₂ – оксид азота (IV)
ω(N) = (Ar(N) / Mr(NO₂)) · 100% = (14 / (14 + 2 · 16)) · 100% = (14 / 46) · 100% = 30,4%
N₂O₅ – оксид азота (V)
ω(N) = (2 · Ar(N)) / Mr(N₂O₅) = (2 · 14) / (2 · 14 + 5 · 16) · 100% = 28 / 108 · 100% = 25,9%
Вывод: с увеличением с.о. азота в оксиде массовая доля данного химического элемента уменьшается.
Вопрос 7
Дано:
m(Cl₂O₇) = 45,75 кг = 480000 г
M(Cl₂O₇) = 183 г/моль
Vm = 22,4 л/моль
V(Cl₂O₇) = ?
Решение:
m(Cl₂O₇) = 45,75 кг = 45750 г
M(Cl₂O₇) = 35,5 · 2 + 16 · 7 = 183 (г/моль)
n(Cl₂O₇) = m/M = 45750 / 183 = 250 (моль)
V(Cl₂O₇) = n · Vm = 250 · 22,4 = 5600 (л) = 5,6 (м³)
Ответ: 5,6 м³.
Вопрос 8
Дано:
m(P₂O₃) = 220 г
M(P₂O₃) = 110 г/моль
Nᴀ = 6 · 10²³ атомов/моль
N(P) = ?
N(O) = ?
Решение:
n(P₂O₃) = m/M = 220 / 110 = 2 (моль)
n(Р) = 2 · n(P₂O₃) = 2 · 2 = 4 (моль)
n(О) = 3 · n(P₂O₃) = 3 · 2 = 6 (моль)
N(P) = n · Nᴀ = 4 · 6 · 10²³ = 2,4 · 10²⁴ (атомов)
N(O) = n · Nᴀ = 3 · 6 · 10²³ = 3,6 · 10²⁴ (атомов)
Ответ: 2,4 · 10²⁴ атомов, 3,6 · 10²⁴ атомов.
Вопрос 3
Для игры в «крестики-нолики» с формулами гидридов, необходимо найти ряд из трех формул, которые являются гидридами. Гидриды — это соединения химических элементов с водородом.
- KH — гидрид калия (соединение металла K с водородом H).
- H₂O — вода (соединение неметалла O с водородом H, является гидридом кислорода).
- CO — оксид углерода (соединение углерода с кислородом, не гидрид).
- BaH₂ — гидрид бария (соединение металла Ba с водородом H).
- CuO — оксид меди (соединение меди с кислородом, не гидрид).
- NaOH — гидроксид натрия (соединение металла, кислорода и водорода, не гидрид).
- CaH₂ — гидрид кальция (соединение металла Ca с водородом H).
- NH₃ — аммиак (соединение неметалла N с водородом H, является гидридом азота).
- Li₂O — оксид лития (соединение лития с кислородом, не гидрид).
Выигрышный путь (формулы гидридов):
KH
BaH₂
CaH₂
Вопрос 4
Для написания формул оксидов и летучих водородных соединений необходимо учитывать степень окисления элемента и его положение в Периодической системе.
Общие принципы:
Оксиды: Соединения элемента с кислородом. Кислород в большинстве оксидов имеет степень окисления -2. Формула составляется так, чтобы сумма степеней окисления всех атомов в молекуле была равна нулю.
Летучие водородные соединения (гидриды неметаллов): Для неметаллов, особенно из главных подгрупп IV-VII групп, образуются летучие водородные соединения, в которых неметалл проявляет низшую (отрицательную) степень окисления. Низшая степень окисления для неметаллов определяется как (номер группы — 8). Водород в таких соединениях имеет степень окисления +1.
1) Углерод (IV)
Элемент: Углерод (C)
Заданная степень окисления: +4
Оксид:
Углерод (C) имеет степень окисления +4.
Кислород (O) имеет степень окисления -2.
Чтобы сбалансировать заряды: (+4) + X * (-2) = 0 => X = 2.
Формула оксида: CO₂ (диоксид углерода, углекислый газ).
Летучее водородное соединение:
Углерод находится в IV группе. Низшая степень окисления для углерода: 4 — 8 = -4.
Водород (H) имеет степень окисления +1.
Чтобы сбалансировать заряды: (-4) + X * (+1) = 0 => X = 4.
Формула летучего водородного соединения: CH₄ (метан).
2) Азот (III)
Элемент: Азот (N)
Заданная степень окисления: +3
Оксид:
Азот (N) имеет степень окисления +3.
Кислород (O) имеет степень окисления -2.
Наименьшее общее кратное для 3 и 2 равно 6.
Для азота: 6 / 3 = 2 атома N.
Для кислорода: 6 / 2 = 3 атома O.
Формула оксида: N₂O₃ (триоксид диазота).
Летучее водородное соединение:
Азот находится в V группе. Низшая степень окисления для азота: 5 — 8 = -3.
Водород (H) имеет степень окисления +1.
Чтобы сбалансировать заряды: (-3) + X * (+1) = 0 => X = 3.
Формула летучего водородного соединения: NH₃ (аммиак).
3) Сера (VI)
Элемент: Сера (S)
Заданная степень окисления: +6
Оксид:
Сера (S) имеет степень окисления +6.
Кислород (O) имеет степень окисления -2.
Чтобы сбалансировать заряды: (+6) + X * (-2) = 0 => X = 3.
Формула оксида: SO₃ (триоксид серы).
Летучее водородное соединение:
Сера находится в VI группе. Низшая степень окисления для серы: 6 — 8 = -2.
Летучие водородные соединения образуются, когда неметалл проявляет свою низшую (отрицательную) степень окисления. Например, для серы это H₂S (сероводород), где сера имеет степень окисления -2.
Сера в степени окисления +6 (высшая положительная степень окисления) не образует летучих водородных соединений. Летучие водородные соединения характерны для неметаллов в их низших отрицательных степенях окисления.
Поэтому, для серы в степени окисления +6, летучее водородное соединение не существует.
Итоговый ответ:
CO₂, CH₄
N₂O₃, NH₃
SO₃, сера в с.о. +6 не имеет водородного соединения
Вопрос 5
Для заполнения таблицы необходимо определить химические формулы оксидов по их названиям или наоборот, а также указать их основное местонахождение в природе.
Строка 1: Название оксида — «Оксид водорода»
Определение формулы: «Оксид водорода» — это химическое название соединения водорода с кислородом. Единственное стабильное и широко распространенное соединение водорода и кислорода — это вода.
Водород (H) имеет степень окисления +1.
Кислород (O) имеет степень окисления -2.
Для нейтральной молекулы необходимо два атома водорода на один атом кислорода: 2 × (+1) + 1 × (-2) = 0.
Следовательно, формула — H₂O.
Определение нахождения в природе: Вода (H₂O) является основным компонентом гидросферы Земли, которая включает океаны, моря, реки, озера, ледники, подземные воды и водяной пар в атмосфере.
Следовательно, нахождение в природе — Гидросфера.
Строка 2: Формула — «CO₂»
Определение названия оксида: CO₂ — это соединение углерода (C) и кислорода (O). Это оксид углерода. Чтобы указать правильное название, необходимо определить степень окисления углерода в этом соединении.
Кислород (O) имеет степень окисления -2.
В молекуле CO₂ два атома кислорода, что дает общий отрицательный заряд 2 × (-2) = -4.
Чтобы молекула была нейтральной, углерод должен иметь степень окисления +4.
Следовательно, название оксида — Оксид углерода (IV) (или диоксид углерода, углекислый газ).
Определение нахождения в природе: Углекислый газ (CO₂) является важным компонентом атмосферы Земли. Он играет ключевую роль в парниковом эффекте и фотосинтезе.
Следовательно, нахождение в природе — Атмосфера.
Строка 3: Формулы — «Al₂O₃, SiO₂»
Определение названия оксидов:
Al₂O₃: Это соединение алюминия (Al) и кислорода (O). Алюминий (Al) находится в III группе и имеет степень окисления +3. Кислород (O) имеет степень окисления -2. Два атома алюминия (2 × +3 = +6) и три атома кислорода (3 × -2 = -6) дают нейтральную молекулу. Название — Оксид алюминия (или оксид алюминия (III), глинозем).
SiO₂: Это соединение кремния (Si) и кислорода (O). Кремний (Si) находится в IV группе и в этом соединении имеет степень окисления +4. Кислород (O) имеет степень окисления -2. Один атом кремния (+4) и два атома кислорода (2 × -2 = -4) дают нейтральную молекулу. Название — Оксид кремния (IV) (или диоксид кремния, кремнезем).
Следовательно, название оксидов — Оксид алюминия, оксид кремния (IV).
Определение нахождения в природе:
Оксид алюминия (Al₂O₃) является основным компонентом минералов, таких как боксит (источник алюминия) и корунд (драгоценные камни рубин и сапфир).
Оксид кремния (SiO₂) является наиболее распространенным соединением в земной коре, образуя такие минералы, как кварц, и является основным компонентом песка и многих пород.
Оба эти оксида являются ключевыми составляющими земной коры.
Следовательно, нахождение в природе — Литосфера.
Итоговая заполненная таблица:
| Название оксида | Формула | Нахождение в природе |
|---|---|---|
| Оксид водорода | H₂O | Гидросфера |
| Оксид углерода (IV) | CO₂ | Атмосфера |
| Оксид алюминия, оксид кремния (IV) | Al₂O₃, SiO₂ | Литосфера |
Вопрос 6
Для решения данной задачи необходимо выполнить следующие шаги:
- Определить название каждого оксида азота, исходя из степени окисления азота в нем.
- Рассчитать относительную молекулярную массу (\(\text{Mr}\)) каждого оксида.
- Рассчитать массовую долю азота (\(\omega(\text{N})\)) в каждом оксиде, используя формулу:
\(\omega(\text{элемента}) = \left( \frac{\text{n} \cdot \text{Ar}(\text{элемента})}{\text{Mr}(\text{соединения})} \right) \cdot 100\%\),
где n — количество атомов элемента в формуле, Ar — относительная атомная масса элемента, Mr — относительная молекулярная масса соединения.
Для расчетов используем относительные атомные массы: \(\text{Ar}(\text{N}) \approx 14\), \(\text{Ar}(\text{O}) \approx 16\). - Сделать вывод о зависимости массовой доли азота от его степени окисления.
- Построить схематический график данной зависимости.
Подробное объяснение решения:
1. \(\text{N}_2\text{O}\)
Определение степени окисления и названия: В молекуле \(\text{N}_2\text{O}\) кислород имеет степень окисления -2. Пусть степень окисления азота равна \(\text{x}\). Тогда \(2\text{x} + 1 \cdot (-2) = 0\), откуда \(2\text{x} = 2\), и \(\text{x} = +1\).
Следовательно, это оксид азота (I) (также известный как закись азота или веселящий газ).
Расчет \(\text{Mr}(\text{N}_2\text{O})\): \(\text{Mr}(\text{N}_2\text{O}) = 2 \cdot \text{Ar}(\text{N}) + 1 \cdot \text{Ar}(\text{O}) = 2 \cdot 14 + 1 \cdot 16 = 28 + 16 = 44\).
Расчет \(\omega(\text{N})\): \(\omega(\text{N}) = \left( \frac{2 \cdot \text{Ar}(\text{N})}{\text{Mr}(\text{N}_2\text{O})} \right) \cdot 100\% = \left( \frac{2 \cdot 14}{44} \right) \cdot 100\% = \left( \frac{28}{44} \right) \cdot 100\% \approx 63.64\%\).
Округляем до одного знака после запятой: \(\omega(\text{N}) = 63.6\%\).
2. \(\text{NO}\)
Определение степени окисления и названия: В молекуле \(\text{NO}\) кислород имеет степень окисления -2. Пусть степень окисления азота равна \(\text{x}\). Тогда \(\text{x} + 1 \cdot (-2) = 0\), откуда \(\text{x} = +2\).
Следовательно, это оксид азота (II) (также известный как оксид азота).
Расчет \(\text{Mr}(\text{NO})\): \(\text{Mr}(\text{NO}) = 1 \cdot \text{Ar}(\text{N}) + 1 \cdot \text{Ar}(\text{O}) = 1 \cdot 14 + 1 \cdot 16 = 14 + 16 = 30\).
Расчет \(\omega(\text{N})\): \(\omega(\text{N}) = \left( \frac{1 \cdot \text{Ar}(\text{N})}{\text{Mr}(\text{NO})} \right) \cdot 100\% = \left( \frac{1 \cdot 14}{30} \right) \cdot 100\% = \left( \frac{14}{30} \right) \cdot 100\% \approx 46.67\%\).
Округляем до одного знака после запятой: \(\omega(\text{N}) = 46.7\%\).
3. \(\text{N}_2\text{O}_3\)
Определение степени окисления и названия: В молекуле \(\text{N}_2\text{O}_3\) кислород имеет степень окисления -2. Пусть степень окисления азота равна \(\text{x}\). Тогда \(2\text{x} + 3 \cdot (-2) = 0\), откуда \(2\text{x} = 6\), и \(\text{x} = +3\).
Следовательно, это оксид азота (III).
Расчет \(\text{Mr}(\text{N}_2\text{O}_3)\): \(\text{Mr}(\text{N}_2\text{O}_3) = 2 \cdot \text{Ar}(\text{N}) + 3 \cdot \text{Ar}(\text{O}) = 2 \cdot 14 + 3 \cdot 16 = 28 + 48 = 76\).
Расчет \(\omega(\text{N})\): \(\omega(\text{N}) = \left( \frac{2 \cdot \text{Ar}(\text{N})}{\text{Mr}(\text{N}_2\text{O}_3)} \right) \cdot 100\% = \left( \frac{2 \cdot 14}{76} \right) \cdot 100\% = \left( \frac{28}{76} \right) \cdot 100\% \approx 36.84\%\).
Округляем до одного знака после запятой: \(\omega(\text{N}) = 36.8\%\).
4. \(\text{NO}_2\)
Определение степени окисления и названия: В молекуле \(\text{NO}_2\) кислород имеет степень окисления -2. Пусть степень окисления азота равна \(\text{x}\). Тогда \(\text{x} + 2 \cdot (-2) = 0\), откуда \(\text{x} = +4\).
Следовательно, это оксид азота (IV) (также известный как диоксид азота или бурый газ).
Расчет \(\text{Mr}(\text{NO}_2)\): \(\text{Mr}(\text{NO}_2) = 1 \cdot \text{Ar}(\text{N}) + 2 \cdot \text{Ar}(\text{O}) = 1 \cdot 14 + 2 \cdot 16 = 14 + 32 = 46\).
Расчет \(\omega(\text{N})\): \(\omega(\text{N}) = \left( \frac{1 \cdot \text{Ar}(\text{N})}{\text{Mr}(\text{NO}_2)} \right) \cdot 100\% = \left( \frac{1 \cdot 14}{46} \right) \cdot 100\% = \left( \frac{14}{46} \right) \cdot 100\% \approx 30.43\%\).
Округляем до одного знака после запятой: \(\omega(\text{N}) = 30.4\%\).
5. \(\text{N}_2\text{O}_5\)
Определение степени окисления и названия: В молекуле \(\text{N}_2\text{O}_5\) кислород имеет степень окисления -2. Пусть степень окисления азота равна \(\text{x}\). Тогда \(2\text{x} + 5 \cdot (-2) = 0\), откуда \(2\text{x} = 10\), и \(\text{x} = +5\).
Следовательно, это оксид азота (V).
Расчет \(\text{Mr}(\text{N}_2\text{O}_5)\): \(\text{Mr}(\text{N}_2\text{O}_5) = 2 \cdot \text{Ar}(\text{N}) + 5 \cdot \text{Ar}(\text{O}) = 2 \cdot 14 + 5 \cdot 16 = 28 + 80 = 108\).
Расчет \(\omega(\text{N})\): \(\omega(\text{N}) = \left( \frac{2 \cdot \text{Ar}(\text{N})}{\text{Mr}(\text{N}_2\text{O}_5)} \right) \cdot 100\% = \left( \frac{2 \cdot 14}{108} \right) \cdot 100\% = \left( \frac{28}{108} \right) \cdot 100\% \approx 25.93\%\).
Округляем до одного знака после запятой: \(\omega(\text{N}) = 25.9\%\).
Вывод:
Сравнивая полученные значения, можно заметить, что по мере увеличения степени окисления азота (от +1 до +5) массовая доля азота в оксиде уменьшается. Это происходит потому, что при увеличении степени окисления азота, количество атомов кислорода (с постоянной массой) в молекуле оксида относительно возрастает, что приводит к увеличению общей молекулярной массы соединения за счет кислорода, и, как следствие, снижению процентного содержания азота.
Построение схематического графика зависимости:
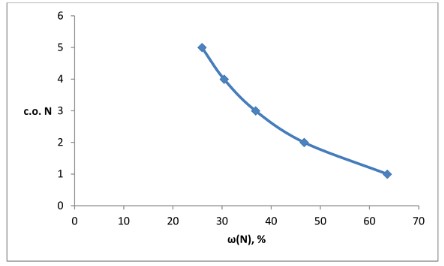
Для построения графика необходимо отложить по осям полученные значения:
По оси X (горизонтальной) отложим массовую долю азота, \(\omega(\text{N})\), в процентах.
По оси Y (вертикальной) отложим степень окисления азота, \(\text{с.о. N}\).
Отметим на графике следующие точки, соответствующие нашим расчетам:
Для \(\text{N}_2\text{O}\): (\(\omega(\text{N}) \approx 63.6\%\), \(\text{с.о. N} = 1\))
Для \(\text{NO}\): (\(\omega(\text{N}) \approx 46.7\%\), \(\text{с.о. N} = 2\))
Для \(\text{N}_2\text{O}_3\): (\(\omega(\text{N}) \approx 36.8\%\), \(\text{с.о. N} = 3\))
Для \(\text{NO}_2\): (\(\omega(\text{N}) \approx 30.4\%\), \(\text{с.о. N} = 4\))
Для \(\text{N}_2\text{O}_5\): (\(\omega(\text{N}) \approx 25.9\%\), \(\text{с.о. N} = 5\))
Соединив эти точки плавной линией, мы получим график, который наглядно покажет обратную зависимость: по мере увеличения степени окисления азота, его массовая доля в оксиде уменьшается. График будет иметь вид нисходящей кривой.
Вопрос 7
Дано: масса вещества 45,75 кг, молярная масса 183 г/моль, молярный объем газа при н.у. — 22,4 л/моль.
Для начала переведем массу из килограммов в граммы: 45,75 кг = 45750 г.
Далее вычисляем количество вещества по формуле: n = m / M = 45750 / 183 = 250 моль.
Теперь найдем объем по формуле V = n · Vm = 250 · 22,4 = 5600 литров.
И, наконец, переведем литры в кубические метры: 5600 л = 5,6 м³.
Ответ: 5,6 м³.
Вопрос 8
Дано: масса 220 г, молярная масса оксида фосфора (III) — 110 г/моль, число Авогадро — 6 · 10²³.
Сначала определим количество вещества самого оксида: n(P₂O₃) = 220 / 110 = 2 моль.
По формуле оксида видно, что в одной молекуле содержится 2 атома фосфора и 3 атома кислорода.
Значит, количество вещества фосфора: n(P) = 2 · 2 = 4 моль, а количество вещества кислорода: n(O) = 3 · 2 = 6 моль.
Чтобы найти число атомов, умножаем количество вещества на число Авогадро:
N(P) = 4 · 6 · 10²³ = 2,4 · 10²⁴ атомов,
N(O) = 6 · 6 · 10²³ = 3,6 · 10²⁴ атомов.
Ответ: 2,4 · 10²⁴ атомов фосфора и 3,6 · 10²⁴ атомов кислорода.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!