
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 83-84 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
Часть I
1. Признаки оснований:
— ________ вещества;
— состоят из простых ионов _______ (кроме NH₄⁺) и сложных ________ — ионов ОН⁻;
— общая формула оснований: Мⁿ⁺(ОН)ₙ, где n — заряд иона, равный с. о. металла.
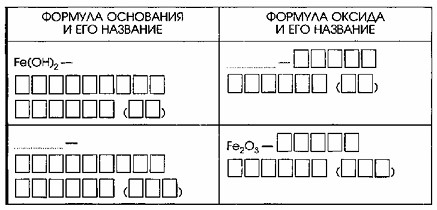
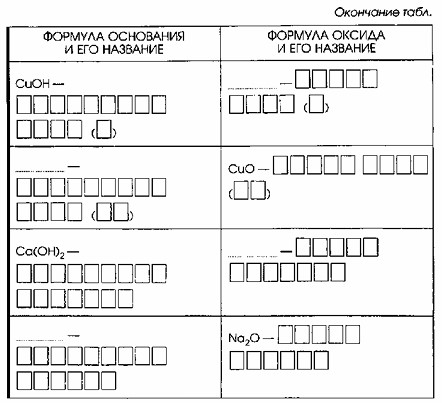
4. Каждому основанию соответствует свой оксид металла. Дополните таблицу «Основания и соответствующие им оксиды».
5. Щёлочи изменяют окраску ______________________________. Дополните таблицу «Изменение окраски индикатора в щелочной среде».
| ИНДИКАТОР | ОКРАСКА В НЕЙТРАЛЬНОЙ СРЕДЕ | ОКРАСКА В ЩЕЛОЧНОЙ СРЕДЕ |
|---|---|---|
| Малиновая | ||
| Метилоранж | ||
| Фиолетовая |
Часть I
Вопрос 1
Признаки оснований:
- СЛОЖНЫЕ вещества
- Состоят из простых ионов МЕТАЛЛОВ (кроме NH₄⁺) и сложных ГИДРОКСИД-ионов ОН⁻
Вопрос 4
Основания и соответствующие им оксиды
| Формула основания и его название | Формула оксида и его название |
|---|---|
| Fe(OH)₂ – гидроксид железа (II) | FeO – оксид железа (II) |
| Fe(OH)₃ – гидроксид железа (III) | Fe₂O₃ – оксид железа (III) |
| CuOH – гидроксид меди (I) | Cu₂O – оксид меди (I) |
| Cu(OH)₂ – гидроксид меди (II) | CuO – оксид меди (II) |
| Ca(OH)₂ – гидроксид кальция | CaO – оксид кальция |
| NaOH – гидроксид натрия | Na₂O – оксид натрия |
Вопрос 5
Щелочи изменяют окраску ИНДИКАТОРОВ.
Изменение окраски индикатора в щелочной среде
| Индикатор | Окраска индикатора в нейтральной среде | Окраска индикатора в щелочной среде |
|---|---|---|
| Фенолфталеин | Бесцветная | Малиновая |
| Метилоранж | Оранжевый | Желтый |
| Лакмус | Фиолетовая | Синяя |
Часть I
Вопрос 1
Признаки оснований — это свойства, по которым можно распознать, что перед нами основание. Давайте подробно разберём каждый пункт:
Первая строка: «________ вещества»
Здесь пропущено слово «сложные», потому что основания всегда представляют собой соединения, состоящие из двух и более элементов. Они не могут быть простыми веществами (например, как водород H₂ или железо Fe), так как включают в себя как минимум металл и группу ОН⁻ (гидроксид-ион).
Вторая строка: «состоят из простых ионов _______ (кроме NH₄⁺) и сложных ________ — ионов ОН⁻»
Пропущенные слова: «металлов» и «гидроксид». Основания строятся из ионов металлов (например, Na⁺, Ca²⁺, Al³⁺), к которым присоединяются гидроксид-ионы ОН⁻. Исключением является аммоний (NH₄⁺), который также может образовывать основания, но по строению он неметаллический ион. Поэтому уточнение «кроме NH₄⁺» здесь уместно.
Таким образом, признаки оснований:
— сложные вещества (то есть составные, не простые);
— состоят из простых ионов металлов (кроме NH₄⁺) и сложных гидроксид-ионов ОН⁻;
— имеют общую формулу , где — заряд иона металла.
Вопрос 4
Для заполнения таблицы «Основания и соответствующие им оксиды» необходимо руководствоваться основным правилом: металл в основании (гидроксиде) и в соответствующем ему оксиде имеет одну и ту же степень окисления (валентность).
Также важно знать правила составления формул и названий.
Гидроксиды (основания): Состоят из иона металла (M) и гидроксид-ионов (OH⁻).
Формула M(OH)ₙ, где `n` — это степень окисления металла.
Название: «гидроксид [название металла] ([степень окисления металла римскими цифрами, если она переменная])».
Оксиды: Состоят из иона металла (M) и иона кислорода (O²⁻).
Формула составляется так, чтобы суммарный заряд был равен нулю.
Название: «оксид [название металла] ([степень окисления металла римскими цифрами, если она переменная])».
Рассмотрим каждую строку таблицы пошагово:
1. Первая строка (Fe(OH)₂).
Дано: Формула основания Fe(OH)₂.
Определение степени окисления железа (Fe): В гидроксиде Fe(OH)₂, каждая гидроксид-группа (OH) имеет заряд -1.
Поскольку таких групп две, их суммарный заряд -2.
Следовательно, железо (Fe) должно иметь степень окисления +2, чтобы молекула была электронейтральной.
Название основания: Гидроксид железа (II).
(Железо — металл с переменной валентностью, поэтому указываем II).
Соответствующий оксид: Поскольку степень окисления железа +2, ион кислорода O имеет заряд -2, формула оксида будет FeO (1 * (+2) + 1 * (-2) = 0).
Название оксида: Оксид железа (II).
2. Вторая строка (Fe₂O₃).
Дано: Формула оксида Fe₂O₃.
Определение степени окисления железа (Fe): В оксиде Fe₂O₃, каждый атом кислорода (O) имеет заряд -2.
Три атома кислорода дают суммарный заряд -6 (3 * (-2)).
Чтобы компенсировать этот заряд, два атома железа должны иметь суммарный заряд +6.
Следовательно, каждый атом железа (Fe) имеет степень окисления +3 (+6 / 2 = +3).
Название оксида: Оксид железа (III).
Соответствующее основание: Поскольку степень окисления железа +3, ион гидроксида OH имеет заряд -1, формула основания будет Fe(OH)₃ (1 * (+3) + 3 * (-1) = 0).
Название основания: Гидроксид железа (III).
3. Третья строка (CuOH).
Дано: Формула основания CuOH.
Определение степени окисления меди (Cu): В гидроксиде CuOH, гидроксид-группа (OH) имеет заряд -1.
Следовательно, медь (Cu) должна иметь степень окисления +1.
Название основания: Гидроксид меди (I).
(Медь — металл с переменной валентностью, поэтому указываем I).
Соответствующий оксид: Поскольку степень окисления меди +1, ион кислорода O имеет заряд -2, для нейтральности потребуется два атома меди на один атом кислорода.
Формула оксида будет Cu₂O (2 * (+1) + 1 * (-2) = 0).
Название оксида: Оксид меди (I).
4. Четвертая строка (CuO).
Дано: Формула оксида CuO.
Определение степени окисления меди (Cu): В оксиде CuO, атом кислорода (O) имеет заряд -2.
Следовательно, медь (Cu) должна иметь степень окисления +2.
Название оксида: Оксид меди (II).
Соответствующее основание: Поскольку степень окисления меди +2, ион гидроксида OH имеет заряд -1, для нейтральности потребуется две гидроксид-группы на один атом меди.
Формула основания будет Cu(OH)₂ (1 * (+2) + 2 * (-1) = 0).
Название основания: Гидроксид меди (II).
5. Пятая строка (Ca(OH)₂).
Дано: Формула основания Ca(OH)₂.
Определение степени окисления кальция (Ca): В гидроксиде Ca(OH)₂, две гидроксид-группы (OH) имеют суммарный заряд -2.
Следовательно, кальций (Ca) должен иметь степень окисления +2.
(Кальций — элемент II группы, его валентность постоянна и равна II).
Название основания: Гидроксид кальция.
(Римская цифра обычно не указывается для металлов с постоянной валентностью).
Соответствующий оксид: Поскольку степень окисления кальция +2, ион кислорода O имеет заряд -2, формула оксида будет CaO (1 * (+2) + 1 * (-2) = 0).
Название оксида: Оксид кальция.
6. Шестая строка (Na₂O).
Дано: Формула оксида Na₂O.
Определение степени окисления натрия (Na): В оксиде Na₂O, атом кислорода (O) имеет заряд -2.
Два атома натрия должны компенсировать этот заряд, поэтому каждый атом натрия (Na) имеет степень окисления +1 (2 * (+1) + 1 * (-2) = 0).
(Натрий — элемент I группы, его валентность постоянна и равна I).
Название оксида: Оксид натрия.
Соответствующее основание: Поскольку степень окисления натрия +1, ион гидроксида OH имеет заряд -1, формула основания будет NaOH (1 * (+1) + 1 * (-1) = 0).
Название основания: Гидроксид натрия.
Вопрос 5
Для заполнения таблицы и предложения необходимо использовать знания о химических индикаторах и их поведении в различных средах, в данном случае — в щелочной.
1. Дополнение предложения:
Щелочи, как и кислоты, являются веществами, которые изменяют цвет специальных веществ, называемых индикаторами. Индикаторы — это органические красители, которые меняют свою окраску в зависимости от кислотности или щелочности среды (значения pH).
Поэтому предложение «Щёлочи изменяют окраску ______________________________.» дополняется словом «ИНДИКАТОРОВ».
2. Заполнение таблицы:
Для заполнения таблицы необходимо вспомнить или найти информацию о трех наиболее распространенных лабораторных индикаторах: фенолфталеине, метилоранже и лакмусе.
Строка 1: Малиновая окраска в щелочной среде.
Известно, что индикатор, который приобретает малиновую окраску в щелочной среде, — это фенолфталеин.
В нейтральной среде фенолфталеин бесцветен.
Таким образом, первая строка будет: Фенолфталеин | Бесцветная | Малиновая.
Строка 2: Метилоранж.
Дано название индикатора — метилоранж.
В нейтральной среде метилоранж имеет оранжевую окраску.
В щелочной среде метилоранж изменяет свою окраску на желтую.
Таким образом, вторая строка будет: Метилоранж | Оранжевый | Желтый.
Строка 3: Фиолетовая окраска в нейтральной среде.
Известно, что индикатор, который имеет фиолетовую окраску в нейтральной среде, — это лакмус.
В щелочной среде лакмус изменяет свою окраску на синюю.
Таким образом, третья строка будет: Лакмус | Фиолетовая | Синяя.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!