
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 85-86 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
Часть II
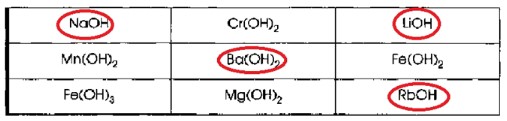
1. Поиграйте в «крестики-нолики». Покажите выигрышный путь, который составляют формулы щелочей.
| NaOH | Cr(OH)₂ | LiOH |
| Mn(OH)₂ | Ba(OH)₂ | Fe(OH)₂ |
| Fe(OH)₃ | Mg(OH)₂ | RbOH |
Впишите в соответствующие столбцы формулы и названия всех приведённых выше оснований.
| РАСТВОРИМЫЕ | НЕРАСТВОРИМЫЕ |
|---|---|
Распределите все приведённые выше основания по другому признаку.
| ОДНОКИСЛОТНЫЕ | ДВУХКИСЛОТНЫЕ | ТРЁХКИСЛОТНЫЕ |
|---|---|---|
2. Составьте формулы оснований и соответствующих им оксидов металлов для следующих ионов:
1) Ag+
2) Pb2+
3) Fe3+
3. В пробирках А и Б находятся известковая вода и раствор гидроксида натрия. Какие качественные реакции необходимо провести, чтобы определить содержимое каждой из пробирок?
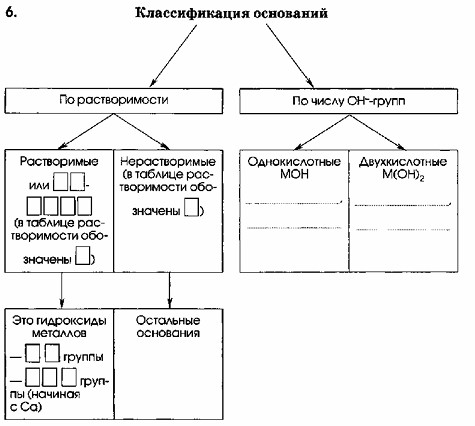
Вопрос 6
| По растворимости | По числу OH—-групп | ||
|---|---|---|---|
| Растворимые или ЩЕЛОЧИ (в таблице растворимости обозначены Р) | Нерастворимые (в таблице растворимости обозначены Н) | Однокислотные MOH NaOH, LiOH | Двухкислотные M(OH)2 Ca(OH)2, Mg(OH)2 |
| Это гидроксиды металлов: IA-группы IIA-группы (начиная с Ca) | Остальные основания (Fe(OH)3, Cu(OH)2) | ||
Часть II
Вопрос 1
| РАСТВОРИМЫЕ | НЕРАСТВОРИМЫЕ |
|---|---|
| NaOH гидроксид натрия | Mn(OH)2 гидроксид марганца (II) |
| Ba(OH)2 гидроксид бария | Fe(OH)3 гидроксид железа (III) |
| LiOH гидроксид лития | Cr(OH)2 гидроксид хрома (II) |
| RbOH гидроксид рубидия | Fe(OH)2 гидроксид железа (II) |
| Mg(OH)2 гидроксид магния |
| ОДНОКИСЛОТНЫЕ | ДВУХКИСЛОТНЫЕ | ТРЁХКИСЛОТНЫЕ |
|---|---|---|
| NaOH | Mn(OH)2 | Fe(OH)3 |
| LiOH | Cr(OH)2 | |
| RbOH | Ba(OH)2 | |
| Fe(OH)2 | ||
| Mg(OH)2 |
Вопрос 2
1. Ag⁺: AgOH → Ag₂O
2. Pb²⁺: Pb(OH)₂ → PbO
3. Fe³⁺: Fe(OH)₃ → Fe₂O₃
Вопрос 3
Качественная реакция на известковую воду проявляется в виде помутнения при пропускании углекислого газа (пробирка Б). Это объясняется следующим химическим взаимодействием:
\(
\text{Ca(OH)}_2 + \text{CO}_2 \rightarrow \text{CaCO}_3\downarrow + \text{H}_2\text{O}
\)
Для подтверждения наличия гидроксида натрия в первой пробирке (пробирка А) можно использовать фенолфталеин. При добавлении этого индикатора раствор приобретает характерный малиновый оттенок, что свидетельствует о щелочной среде.
Вопрос 6
Классификация оснований может быть проведена по нескольким критериям, основными из которых являются растворимость в воде и число гидроксильных групп (OH⁻) в их составе.
1. Классификация по растворимости:
Растворимые основания (ЩЕЛОЧИ):
Это гидроксиды щелочных металлов (элементы IA группы Периодической системы, например, Li, Na, K) и некоторых щелочноземельных металлов (элементы IIA группы, начиная с кальция, т.е. Ca, Sr, Ba).
В таблицах растворимости такие вещества обычно обозначаются буквой «Р» (растворимый).
Примеры: гидроксид натрия (NaOH), гидроксид калия (KOH), гидроксид кальция (Ca(OH)₂).
Нерастворимые основания:
Это гидроксиды большинства других металлов.
В таблицах растворимости они обозначаются буквой «Н» (нерастворимый) или «М» (малорастворимый, который часто относят к нерастворимым в общей классификации).
Примеры: гидроксид железа(III) (Fe(OH)₃), гидроксид меди(II) (Cu(OH)₂), гидроксид магния (Mg(OH)₂).
2. Классификация по числу гидроксильных групп (кислотности):
Этот критерий определяет, сколько гидроксильных групп (OH⁻) содержится в молекуле основания и, соответственно, сколько протонов (H⁺) оно может нейтрализовать в реакции с кислотой.
Однокислотные основания (MOH):
Содержат одну гидроксильную группу (OH⁻) в своей формуле.
Примеры: гидроксид натрия (NaOH), гидроксид лития (LiOH), гидроксид калия (KOH).
Двухкислотные основания (M(OH)₂):
Содержат две гидроксильные группы (OH⁻) в своей формуле.
Примеры: гидроксид кальция (Ca(OH)₂), гидроксид магния (Mg(OH)₂), гидроксид бария (Ba(OH)₂).
Таким образом, заполнение пропусков в диаграмме основано на этих фундаментальных принципах классификации химических оснований.
Часть II
Вопрос 1
Чтобы найти выигрышный путь, нужно определить, какие из этих оснований являются щелочами (т.е. растворимыми в воде).
- NaOH (гидроксид натрия): Щелочь (растворимое основание).
- Cr(OH)₂ (гидроксид хрома(II)): Нерастворимое основание.
- LiOH (гидроксид лития): Щелочь (растворимое основание).
- Mn(OH)₂ (гидроксид марганца(II)): Нерастворимое основание.
- Ba(OH)₂ (гидроксид бария): Щелочь (растворимое основание, хотя его растворимость умеренная, но оно относится к щелочам).
- Fe(OH)₂ (гидроксид железа(II)): Нерастворимое основание.
- Fe(OH)₃ (гидроксид железа(III)): Нерастворимое основание.
- Mg(OH)₂ (гидроксид магния): Нерастворимое основание (малорастворимое).
- RbOH (гидроксид рубидия): Щелочь (растворимое основание).
Таким образом, щелочи в данной сетке: NaOH, LiOH, Ba(OH)₂, RbOH.
Выигрышный путь (диагональ), состоящий из щелочей, это: NaOH, Ba(OH)₂, RbOH. Этот путь отмечен красными кругами на изображении.
Классификация оснований осуществляется по нескольким основным признакам, два из которых используются в данном задании: растворимость в воде и число гидроксильных групп (-OH) в их молекуле.
1. Классификация по растворимости в воде:
Растворимые основания (Щелочи): Это гидроксиды щелочных металлов (элементы IA группы Периодической системы: Li, Na, K, Rb, Cs) и гидроксиды некоторых щелочноземельных металлов (элементы IIA группы, начиная с кальция: Ca, Sr, Ba). Они хорошо растворяются в воде, образуя сильные электролиты.
Из списка: NaOH, LiOH, RbOH (гидроксиды щелочных металлов) и Ba(OH)₂ (гидроксид щелочноземельного металла).
Нерастворимые основания: Это гидроксиды большинства других металлов. Они либо практически не растворяются в воде, либо их растворимость очень мала.
Из списка: Cr(OH)₂, Mn(OH)₂, Fe(OH)₂, Fe(OH)₃, Mg(OH)₂. Гидроксид магния (Mg(OH)₂) считается малорастворимым, но в общей классификации его относят к нерастворимым.
2. Классификация по числу гидроксильных групп (-OH) (кислотности):
Этот признак определяет, сколько групп -OH содержится в формуле основания, что соответствует количеству протонов (H⁺), которые это основание может нейтрализовать в реакции с кислотой.
Однокислотные основания: Содержат одну гидроксильную группу (-OH). Их общая формула часто записывается как MOH.
Из списка: NaOH, LiOH, RbOH.
Двухкислотные основания: Содержат две гидроксильные группы (-OH). Их общая формула часто записывается как M(OH)₂.
Из списка: Cr(OH)₂, Mn(OH)₂, Ba(OH)₂, Fe(OH)₂, Mg(OH)₂.
Трехкислотные основания: Содержат три гидроксильные группы (-OH). Их общая формула часто записывается как M(OH)₃.
Из списка: Fe(OH)₃.
Вопрос 2
Для составления формул оснований и оксидов металлов необходимо учитывать валентность (степень окисления) металла.
Основания представляют собой соединения металла с одной или несколькими гидроксильными группами (-OH). Число гидроксильных групп равно валентности металла. Общая формула основания: Me(OH)ₙ, где n — валентность металла.
Оксиды металлов представляют собой соединения металла с кислородом. Валентность кислорода всегда равна II. Для составления формулы оксида используется правило наименьшего общего кратного для валентностей металла и кислорода. Общая формула оксида: MeₓOᵧ, где x и y определяются валентностями.
1. Для иона Ag⁺ (серебро, валентность I):
Основание: Поскольку валентность серебра равна I, к одному иону серебра присоединяется одна гидроксильная группа. Формула основания: AgOH. Гидроксид серебра(I) является очень неустойчивым соединением и сразу же разлагается на оксид серебра(I) и воду.
Оксид металла: Валентность серебра I, валентность кислорода II. Наименьшее общее кратное для 1 и 2 равно 2. Значит, к двум атомам серебра присоединяется один атом кислорода. Формула оксида: Ag₂O.
Ответ: AgOH → Ag₂O
2. Для иона Pb²⁺ (свинец, валентность II):
Основание: Валентность свинца равна II, поэтому к одному иону свинца присоединяются две гидроксильные группы. Формула основания: Pb(OH)₂. Это гидроксид свинца(II).
Оксид металла: Валентность свинца II, валентность кислорода II. Наименьшее общее кратное для 2 и 2 равно 2. Значит, к одному атому свинца присоединяется один атом кислорода. Формула оксида: PbO.
Ответ: Pb(OH)₂ → PbO
3. Для иона Fe³⁺ (железо, валентность III):
Основание: Валентность железа равна III, поэтому к одному иону железа присоединяются три гидроксильные группы. Формула основания: Fe(OH)₃. Это гидроксид железа(III).
Оксид металла: Валентность железа III, валентность кислорода II. Наименьшее общее кратное для 3 и 2 равно 6. Значит, к двум атомам железа (2 * 3 = 6) присоединяются три атома кислорода (3 * 2 = 6). Формула оксида: Fe₂O₃.
Ответ: Fe(OH)₃ → Fe₂O₃
Вопрос 3
Для определения содержимого пробирок А и Б, содержащих известковую воду (раствор гидроксида кальция, Ca(OH)₂) и раствор гидроксида натрия (NaOH), необходимо провести качественные реакции, которые дают разные, легко наблюдаемые эффекты для каждого вещества.
Шаг 1: Определение известковой воды (Ca(OH)₂)
Известковая вода, или раствор гидроксида кальция, отличается от раствора гидроксида натрия тем, что ион кальция (Ca²⁺) способен образовывать нерастворимый карбонат кальция (CaCO₃) при взаимодействии с углекислым газом.
Качественная реакция: Пропускание углекислого газа (CO₂) через каждый из растворов.
Наблюдаемый эффект: В пробирке, содержащей известковую воду, произойдет помутнение раствора. Это помутнение вызвано образованием белого осадка карбоната кальция, который практически нерастворим в воде.
Химическое уравнение реакции:
Ca(OH)₂ + CO₂ → CaCO₃↓ + H₂O
(Гидроксид кальция + Углекислый газ → Карбонат кальция (осадок) + Вода)
Вывод: Пробирка, в которой наблюдается помутнение при пропускании углекислого газа, содержит известковую воду (Ca(OH)₂). В данном случае, это пробирка Б.
Шаг 2: Определение раствора гидроксида натрия (NaOH)
После того как известковая вода идентифицирована, вторая пробирка будет содержать раствор гидроксида натрия. Для подтверждения этого можно использовать кислотно-основный индикатор. Гидроксид натрия является сильным основанием, и его раствор будет иметь сильно щелочную среду.
Качественная реакция: Добавление индикатора фенолфталеина.
Наблюдаемый эффект: В пробирке, содержащей раствор гидроксида натрия, фенолфталеин изменит свой цвет на малиновый. Фенолфталеин приобретает малиновую окраску в щелочной среде (при pH выше 8.2).
Вывод: Пробирка, в которой фенолфталеин становится малиновым, содержит раствор гидроксида натрия (NaOH). В данном случае, это пробирка А.
Таким образом, последовательное проведение этих двух качественных реакций позволяет однозначно определить содержимое каждой из пробирок.

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!