
Рабочая тетрадь по химии для 8-го класса, написанная под авторством Габриелян, представляет собой незаменимый инструмент для учеников, стремящихся углубить свои знания в области химии. Она не только помогает закрепить теоретические знания, но и развивает практические навыки, необходимые для успешного изучения предмета.
ГДЗ по Химии 8 Класс Страницы 87-88 Рабочая тетрадь (2018) Габриелян — Подробные Ответы
4. Определите заряды ионов металлов и степени окисления элементов в основаниях.
| СОЕДИНЕНИЕ | ЗАРЯД ИОНА МЕТАЛЛА | С.О. ЭЛЕМЕНТОВ |
| Ba(OH)2 | ||
| Al(OH)3 | ||
| KOH |
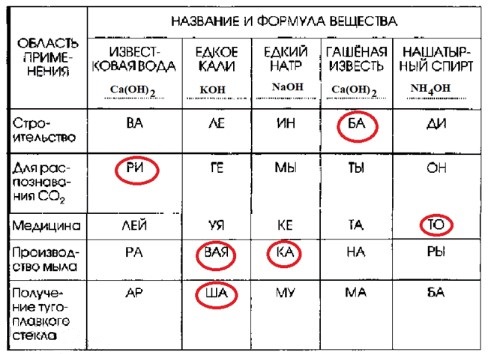
5. Запишите в таблицу «Области применения некоторых оснований» формулы веществ.
| ОБЛАСТЬ ПРИМЕНЕНИЯ | НАЗВАНИЕ И ФОРМУЛА ВЕЩЕСТВА | ||||
| ИЗВЕСТКОВАЯ ВОДА _______ | ЕДКОЕ КАЛИ _______ | ЕДКИЙ HATP _______ | ГАШЁНАЯ ИЗВЕСТЬ _______ | НАШАТЫРНЫЙ СПИРТ _______ | |
| Строительство | BA | ΛΕ | ИН | БА | ДИ |
| Для распознавания СО2 | РИ | ΓΕ | МЫ | ТЫ | ОН |
Окончание табл.
| ОБЛАСТЬ ПРИМЕНЕНИЯ | НАЗВАНИЕ И ФОРМУЛА ВЕЩЕСТВА | ||||
| ИЗВЕСТКОВАЯ ВОДА _______ | ЕДКОЕ КАЛИ _______ | ЕДКИЙ НАТР _______ | ГАШЁНАЯ ИЗВЕСТЬ _______ | НАШАТЫРНЫЙ СПИРТ _______ | |
| Медицина | ЛЕЙ | УЯ | KE | ТА | ТО |
| Производство мыла | РА | ВАЯ | КА | НА | РЫ |
| Получение тугоплавкого стекла | АР | ША | МУ | МА | БА |
Установите соответствие между веществом и областями его применения. Из слогов, соответствующих правильным ответам, вы составите название насыщенного водного раствора гидроксида бария (II): ________
6. Вычислите количество вещества, которое составляют 196 г гидроксида калия. Сколько ионов каждого вида будет содержать эта порция щёлочи?
1) n(________)=
2) Анализ формулы гидроксида калия
показывает, что n(K⁺) = n(________), а n(OH⁻)=2·n(________)
3) N(K⁺) = ________
4) N(OH⁻) = ________
7. Рассчитайте массу 2,5 кмоль гидроксида бария. Сколько ионов каждого вида будет содержать эта порция щёлочи?
Вопрос 4
| Соединение | Заряд иона металла | С.о. элементов |
| Ba(OH)₂ | +2 | Ba⁺²(O⁻²H⁺)₂ |
| Al(OH)₃ | +3 | Al⁺³(O⁻²H⁺)₃ |
| KOH | +1 | K⁺O⁻²H⁺ |
Вопрос 5
Название насыщенного водного раствора гидроксида бария: БАРИТОВАЯ КАША.
Вопрос 6
Дано:
\(m(\text{KOH}) = 196 \, \text{г}\)
\(M(\text{KOH}) = 56 \, \text{г/моль}\)
\(N_A = 6 \cdot 10^{23} \, \text{ионов/моль}\)
Найти:
\(n(\text{KOH}) = ?\)
\(N(\text{K}^+) = ?\)
\(N(\text{OH}^-) = ?\)
Решение:
\(n(\text{KOH}) = \frac{m}{M} = \frac{196}{56} = 3{,}5 \, \text{моль}\)
\(n(\text{K}^+) = n(\text{KOH}) = 3{,}5 \, \text{моль}\)
\(n(\text{OH}^-) = n(\text{KOH}) = 3{,}5 \, \text{моль}\)
\(N(\text{K}^+) = n \cdot N_A = 3{,}5 \cdot 6 \cdot 10^{23} = 2{,}1 \cdot 10^{24} \, \text{ионов}\)
\(N(\text{OH}^-) = n \cdot N_A = 3{,}5 \cdot 6 \cdot 10^{23} = 2{,}1 \cdot 10^{24} \, \text{ионов}\)
Ответ: \(3{,}5 \, \text{моль}\), \(2{,}1 \cdot 10^{24} \, \text{ионов}\)
Вопрос 7
Дано:
\(n(\text{Ba(OH)}_2) = 2{,}5 \, \text{кмоль}\)
\(M(\text{Ba(OH)}_2) = 171 \, \text{г/моль}\)
\(N_A = 6 \cdot 10^{23} \, \text{ионов/моль}\)
Найти:
\(m(\text{Ba(OH)}_2) = ?\)
\(N(\text{Ba}^{2+}) = ?\)
\(N(\text{OH}^-) = ?\)
Решение:
\(n(\text{Ba(OH)}_2) = 2{,}5 \, \text{кмоль} = 2500 \, \text{моль}\)
\(m(\text{Ba(OH)}_2) = n \cdot M = 2500 \cdot 171 = 427500 \, \text{г} = 427{,}5 \, \text{кг}\)
\(n(\text{Ba}^{2+}) = n(\text{Ba(OH)}_2) = 2500 \, \text{моль}\)
\(n(\text{OH}^-) = 2 \cdot n(\text{Ba(OH)}_2) = 2 \cdot 2500 = 5000 \, \text{моль}\)
\(N(\text{Ba}^{2+}) = n \cdot N_A = 2500 \cdot 6 \cdot 10^{23} = 1{,}5 \cdot 10^{27} \, \text{ионов}\)
\(N(\text{OH}^-) = n \cdot N_A = 5000 \cdot 6 \cdot 10^{23} = 3 \cdot 10^{27} \, \text{ионов}\)
Ответ: \(427{,}5 \, \text{кг}\), \(1{,}5 \cdot 10^{27} \, \text{ионов}\), \(3 \cdot 10^{27} \, \text{ионов}\)
Вопрос 4
Для определения заряда ионов металлов и степеней окисления элементов в основаниях, рассмотрим общие правила:
Гидроксидная группа (OH):
В большинстве соединений гидроксидная группа (OH) является анионом с зарядом -1.
Заряд иона металла: В нейтральном соединении сумма зарядов всех ионов должна быть равна нулю.
Зная заряд гидроксидной группы, можно определить заряд иона металла.
Степень окисления (С.О.):
Степень окисления водорода (H) в большинстве соединений равна +1.
Степень окисления кислорода (O) в большинстве соединений равна -2.
Сумма степеней окисления всех атомов в нейтральной молекуле равна нулю.
Степень окисления одноатомного иона равна его заряду.
Применим эти правила к данным соединениям:
Ba(OH)₂ (Гидроксид бария)
Определение заряда иона металла:
Мы видим, что в молекуле Ba(OH)₂ содержится две гидроксидные группы (OH).
Каждая группа OH имеет заряд -1.
Следовательно, общий отрицательный заряд от двух групп OH составляет 2 * (-1) = -2.
Чтобы соединение было нейтральным, ион бария (Ba) должен иметь заряд, компенсирующий этот отрицательный заряд, то есть +2.
Заряд иона металла: Ba²⁺
Определение степеней окисления элементов:
Барий (Ba): Поскольку ион бария имеет заряд +2 (Ba²⁺), его степень окисления равна +2.
Кислород (O): В гидроксидной группе степень окисления кислорода обычно -2.
Водород (H): В гидроксидной группе степень окисления водорода обычно +1.
Проверка: (+2) [Ba] + 2 * ((-2) [O] + (+1) [H]) = +2 + 2 * (-1) = +2 — 2 = 0. Сумма степеней окисления равна нулю, что подтверждает правильность.
С.О. элементов: Ba⁺²(O⁻²H⁺)₂
Al(OH)₃ (Гидроксид алюминия)
Определение заряда иона металла:
В молекуле Al(OH)₃ содержится три гидроксидные группы (OH).
Каждая группа OH имеет заряд -1.
Следовательно, общий отрицательный заряд от трех групп OH составляет 3 * (-1) = -3.
Чтобы соединение было нейтральным, ион алюминия (Al) должен иметь заряд +3.
Заряд иона металла: Al³⁺
Определение степеней окисления элементов:
Алюминий (Al): Поскольку ион алюминия имеет заряд +3 (Al³⁺), его степень окисления равна +3.
Кислород (O): В гидроксидной группе степень окисления кислорода -2.
Водород (H): В гидроксидной группе степень окисления водорода +1.
Проверка: (+3) [Al] + 3 * ((-2) [O] + (+1) [H]) = +3 + 3 * (-1) = +3 — 3 = 0.
С.О. элементов: Al⁺³(O⁻²H⁺)₃
KOH (Гидроксид калия)
Определение заряда иона металла:
В молекуле KOH содержится одна гидроксидная группа (OH).
Группа OH имеет заряд -1.
Чтобы соединение было нейтральным, ион калия (K) должен иметь заряд +1.
Заряд иона металла: K⁺
Определение степеней окисления элементов:
Калий (K): Поскольку ион калия имеет заряд +1 (K⁺), его степень окисления равна +1.
Кислород (O): В гидроксидной группе степень окисления кислорода -2.
Водород (H): В гидроксидной группе степень окисления водорода +1.
Проверка: (+1) [K] + ((-2) [O] + (+1) [H]) = +1 + (-1) = 0.
С.О. элементов: K⁺O⁻²H⁺
Итоговая таблица:
| Соединение | Заряд иона металла | С.о. элементов |
| Ba(OH)₂ | +2 | Ba⁺²(O⁻²H⁺)₂ |
| Al(OH)₃ | +3 | Al⁺³(O⁻²H⁺)₃ |
| KOH | +1 | K⁺O⁻²H⁺ |
Вопрос 5
Для решения данной задачи необходимо выполнить следующие шаги:
- Заполнить формулы веществ в таблице.
- Установить соответствие между каждым веществом и его областями применения, используя общеизвестные химические свойства и применения.
- Извлечь слоги из ячеек, соответствующих правильным ответам, и составить из них итоговое название.
Шаг 1: Заполнение формул веществ в таблице.
Цель этого шага — правильно определить химическую формулу для каждого из пяти оснований, перечисленных в таблице, основываясь на их общепринятых названиях.
Это фундаментальный шаг, так как правильные формулы необходимы для дальнейшего понимания химических свойств и областей применения каждого вещества.
Рассмотрим каждое вещество по отдельности:
1. Известковая вода
Общее название: Известковая вода.
Химическая природа: Это насыщенный водный раствор гидроксида кальция.
Определение формулы:
Кальций (Ca) — это элемент из II группы периодической таблицы, который образует ионы с зарядом +2 (Ca²⁺).
Гидроксид-ион (OH⁻) — это сложный ион с зарядом -1.
Чтобы суммарный заряд соединения был нейтральным, нам нужен один ион Ca²⁺ и два гидроксид-иона (2 × (-1) = -2).
Формула: Ca(OH)₂
Примечание: Известковая вода — это именно раствор гидроксида кальция, но его формула соответствует растворенному веществу.
2. Едкое кали
Общее название: Едкое кали.
Химическая природа: Это гидроксид калия.
Определение формулы:
Калий (K) — это элемент из I группы периодической таблицы, который образует ионы с зарядом +1 (K⁺).
Гидроксид-ион (OH⁻) — это сложный ион с зарядом -1.
Чтобы суммарный заряд соединения был нейтральным, нам нужен один ион K⁺ и один гидроксид-ион.
Формула: KOH
3. Едкий натр
Общее название: Едкий натр.
Химическая природа: Это гидроксид натрия.
Определение формулы:
Натрий (Na) — это элемент из I группы периодической таблицы, который образует ионы с зарядом +1 (Na⁺).
Гидроксид-ион (OH⁻) — это сложный ион с зарядом -1.
Чтобы суммарный заряд соединения был нейтральным, нам нужен один ион Na⁺ и один гидроксид-ион.
Формула: NaOH
4. Гашёная известь
Общее название: Гашёная известь (или пушонка).
Химическая природа: Это гидроксид кальция.
Определение формулы: Как и в случае с известковой водой, это соединение кальция и гидроксид-ионов.
Кальций (Ca²⁺).
Гидроксид-ион (OH⁻).
Формула: Ca(OH)₂
Примечание: «Гашёная известь» — это твердое вещество, получаемое гашением негашеной извести (оксида кальция, CaO) водой. «Известковая вода» — это ее водный раствор. Химически это одно и то же соединение.
5. Нашатырный спирт
Общее название: Нашатырный спирт.
Химическая природа: Это водный раствор аммиака (NH₃).
В растворе аммиак частично реагирует с водой, образуя ионы аммония (NH₄⁺) и гидроксид-ионы (OH⁻).
Часто для обозначения этого раствора используют формулу гидроксида аммония.
Определение формулы:
Аммоний-ион (NH₄⁺) — это сложный ион с зарядом +1.
Гидроксид-ион (OH⁻) — это сложный ион с зарядом -1.
Чтобы суммарный заряд соединения был нейтральным, нам нужен один ион NH₄⁺ и один гидроксид-ион.
Формула: NH₄OH
Примечание: Хотя NH₄OH как стабильная молекула в растворе не существует в значительных количествах (это скорее условное обозначение для равновесия NH₃ + H₂O ⇌ NH₄⁺ + OH⁻), эта формула широко используется в учебной литературе для обозначения водного раствора аммиака как слабого основания.
После выполнения этого шага, верхняя строка таблицы (под названиями веществ) должна быть заполнена следующими формулами:
Известковая вода: Ca(OH)₂
Едкое кали: KOH
Едкий натр: NaOH
Гашёная известь: Ca(OH)₂
Нашатырный спирт: NH₄OH
Эти формулы являются отправной точкой для дальнейшего анализа областей применения.
Шаг 2: Установление соответствия между веществом и областями его применения.
Рассмотрим каждое вещество и его характерные области применения, находя соответствующие слоги в таблице:
Известковая вода (Ca(OH)₂):
Для распознавания CO₂: Известковая вода (раствор гидроксида кальция) широко используется для качественного определения углекислого газа (CO₂). При пропускании CO₂ через известковую воду она мутнеет из-за образования нерастворимого карбоната кальция (CaCO₃).
Соответствующий слог в таблице: РИ
Едкое кали (KOH) — Гидроксид калия:
Производство мыла: Гидроксид калия используется в производстве жидкого мыла (калиевые мыла).
Соответствующий слог в таблице: ВАЯ
Получение тугоплавкого стекла: Соединения калия, включая KOH, используются в производстве специальных видов стекла для придания им определенных свойств, в том числе повышения тугоплавкости.
Соответствующий слог в таблице: ША
Едкий натр (NaOH) — Гидроксид натрия:
Производство мыла: Гидроксид натрия используется в производстве твердого мыла (натриевые мыла).
Соответствующий слог в таблице: КА
Гашёная известь (Ca(OH)₂) — Гидроксид кальция:
Строительство: Гашёная известь является основным компонентом известковых строительных растворов, используемых для штукатурки, кладки и побелки.
Соответствующий слог в таблице: БА
Нашатырный спирт (NH₄OH) — Гидроксид аммония (водный раствор аммиака):
Медицина: Нашатырный спирт применяется в медицине как средство для выведения из обморока (путем раздражения дыхательных путей) и как антисептическое средство для обработки кожи.
Соответствующий слог в таблице: ТО
Шаг 3: Составление названия из слогов.
Соберем слоги, которые были определены как соответствующие правильным областям применения:
БА (из «Гашёная известь» и «Строительство»)
РИ (из «Известковая вода» и «Для распознавания CO₂»)
ТО (из «Нашатырный спирт» и «Медицина»)
ВАЯ (из «Едкое кали» и «Производство мыла»)
КА (из «Едкий натр» и «Производство мыла»)
ША (из «Едкое кали» и «Получение тугоплавкого стекла»)
Соединяя эти слоги в правильном порядке, получаем: БАРИТОВАЯ КАША.
Итоговая заполненная таблица:
Вопрос 6
Шаг 1. Что дано и что нужно найти?
Дано:
Масса вещества: \(m(\text{KOH}) = 196 \, \text{г}\)
Молярная масса вещества: \(M(\text{KOH}) = 56 \, \text{г/моль}\)
Постоянная Авогадро: \(N_A = 6 \cdot 10^{23} \, \text{ионов/моль}\)
Найти:
1. Количество вещества \(n(\text{KOH})\) — сколько моль вещества содержится в 196 г.
2. Сколько ионов калия \(\text{K}^+\) и гидроксид-ионов \(\text{OH}^-\) содержится в этом веществе.
Шаг 2. Что такое KOH и как оно распадается в воде?
KOH — это гидроксид калия, типичное однокислотное основание, которое при растворении в воде полностью диссоциирует на ионы:
\( \text{KOH} \rightarrow \text{K}^+ + \text{OH}^- \)
То есть каждая молекула KOH даёт один ион калия и один гидроксид-ион.
Шаг 3. Вычисляем количество вещества KOH
По формуле:
\( n = \frac{m}{M} \)
\( n(\text{KOH}) = \frac{196}{56} = 3{,}5 \, \text{моль} \)
Это означает, что в 196 г KOH содержится 3,5 моля молекул KOH.
Шаг 4. Сколько ионов получится из 3,5 моль KOH?
По реакции диссоциации:
- из 1 моль KOH образуется 1 моль ионов K⁺ и 1 моль OH⁻
- из 3,5 моль получится:
\(n(\text{K}^+) = 3{,}5 \, \text{моль}\)
\(n(\text{OH}^-) = 3{,}5 \, \text{моль}\)
Шаг 5. Вычисляем число ионов
По формуле:
\( N = n \cdot N_A \)
\( N(\text{K}^+) = 3{,}5 \cdot 6 \cdot 10^{23} = 2{,}1 \cdot 10^{24} \, \text{ионов} \)
\( N(\text{OH}^-) = 3{,}5 \cdot 6 \cdot 10^{23} = 2{,}1 \cdot 10^{24} \, \text{ионов} \)
Итог:
Количество вещества KOH: 3,5 моль
Количество ионов калия: \(2{,}1 \cdot 10^{24}\)
Количество ионов OH⁻: \(2{,}1 \cdot 10^{24}\)
Вопрос 7
Шаг 1. Дано и что нужно найти
Дано:
\(n(\text{Ba(OH)}_2) = 2{,}5 \, \text{кмоль} = 2500 \, \text{моль}\)
\(M(\text{Ba(OH)}_2) = 171 \, \text{г/моль}\)
\(N_A = 6 \cdot 10^{23} \, \text{ионов/моль}\)
Найти:
Массу вещества
Число ионов \(Ba^{2+}\)
Число ионов \(OH^-\)
Шаг 2. Что такое Ba(OH)₂ и как он диссоциирует?
Ba(OH)₂ — это гидроксид бария, типичное двукислотное основание (в составе — два гидроксид-иона).
В воде диссоциирует так:
\( \text{Ba(OH)}_2 \rightarrow \text{Ba}^{2+} + 2\text{OH}^- \)
То есть:
1 моль Ba(OH)₂ даёт 1 моль Ba²⁺ и 2 моль OH⁻
2500 моль даст:
- 2500 моль Ba²⁺
- 5000 моль OH⁻
Шаг 3. Вычисляем массу вещества
\( m = n \cdot M = 2500 \cdot 171 = 427500 \, \text{г} = 427{,}5 \, \text{кг} \)
Шаг 4. Вычисляем число ионов
\( N(\text{Ba}^{2+}) = 2500 \cdot 6 \cdot 10^{23} = 1{,}5 \cdot 10^{27} \)
\( N(\text{OH}^-) = 5000 \cdot 6 \cdot 10^{23} = 3 \cdot 10^{27} \)
Итог:
Масса вещества: 427,5 кг
Ионов Ba²⁺: \(1{,}5 \cdot 10^{27}\)
Ионов OH⁻: \(3 \cdot 10^{27}\)

Любой навык лучше отрабатывать самостоятельной практикой, и решение задач — не исключение. Прежде чем обратиться к подсказкам, стоит попробовать справиться с заданием, опираясь на свои знания. Если дойти до конца удалось — проверить ответ и в случае расхождений сверить своё решение с правильным.





Оставь свой отзыв 💬
Комментариев пока нет, будьте первым!